- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Виды химической связи (10 класс)
Содержание
- 1. Презентация по химии на тему Виды химической связи (10 класс)
- 2. ЦЕЛЬ УРОКА:выявление и оценка степени овладения системой
- 3. Химическая связь – это такое взаимодействие атомов,
- 4. это связь, возникающая между атомами за счет
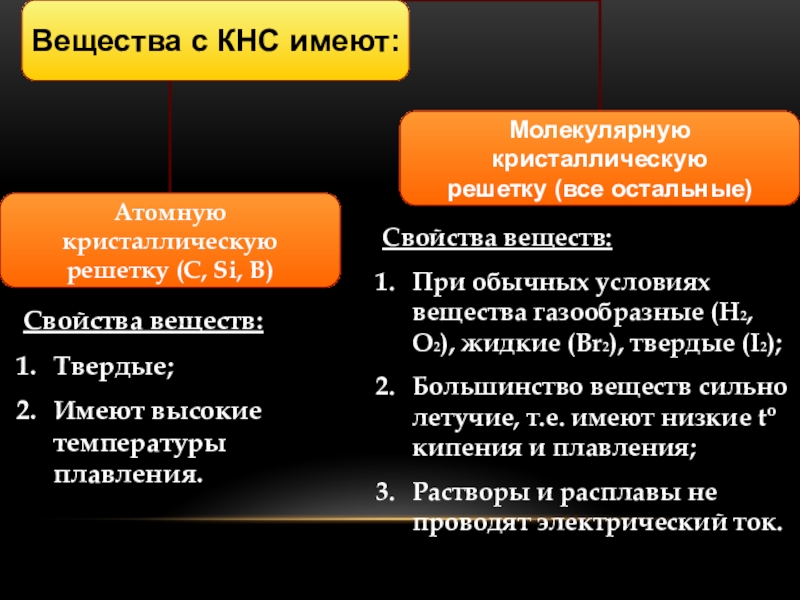
- 5. КНС образуют атомы одного и того же
- 6. Свойства веществ:Твердые;Имеют высокие температуры плавления.Свойства веществ:При обычных
- 7. КПС образуют атомы разных неметаллов (с разной
- 8. Свойства веществ:При обычных условиях вещества газообразные, жидкие,
- 9. ИС образуется между атомами металлов и
- 10. Свойства веществ:Все вещества при обычных условиях твердые.Имеют
- 11. Металлическая связь – связь в металлах и
- 12. Водородная связь – связь между атомами водорода
- 13. Механизм возникновения связи:
ЦЕЛЬ УРОКА:выявление и оценка степени овладения системой знаний и комплексом навыков и умений о химической связи, готовности учащихся успешно применять полученные знания на практике, позволяющие обеспечить обратную связь и оперативную корректировку учебного процесса; развитие критического мышления
Слайд 2ЦЕЛЬ УРОКА:
выявление и оценка степени овладения системой знаний и комплексом навыков
и умений о химической связи, готовности учащихся успешно применять полученные знания на практике, позволяющие обеспечить обратную связь и оперативную корректировку учебного процесса;
развитие критического мышления , самостоятельности и способности к рефлексии, обеспечение системности учения;
воспитание положительной мотивации учения, правильной самооценки и чувства ответственности.
развитие критического мышления , самостоятельности и способности к рефлексии, обеспечение системности учения;
воспитание положительной мотивации учения, правильной самооценки и чувства ответственности.
Слайд 3
Химическая связь – это такое взаимодействие атомов, которое связывает их в
молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Слайд 4это связь, возникающая между атомами за счет образования общих электронных пар.
По
степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Ковалентная связь
Слайд 5КНС образуют атомы одного и того же химического элемента.
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому наружные неспаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Примеры образования КНС:
H . + . H H : H H-H H2
.. .. .. ..
: F . + . F : : F : F : F-F F2
.. .. .. ..
. .
: O : + : O : : O :: O : O=O O2
. . .. ..
Примеры образования КНС:
H . + . H H : H H-H H2
.. .. .. ..
: F . + . F : : F : F : F-F F2
.. .. .. ..
. .
: O : + : O : : O :: O : O=O O2
. . .. ..
Ковалентная неполярная связь
Слайд 6Свойства веществ:
Твердые;
Имеют высокие температуры плавления.
Свойства веществ:
При обычных условиях вещества газообразные (H2,
O2), жидкие (Br2), твердые (I2);
Большинство веществ сильно летучие, т.е. имеют низкие to кипения и плавления;
Растворы и расплавы не проводят электрический ток.
Большинство веществ сильно летучие, т.е. имеют низкие to кипения и плавления;
Растворы и расплавы не проводят электрический ток.
Слайд 7КПС образуют атомы разных неметаллов (с разной электороотрицательностью). Электроотрицательность (ЭО)- это
свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – F.
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные неспаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Примеры образования связи.
.. .. + -
H + . Cl H . Cl : H Cl + - Диполь
.. ..
Самый электроотрицательный элемент – F.
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные неспаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Примеры образования связи.
.. .. + -
H + . Cl H . Cl : H Cl + - Диполь
.. ..
Ковалентная полярная связь
Слайд 8Свойства веществ:
При обычных условиях вещества газообразные, жидкие, твердые;
Большинство веществ сильнолетучие, т.е.
имеют низкие to кипения и плавления;
Растворы и расплавы проводят электрический ток.
Растворы и расплавы проводят электрический ток.
Свойства веществ:
Твердые;
Имеют высокие to плавления.
Слайд 9 ИС образуется между атомами металлов и неметаллов, т.е. между атомами
резко отличающимися друг от друга по электроотрицательности.
Механизм образования связи.
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами.
Пример образования связи.
.. ..
Na + . Cl : [ Na ] + [ . Cl : ]- или Na+ Cl-
.. ..
Механизм образования связи.
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами.
Пример образования связи.
.. ..
Na + . Cl : [ Na ] + [ . Cl : ]- или Na+ Cl-
.. ..
Ионная связь
Слайд 10Свойства веществ:
Все вещества при обычных условиях твердые.
Имеют высокие температуры кипения и
плавления.
Расплавы и растворы проводят электрический ток.
Расплавы и растворы проводят электрический ток.
Слайд 11Металлическая связь – связь в металлах и сплавах, которую выполняют относительно
свободные электроны между ионами металлов в металлической кристаллической решетке.
Схема образования металлической связи (М – металл):
_
М0 – ne M n+
Свойства веществ:
Твердость, ковкость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск.
Схема образования металлической связи (М – металл):
_
М0 – ne M n+
Свойства веществ:
Твердость, ковкость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск.
Металлическая связь
Слайд 12Водородная связь – связь между атомами водорода одной молекулы и сильноотрицательными
элементами (O, N, F) другой молекулы.
Примеры межмолекулярной водородной связи:
… О - - Н + … О - - Н + …
| |
H + H + вода
… О - - Н + … О - - Н + …
| | +
С2H5 + С2H5 этиловый спирт
Примеры межмолекулярной водородной связи:
… О - - Н + … О - - Н + …
| |
H + H + вода
… О - - Н + … О - - Н + …
| | +
С2H5 + С2H5 этиловый спирт
Водородная связь
Слайд 13 Механизм возникновения связи:
Протон одной молекулы притягивается
неподеленной электронной парой атома другой молекулы.
Примеры веществ:
водородные соединения F, O, N (реже Cl и S), спирт. Белки, нуклеиновые кислоты и др.
Примеры веществ:
водородные соединения F, O, N (реже Cl и S), спирт. Белки, нуклеиновые кислоты и др.