выполнила:
Никифорова И.В
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Углерод и его свойства
Содержание
- 1. Презентация по химии на тему Углерод и его свойства
- 2. Цели урока:Обеспечить усвоение учащимися на уровне восприятия,
- 3. Слайд 3
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. АЛМАЗ
- 8. Кристаллические решетки Существуют разновидности кристаллических
- 9. Физические свойстваОдно из самых твёрдых и
- 10. Применение основано на физических свойствахИзготовление бриллиантов –
- 11. Графит «рождающий уголь» кристаллическое аллотропное видоизменение углерода, в древности считалось минералом свинца
- 12. Кристаллическая решётка – плоская атомнаяАтомы связаны
- 13. Физические свойстваМягкое вещество серого цвета, малая механическая
- 14. ПРИМЕНЕНИЕ ГРАФИТАГрафитовый порошок – изготовление минеральных красок.Смазочный
- 15. Материалы на основе графитаГрафлекс или пенографит –
- 16. КарандашиПервые графитовые карандаши появились в XVIII
- 17. Аморфный углерод: древесный уголь, кокс, сажаИсследованиями было
- 18. Адсорбция Явление адсорбции открыто русским химиком Ловицем
- 19. Адсорбция углерода
- 20. Слайд 20
- 21. Слайд 21
- 22. Природные соединения углерода Мрамор состоит из доломита (карбоната кальция и магния)мел
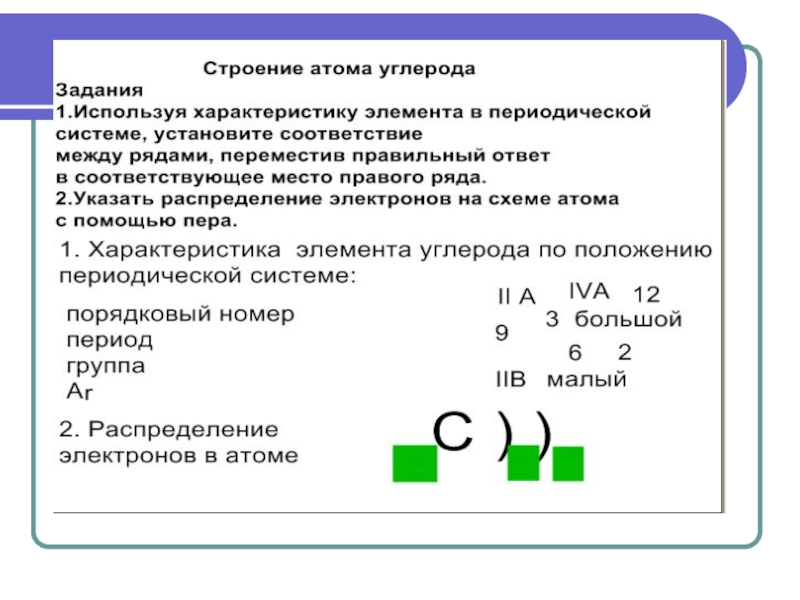
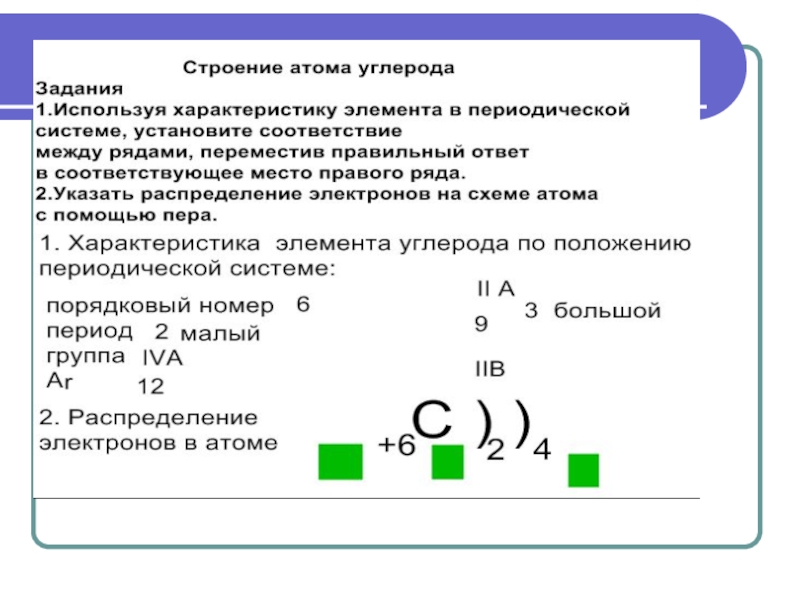
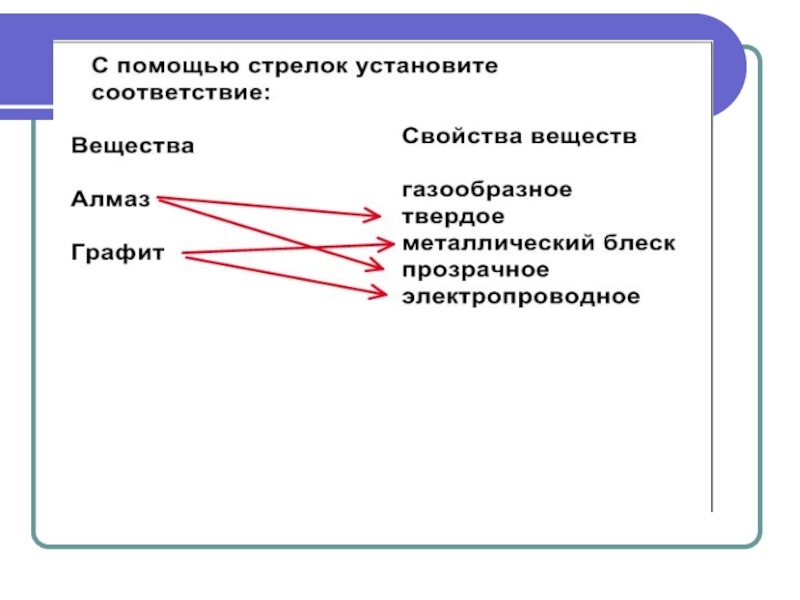
- 23. Задания на закрепление
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Слайд 27
- 28. Домашнее задание § 29, вопросы после параграфа
- 29. Литератураhttp://collection.edu.yar.ru/dlrstore/cdc7c009-0534-7300-f45c-6322687fc743/index.htmХимия. 9 класс: учеб. Для общеобразоват. учреждени
Цели урока:Обеспечить усвоение учащимися на уровне восприятия, осмысления и первичного запоминания состава, строения, свойств, применения углерода и его соединений; Продолжить формирование информационной, коммуникативной компетентностей.Задачи для учащихся: 1) дать характеристику химического элемента и простого вещества углерода;2) рассмотреть
Слайд 1Муниципальное образовательное учреждение средняя школа №2
«Углерод, его физические и химические свойства»
Работу
Слайд 2Цели урока:
Обеспечить усвоение учащимися на уровне восприятия, осмысления и первичного запоминания
состава, строения, свойств, применения углерода и его соединений;
Продолжить формирование информационной, коммуникативной компетентностей.
Задачи для учащихся:
1) дать характеристику химического элемента и простого вещества углерода;
2) рассмотреть строение, сравнение свойств и применение алмаза и графита; природных соединений углерода. Дать понятие адсорбции, рассказать об аморфном углероде и его сортах;
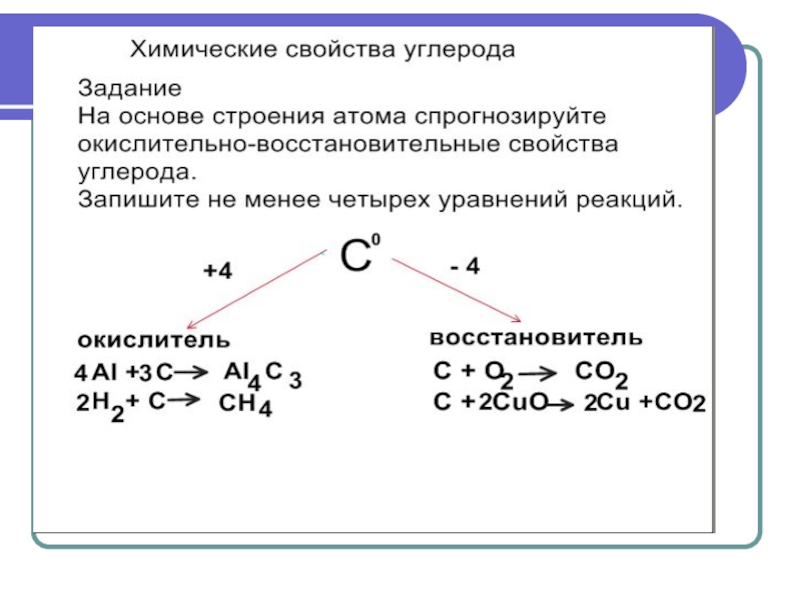
3) уметь записывать уравнения химических реакций, характеризующих химические свойства углерода;
4) уметь находить информацию, обрабатывать и преподносить.
Продолжить формирование информационной, коммуникативной компетентностей.
Задачи для учащихся:
1) дать характеристику химического элемента и простого вещества углерода;
2) рассмотреть строение, сравнение свойств и применение алмаза и графита; природных соединений углерода. Дать понятие адсорбции, рассказать об аморфном углероде и его сортах;
3) уметь записывать уравнения химических реакций, характеризующих химические свойства углерода;
4) уметь находить информацию, обрабатывать и преподносить.
Слайд 8 Кристаллические решетки Существуют разновидности кристаллических решёток алмаза: гексагональный алмаз и
кубический алмаз
(рис. 1) (рис. 2)
Слайд 9Физические свойства
Одно из самых твёрдых
и тугоплавких веществ (плотная упаковка
и
прочность связей).
Хрупок – довольно легко расколоть на части.
Очень высокая теплопроводность – проводит тепло в несколько раз лучше, чем многие металлы (в 4 раза лучше меди).
Не проводит электрический ток.
Хрупок – довольно легко расколоть на части.
Очень высокая теплопроводность – проводит тепло в несколько раз лучше, чем многие металлы (в 4 раза лучше меди).
Не проводит электрический ток.
Слайд 10Применение основано на физических свойствах
Изготовление бриллиантов – огранённые алмазы сильно преломляют
свет.
Для резки стекла, металлов, наконечники свёрл («алмазные жала»), буров и резцов – благодаря твёрдости.
Алмазный порошок – для полировки и огранки драгоценных камней (рубинов) – твёрдость.
Для резки стекла, металлов, наконечники свёрл («алмазные жала»), буров и резцов – благодаря твёрдости.
Алмазный порошок – для полировки и огранки драгоценных камней (рубинов) – твёрдость.
Слайд 11Графит
«рождающий уголь» кристаллическое аллотропное видоизменение углерода, в древности считалось минералом
свинца
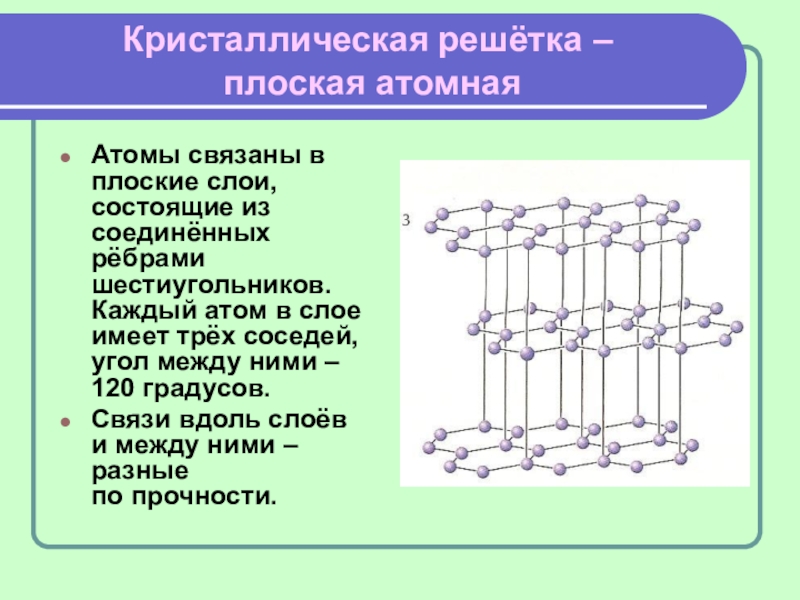
Слайд 12Кристаллическая решётка –
плоская атомная
Атомы связаны в плоские слои, состоящие из
соединённых рёбрами шестиугольников. Каждый атом в слое имеет трёх соседей,
угол между ними –
120 градусов.
Связи вдоль слоёв и между ними – разные по прочности.
Связи вдоль слоёв и между ними – разные по прочности.
Слайд 13Физические свойства
Мягкое вещество серого цвета, малая механическая прочность (неравноценные по прочности
связи).
Электропроводен и имеет металлический блеск (электроны блуждают, как у металлов).
Вещество жирное на ощупь.
Теплопроводность в направлении плоскости слоёв больше, чем в перпендикулярном направлении.
Электропроводен и имеет металлический блеск (электроны блуждают, как у металлов).
Вещество жирное на ощупь.
Теплопроводность в направлении плоскости слоёв больше, чем в перпендикулярном направлении.
Слайд 14ПРИМЕНЕНИЕ ГРАФИТА
Графитовый порошок – изготовление минеральных красок.
Смазочный материал (в смеси с
маслом) – между отдельными слоями графита взаимодействие настолько слабо, что возникает скольжение. Чешуйки графита, заполняя неровности поверхности, создают гладкую поверхность.
Графитовые стержни – электроды –электропроводность.
Тигли, блоки для атомных реакторов – тугоплавкость.
Теплозащитный материал для головных частей ракет – термостойкость.
Получение карбидов – легко реагирует с металлами.
Графитовые стержни – электроды –электропроводность.
Тигли, блоки для атомных реакторов – тугоплавкость.
Теплозащитный материал для головных частей ракет – термостойкость.
Получение карбидов – легко реагирует с металлами.
Слайд 15Материалы на основе графита
Графлекс или пенографит – высокопористый материал, заменяет резину
и металл.
Стеклоуглерод – химически стоек, заменяет платиновую химическую посуду.
Пирографит – для изготов-ления искусственных клапанов сердца.
Углеродное волокно – как наполнитель в пластике, для придания большей прочности и электропровод-ности, лёгкие эластичные электронагреватели.
На рисунке: углеродная ткань и углеродное волокно, стаканчик из стеклоуглерода.
Стеклоуглерод – химически стоек, заменяет платиновую химическую посуду.
Пирографит – для изготов-ления искусственных клапанов сердца.
Углеродное волокно – как наполнитель в пластике, для придания большей прочности и электропровод-ности, лёгкие эластичные электронагреватели.
На рисунке: углеродная ткань и углеродное волокно, стаканчик из стеклоуглерода.
Слайд 16Карандаши
Первые графитовые карандаши появились
в XVIII веке. Это было связано с
открытием графитового месторождения в Камберленде (Англия).
В 1795 г. в Париже по способу Конта изготавливались карандаши из смеси графита и глины, обожжённые в печи. Эта технология используется и по сей день. Чем больше глины – тем твёрже карандаш. В особые мягкие карандаши добавляют воск и сало – ими можно писать на стекле. Особый сорт рыхлых карандашей служит для пастельной живописи.
В 1795 г. в Париже по способу Конта изготавливались карандаши из смеси графита и глины, обожжённые в печи. Эта технология используется и по сей день. Чем больше глины – тем твёрже карандаш. В особые мягкие карандаши добавляют воск и сало – ими можно писать на стекле. Особый сорт рыхлых карандашей служит для пастельной живописи.
Слайд 17Аморфный углерод: древесный уголь, кокс, сажа
Исследованиями было установлено, что эти три
разновидности – мелкокристаллический графит,
а не отдельные аллотропные модификации.
Сажа получается при разложении метана.
Кокс образуется при разложении угля без доступа воздуха.
Древесный уголь образуется при разложении древесины без доступа воздуха. Обладает свойством адсорбции. Активированный уголь прокаливают на перегретом пару, число пор при этом увеличивается, что улучшает адсорбцию.
Сажа получается при разложении метана.
Кокс образуется при разложении угля без доступа воздуха.
Древесный уголь образуется при разложении древесины без доступа воздуха. Обладает свойством адсорбции. Активированный уголь прокаливают на перегретом пару, число пор при этом увеличивается, что улучшает адсорбцию.
Слайд 18Адсорбция
Явление адсорбции открыто русским химиком Ловицем и используется для очистки
сахара, спирта
Н.Д. Зелинский на основе адсорбционных свойств древесного угля разработал
фильтрущий противогаз
Н.Д. Зелинский на основе адсорбционных свойств древесного угля разработал
фильтрущий противогаз
Слайд 28Домашнее задание
§ 29, вопросы после параграфа № 5, 7 дополнительно
№ 8
подготовить индивидуальные сообщения (по желанию) по темам: «Алмазные усы», «Открытие фуллеренов», «Радиоуглерод-очевидец прошлого», «С-60 - футбольный мяч для физиков и химиков»
подготовить индивидуальные сообщения (по желанию) по темам: «Алмазные усы», «Открытие фуллеренов», «Радиоуглерод-очевидец прошлого», «С-60 - футбольный мяч для физиков и химиков»
Слайд 29Литература
http://collection.edu.yar.ru/dlrstore/cdc7c009-0534-7300-f45c-6322687fc743/index.htm
Химия. 9 класс: учеб. Для общеобразоват. учреждени / О.С. Габриелян.-М.:Дрофа, 2008
http:// http://www http://www. http://www.glous http://www.glous- http://www.glous-kniga http://www.glous-kniga. http://www.glous-kniga.ru
http://www.google.ru/imglanding?q=%D1%84%D0%BE%D1%82%D0%BE%20%D0%BC%D0%B5%D0%BB&imgurl=http://forexaw.com/uploads/news/19/1263385711.jpg&imgrefurl=http://forexaw.com/TERMs/Nature/l377_%25D0%259C%25D0%25B5%2 (фото мела)
http://www.google.ru/imglanding?q=%D0%BA%D0%B0%D0%BB%D1%8C%D1%86%D0%B8%D1%82&imgurl=http://www.beg.utexas.edu/mainweb/publications/graphics/calcit (кальцит)
http://images.yandex.ru/yandsearch?ed=1&text=%D1%84%D0%BE%D1%82%D0%BE%20%D0%BC%D1%80%D0%B0%D0%BC%D0%BE%D1%80&p=107&img_url=hotel-moskow.ru%2Fmramor.jpg&rpt=simage(мрамор)
http://www.google.ru/imglanding?q=%D1%84%D0%BE%D1%82%D0%BE%20%D0%BC%D0%B5%D0%BB&imgurl=http://forexaw.com/uploads/news/19/1263385711.jpg&imgrefurl=http://forexaw.com/TERMs/Nature/l377_%25D0%259C%25D0%25B5%2 (фото мела)
http://www.google.ru/imglanding?q=%D0%BA%D0%B0%D0%BB%D1%8C%D1%86%D0%B8%D1%82&imgurl=http://www.beg.utexas.edu/mainweb/publications/graphics/calcit (кальцит)
http://images.yandex.ru/yandsearch?ed=1&text=%D1%84%D0%BE%D1%82%D0%BE%20%D0%BC%D1%80%D0%B0%D0%BC%D0%BE%D1%80&p=107&img_url=hotel-moskow.ru%2Fmramor.jpg&rpt=simage(мрамор)