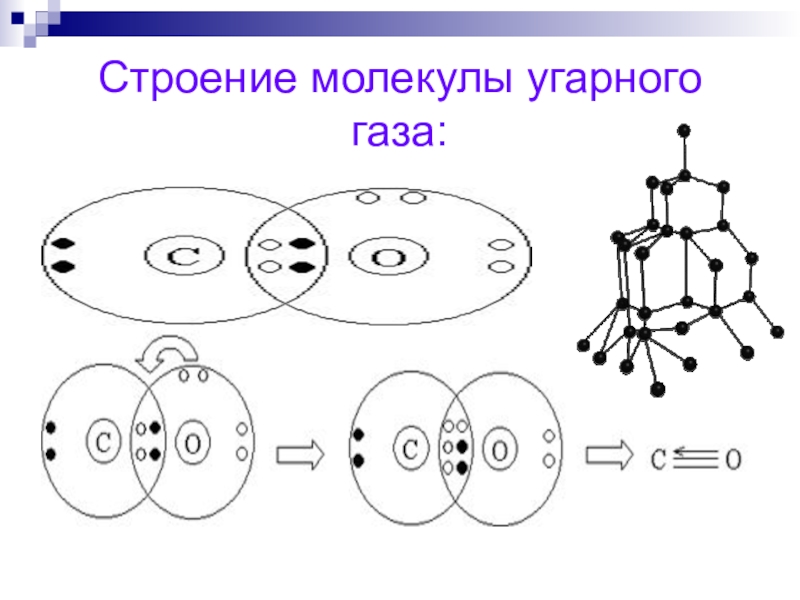
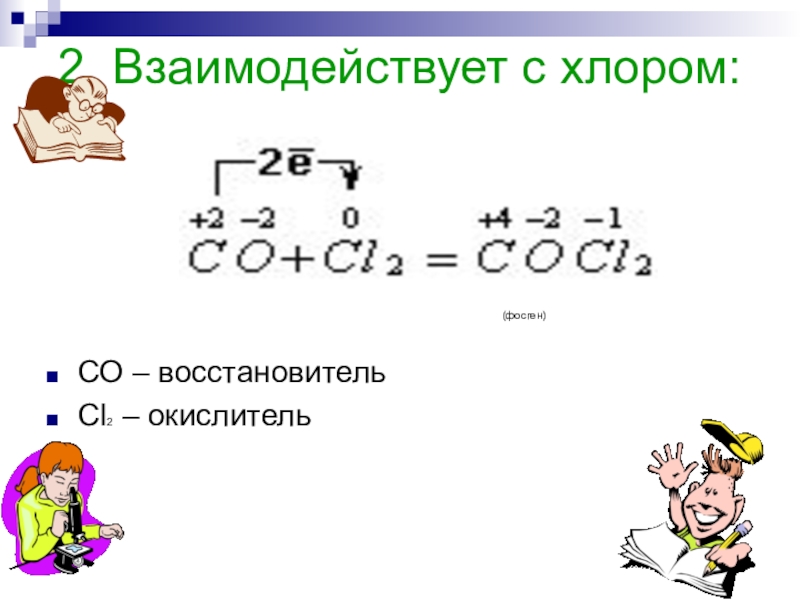
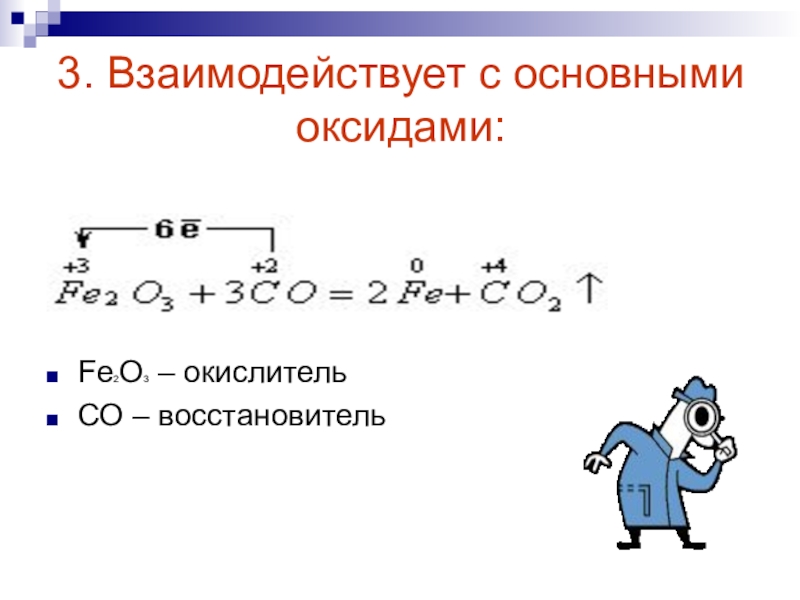
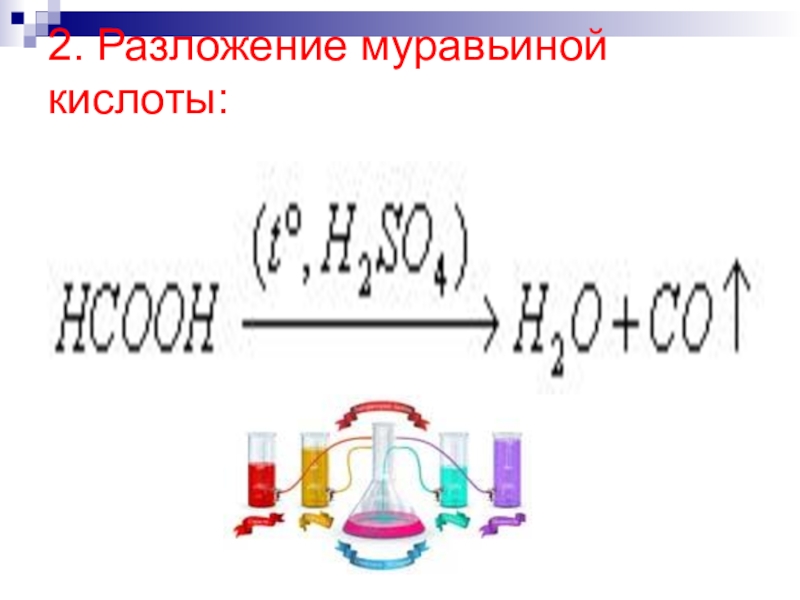
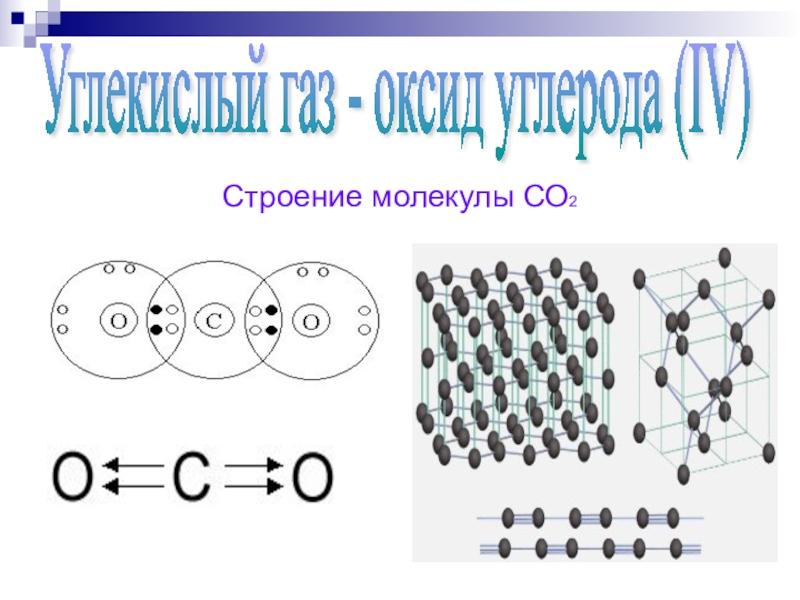
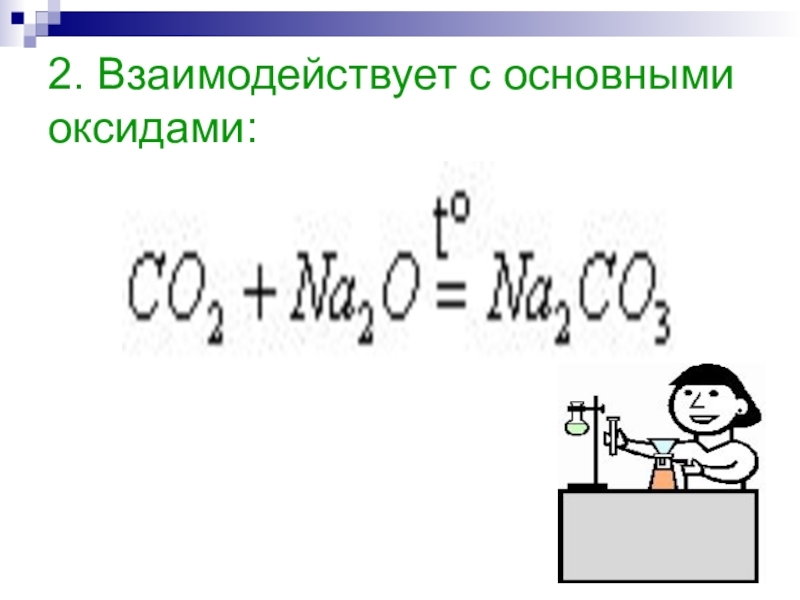
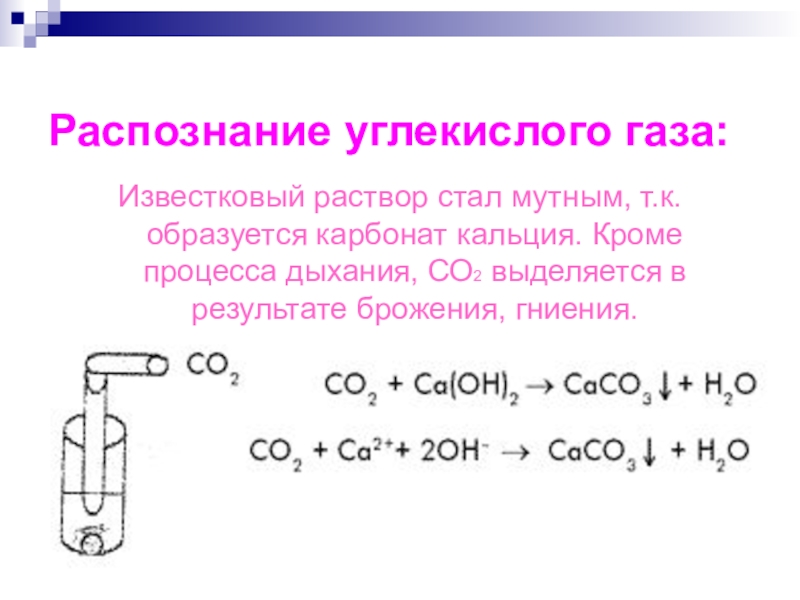
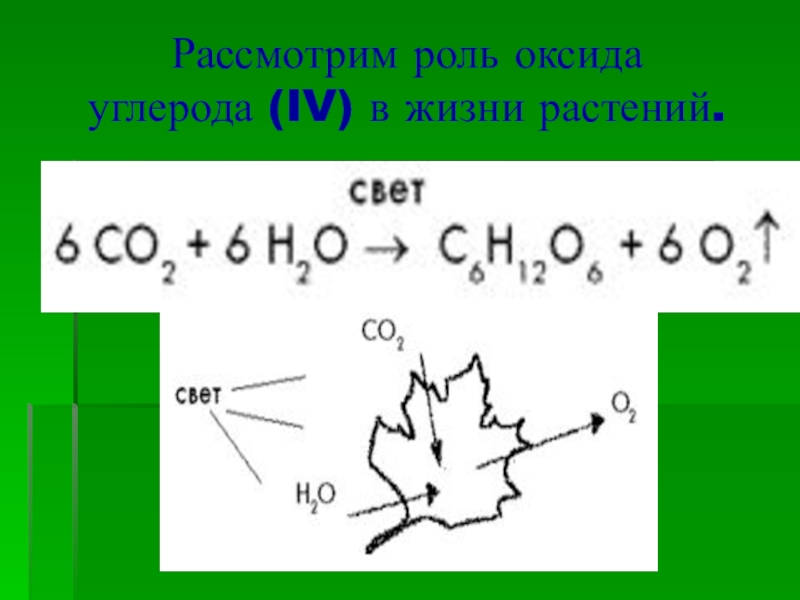
Напишите электронную формулу атома углерода, покажите распределение валентных электронов по атомным орбиталям. Укажите возможные степени окисления атомы углерода в соединениях.
Расскажите о строении:
А) алмаза
Б) графита
В) атомарного углерода
Повторение домашнего задания: