- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Углерод и его соединения
Содержание
- 1. Презентация по химии на тему Углерод и его соединения
- 2. Углерод (химический символ — C) — химический
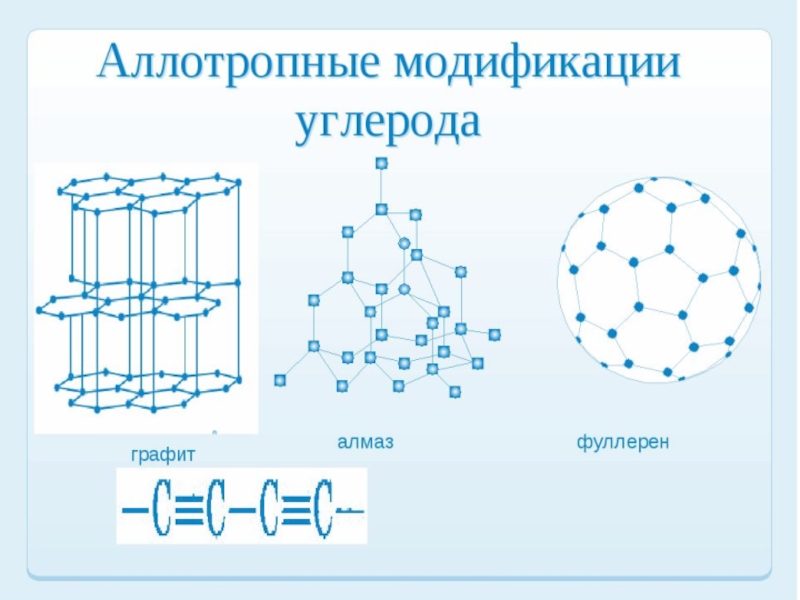
- 3. Нахождение в природеАлмазМагнезитГрафит
- 4. Слайд 4
- 5. Химические свойства
- 6. Слайд 6
- 7. Угольную кислоту получил в начале XVIII в.
- 8. Угольная кислота формула (Н2СО3) – это двухосновная,
- 9. реакция с оксидами металлов:H2CO3 +CaO → CaCO3 + H2O
- 10. Карбонаты
- 11. Применение СтроительствоХимическая промышленностьОптикаИспользуют при производстве стекла, мыла,
Углерод (химический символ — C) — химический элемент четырнадцатой группы 2-го периода периодической системы химических элементов. Порядковый номер 6, атомная масса — 12,0107.
Слайд 2Углерод (химический символ — C) — химический элемент четырнадцатой группы 2-го
периода периодической системы химических элементов. Порядковый номер 6, атомная масса — 12,0107.
Слайд 7Угольную кислоту получил в начале XVIII в. английский химик Д.Пристли путем
растворения в воде углекислого газа. Полученный раствор называли «содовой» водой.
Угольная кислота
Слайд 8Угольная кислота формула (Н2СО3) – это двухосновная, кислородсодержащая, слабая кислота. Структурная
формула ее выглядит следующим образом (см. рисунок)
В чистом виде угольная кислота существовать не может. Она устойчива только в разбавленных водных растворах и образуется при растворении СО2 в Н2О:
СО2 + Н2О -- Н2СО3
В водных растворах H2СO3 диссоциирует ступенчато:
H2СO3 -- H+ + HСO3− K1 дисс. = 4,5 ∙ 10-7
HСO3− -- СO32− + H+ K2 дисс. = 4,8 ∙ 10-11
В чистом виде угольная кислота существовать не может. Она устойчива только в разбавленных водных растворах и образуется при растворении СО2 в Н2О:
СО2 + Н2О -- Н2СО3
В водных растворах H2СO3 диссоциирует ступенчато:
H2СO3 -- H+ + HСO3− K1 дисс. = 4,5 ∙ 10-7
HСO3− -- СO32− + H+ K2 дисс. = 4,8 ∙ 10-11
Физические свойства
Слайд 9реакция с оксидами металлов:
H2CO3 +CaO → CaCO3 + H2O (образуется мел CaCO3 и вода).
Мел - это тоже соль, химическое название которого - карбонат кальция;
реакция со щелочами и основаниями:
H2CO3 + 2KOH → K2CO3 + 2H2O ( образуется поташ - промышленное название соли карбоната калия и вода);
реакция с солью, образованной более слабой кислотой:
H2CO3 + Na2SiO3 → H2SiO3 + Na2CO3. В этой химической реакции выпадает осадок -кремниевая кислота, а образующийся водный раствор соли называется раствором карбонатом натрия;
при повышенной температуре угольная кислота легко распадается на составляющие углекислый газ и воду :
H2CO3 → CO2 + H2
реакция со щелочами и основаниями:
H2CO3 + 2KOH → K2CO3 + 2H2O ( образуется поташ - промышленное название соли карбоната калия и вода);
реакция с солью, образованной более слабой кислотой:
H2CO3 + Na2SiO3 → H2SiO3 + Na2CO3. В этой химической реакции выпадает осадок -кремниевая кислота, а образующийся водный раствор соли называется раствором карбонатом натрия;
при повышенной температуре угольная кислота легко распадается на составляющие углекислый газ и воду :
H2CO3 → CO2 + H2
Химические свойства
Слайд 11Применение
Строительство
Химическая промышленность
Оптика
Используют при производстве стекла,
мыла, бумаги, как моющее средство,
при
заправке огнетушителей, в кондитерском деле.