- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Строение атомас использованием цифровых образовательных ресурсов.
Содержание
- 1. Презентация по химии на тему Строение атомас использованием цифровых образовательных ресурсов.
- 2. - сформировать у учащихся целостное представление о
- 3. Этапы урока.1. Совместно с учениками выработать цели
- 4. «Атом» – неделимый, введено в лексикон греческим
- 5. Атомная гипотеза
- 6. Все вещества состоят из «корпускул» (молекул).Молекулы состоят
- 7. История открытия строения атома
- 8. 1. В центре атома находится положительно заряженное
- 9. Слайд 9
- 10. Химический элемент – это совокупность атомов одного
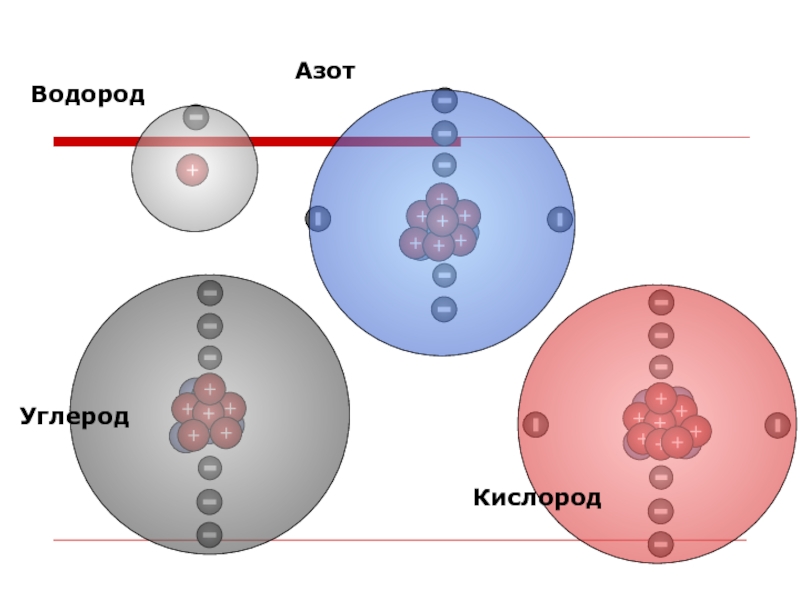
- 11. ВодородАзотКислородУглерод
- 12. таблицаТренажер «Основные сведения о строении атома».
- 13. e- = 11 p+ = 11n0 =
- 14. Задание №2. Выполни тесты с
- 15. Проверь себяОтносительная атомная масса атома меди:а) 63
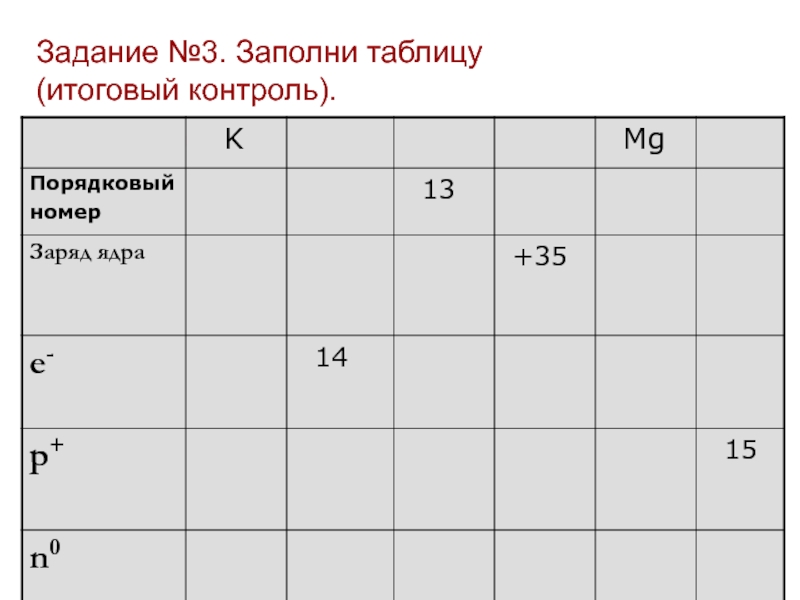
- 16. Задание №3. Заполни таблицу (итоговый контроль).
- 17. Домашнее задание: § 7 Если вы получили
- 18. Используемые информационно-образовательные ресурсы: http://files.school-collection.edu.ru/dlrstore/4f5121da-edbe-2159-704a-7a1b0d424dbe/index.htm Используемые информационно-образовательные ресурсы: http://files.school-collection.edu.ru/dlrstore/4f5121da-edbe-2159-704a-7a1b0d424dbe/index.htm
Слайд 2- сформировать у учащихся целостное представление о строении атома и атомного
продолжить формирование общеучебных компетенций;
- способствовать развитию творческих способностей учащихся (умение анализировать и выделять главное, делать выводы);
- осуществлять контроль и самоконтроль;
продолжить формирование у учащихся научной картины мира.
Цели урока:
Тип урока:
урок усвоения новых знаний
Слайд 3Этапы урока.
1. Совместно с учениками выработать цели урока.
2. Изучить основные теоретические
3. Научиться определять строение атома и атомного ядра (первичная проверка знаний).
4. Закрепить знания о строении атома с помощью различных форм самостоятельной работы (итоговый контроль).
5. Оценка результативности урока. Индивидуально- дифференцированное домашнее задание.
Слайд 4
«Атом» – неделимый,
введено в лексикон греческим философом Демокритом -2500 лет назад.
Слайд 6
Все вещества состоят из «корпускул» (молекул).
Молекулы состоят из «элементов» (атомов).
Частицы
Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ – из разных атомов.
Атомно-
молекулярная
теория
М.В. Ломоносов
(1711-1765 гг.)
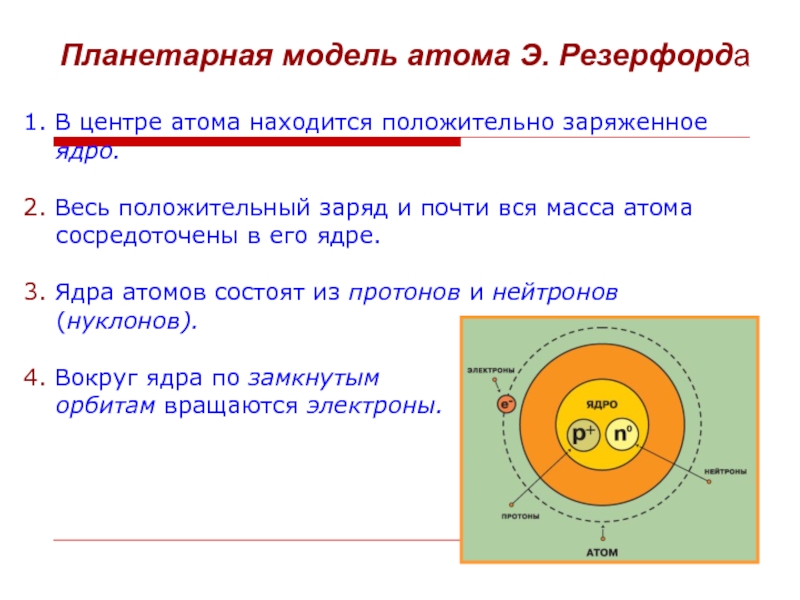
Слайд 81. В центре атома находится положительно заряженное
ядро.
2. Весь положительный
сосредоточены в его ядре.
3. Ядра атомов состоят из протонов и нейтронов
(нуклонов).
4. Вокруг ядра по замкнутым
орбитам вращаются электроны.
Планетарная модель атома Э. Резерфорда
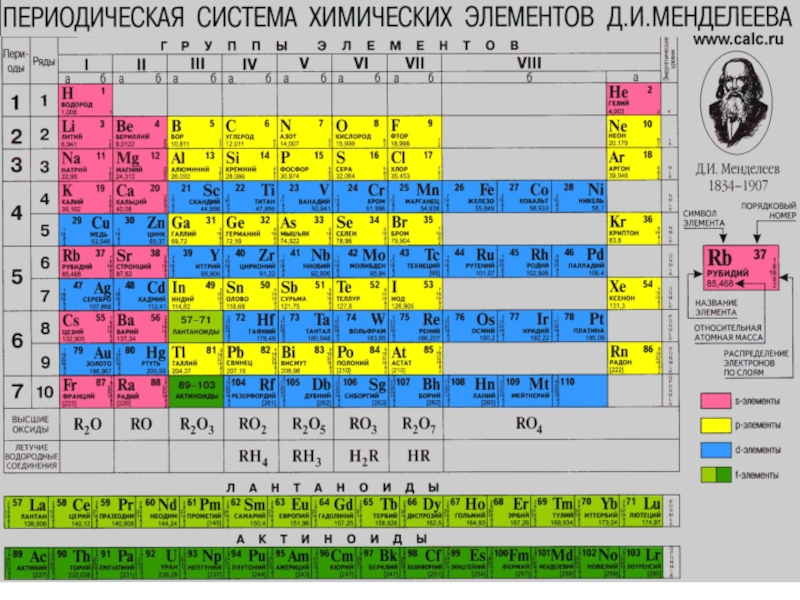
Слайд 10Химический элемент – это совокупность атомов одного вида с одинаковым положительным
Числу протонов в ядре (Z)
Порядковый номер элемента в ПС
=
Генри Мозли (1914г.) исследовал изменение зарядов
ядер по Периодической системе химических элементов.
И на основании его работ выяснилась закономерность:
Для того чтобы рассчитать число нейтронов необходимо: n = A r - Z
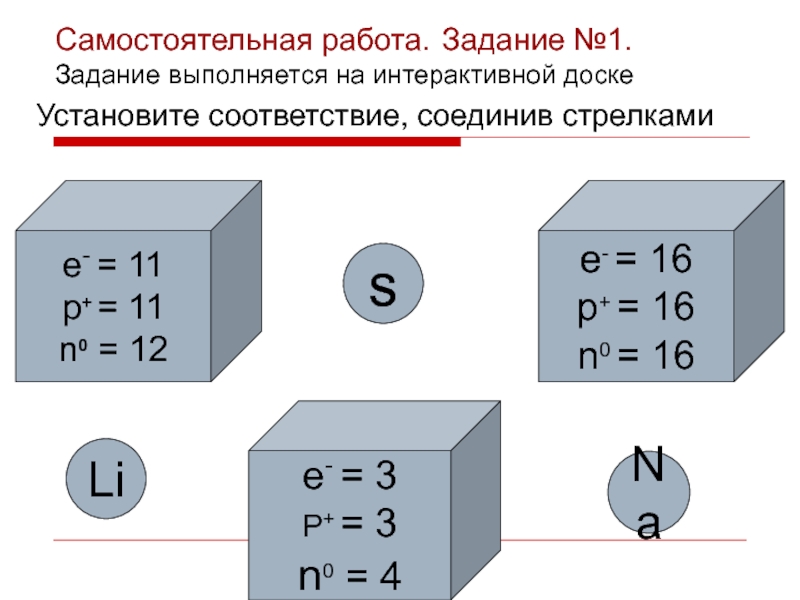
Слайд 13e- = 11
p+ = 11
n0 = 12
e- = 16
p+ =
n0 = 16
e- = 3
P+ = 3
n0 = 4
Na
Li
s
Установите соответствие, соединив стрелками
Самостоятельная работа. Задание №1.
Задание выполняется на интерактивной доске
Слайд 14
Задание №2.
Выполни тесты с целью обобщающего закрепления.
Относительная атомная масса
а) 63 б) 29 в) 64 г) 12 д) 65
Заряд ядра атома углерода равен:
а) 7 б) 13 в) 6 г) 29 д) 11
Число протонов в ядре атома кальция:
а ) 20 б) 17 в) 4 г) 31 д) 6
Число нейтронов в ядре атома хрома:
а) 8 б) 28 в) 11 г) 30 д) 24
Число электронов в атоме золота:
а) 11 б) 8 в) 56 г) 79 д) 30
Слайд 15Проверь себя
Относительная атомная масса атома меди:
а) 63 б) 29
Заряд ядра атома углерода равен:
а) 7 б) 13 в) 6 г) 29 д) 11
Число протонов в ядре атома кальция:
а ) 20 б) 17 в) 4 г) 31 д) 6
Число нейтронов в ядре атома хрома:
а) 8 б) 28 в)11 г) 30 д) 24
Число электронов в атоме золота:
а) 47 б) 8 в) 56 г) 79 д) 30
Слайд 17
Домашнее задание: § 7
Если вы получили оценку «3»
и хотите
то выполните упр.1,2,3,4 на стр. 50.
Если вы получили оценку «4 или 5», то выполните творческое задание:
1.Представьте себя каким-либо физическим объектом – атомом, электроном– и напишите небольшой рассказ о своем состоянии, окружении и о том, что происходит с вами, что вы наблюдаете.
2. Используя изученные на уроке термины: атом, ядро, оболочка, протон, нейтрон, электрон; фамилии ученых: Д.И.Менделеев, М.В.Ломоносов, Э.Резерфорд,
составить кроссворд.