- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Строение атома(11 класс)
Содержание
- 1. Презентация по химии на тему Строение атома(11 класс)
- 2. Ещё древнегреческие ученые догадывались о существовании мельчайших
- 3. В начале XIX века Д. Дальтон возродил
- 4. Эти открытия дали толчок к созданию первых
- 5. Модель Нильса БораНильс Бор (1913) сформулировал постулаты,
- 6. АтомАтом (греч. atomos — неделимый) наименьшая частица
- 7. ЯдроЯдро атома состоит из нуклонов. Нуклоны в
- 8. Атом любого элемента можно обозначить электронной формулой
- 9. Электрон является отрицательно заряженной частицей. Электронная оболочка
- 10. Изотопы – это разновидности атомов одного и
- 11. Спасибо за внимание!
Слайд 2Ещё древнегреческие ученые догадывались о существовании мельчайших химически частиц, из которых
Из истории
Слайд 3В начале XIX века Д. Дальтон возродил атомистическую теорию, опираясь на
После получения экспериментальных доказательств сложности строения атома было установлено, что атом состоит из отрицательно и положительно заряженных частиц, которые взаимодействуют между собой.
Слайд 4Эти открытия дали толчок к созданию первых моделей строения атома. Одна
В 1911г. Резерфорд предложил планетарную модель строения атома, похожую на строение солнечной системы. Согласно планетарной модели, в центре атома находится очень маленькое ядро. Вокруг ядра по орбитам движутся электроны, число которых определяется зарядом ядра. Внешняя траектория движения электронов определяет внешние размеры атома.
Модели строения атома
Слайд 5Модель Нильса Бора
Нильс Бор (1913) сформулировал постулаты, в которых заключается теория
Первый постулат.
Электрон движется вокруг ядра по строго определенным замкнутым стационарным орбитам в соответствии с «разрешенными» значениями энергии Е1, Е2, …, Еn, при этом энергия не поглощается и не излучается.
Второй постулат.
Электрон моет переходить из одного разрешенного энергетического состояния в другое, что сопровождается излучением или поглощением кванта энергии.
Слайд 6Атом
Атом (греч. atomos — неделимый) наименьшая частица химического элемента, обладающая его
1932 год - разработана протонно-нейтронная теория ядра, согласно которой ядра атомов состоят из протонов и нейтронов.
Схема строения атома
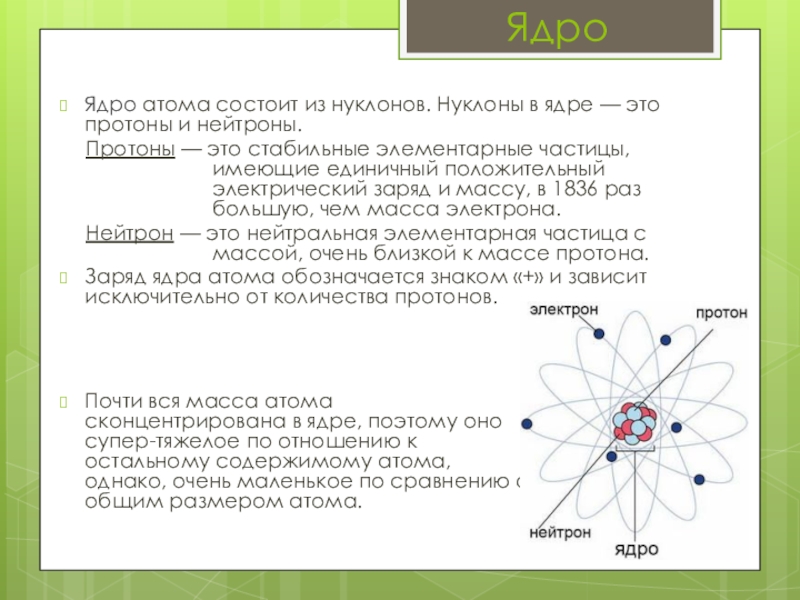
Слайд 7Ядро
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны
Протоны — это стабильные элементарные частицы, имеющие единичный положительный электрический заряд и массу, в 1836 раз большую, чем масса электрона.
Нейтрон — это нейтральная элементарная частица с массой, очень близкой к массе протона.
Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов.
Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
Слайд 8Атом любого элемента можно обозначить электронной формулой и электронно графической формулой:
Единственным
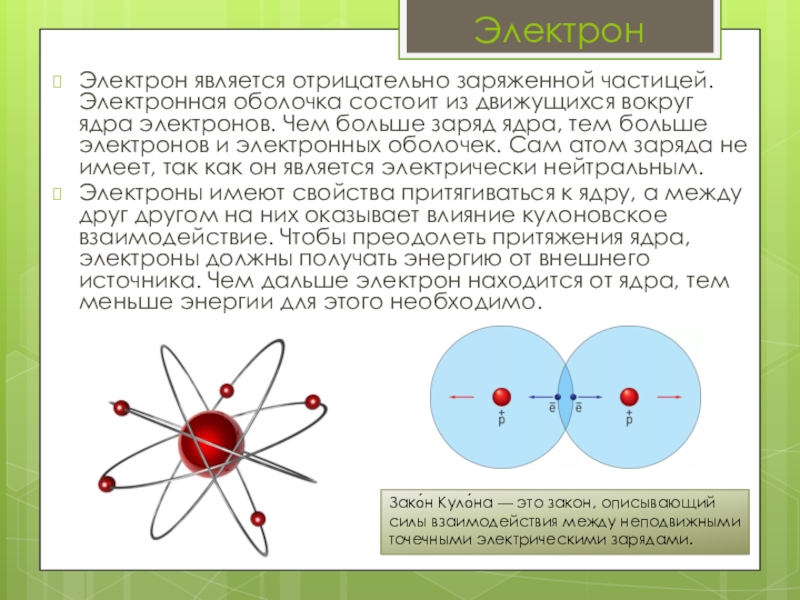
Слайд 9Электрон является отрицательно заряженной частицей. Электронная оболочка состоит из движущихся вокруг
Электроны имеют свойства притягиваться к ядру, а между друг другом на них оказывает влияние кулоновское взаимодействие. Чтобы преодолеть притяжения ядра, электроны должны получать энергию от внешнего источника. Чем дальше электрон находится от ядра, тем меньше энергии для этого необходимо.
Электрон
Зако́н Куло́на — это закон, описывающий силы взаимодействия между неподвижными точечными электрическими зарядами.
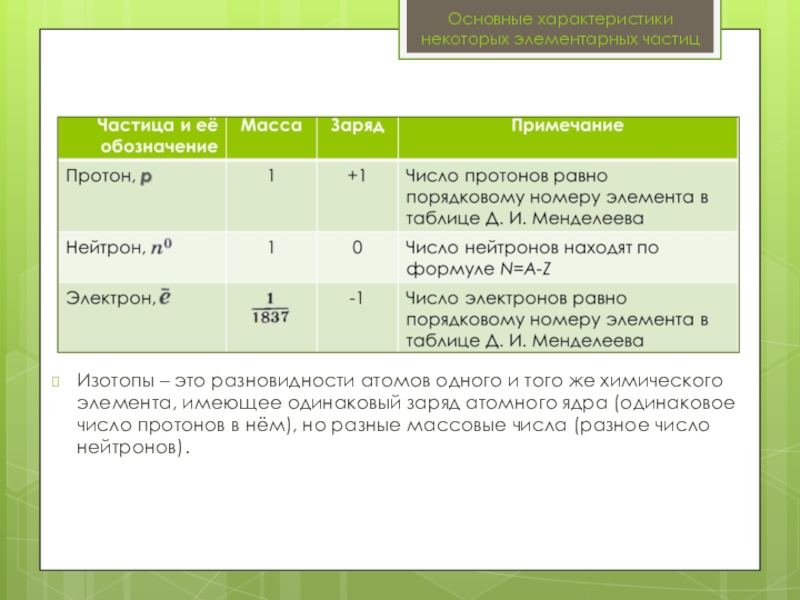
Слайд 10Изотопы – это разновидности атомов одного и того же химического элемента,
Основные характеристики некоторых элементарных частиц