- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Степень окисления(8 класс)
Содержание
- 1. Презентация по химии на тему Степень окисления(8 класс)
- 2. Степень окисленияВалентность – свойство атомов удерживать в
- 3. Заряд ионов в ионных соединениях иусловный заряд
- 4. План определения степени окисления элементов в соединениях.1.
- 5. 3. Определите наиболее электроотрицательный элемент и направление
- 6. -4 -3
- 7. Определение степени окисления в сложных соединениях, состоящих
- 8. 1. Определите степень окисления атомов в соединении.ЗаданияCH4,
Слайд 1Степень окисления
(к учебнику Химия 8.
Рудзитис Г.Е., Фельдман Ф.Г.)
Составила учитель химии Павленко
Слайд 2Степень окисления
Валентность – свойство атомов удерживать в соединении определенное число атомов
N Ξ N
III III
H – N – H
|
H
I III I
F – N – F
|
F
I III I
{
{
Полярная связь
Неполярная связь
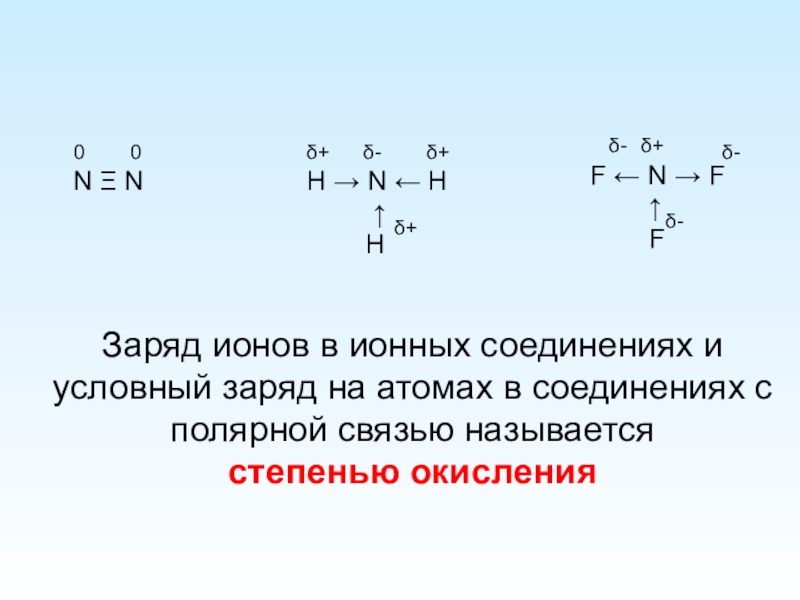
Слайд 3Заряд ионов в ионных соединениях и
условный заряд на атомах в соединениях
степенью окисления
N Ξ N
H → N ← H
↑
H
F ← N → F
↑
F
δ+
0
0
δ-
δ-
δ-
δ-
δ+
δ+
δ+
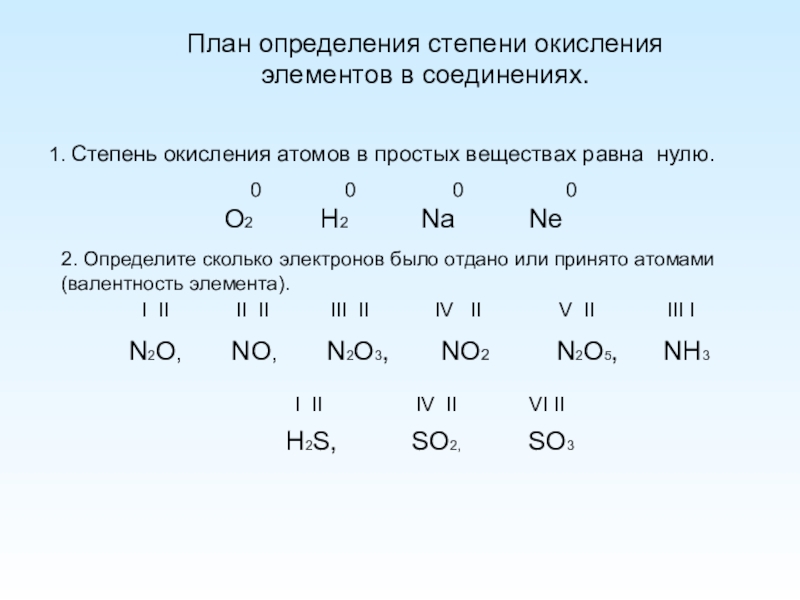
Слайд 4План определения степени окисления элементов в соединениях.
1. Степень окисления атомов в
O2 H2 Na Ne
0
0
0
0
2. Определите сколько электронов было отдано или принято атомами (валентность элемента).
N2O, NO, N2O3, NO2 N2O5, NH3
H2S, SO2, SO3
I II II II III II IV II V II III I
I II IV II VI II
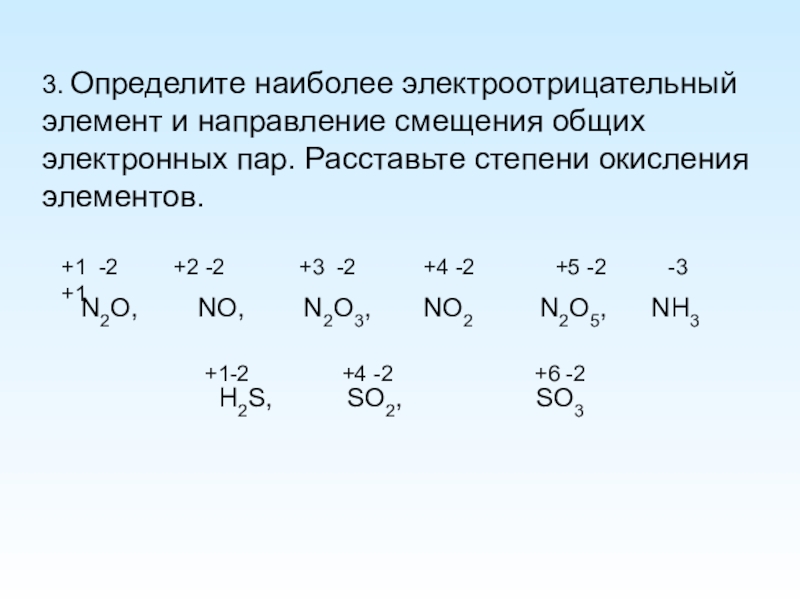
Слайд 53. Определите наиболее электроотрицательный элемент и направление смещения общих электронных пар.
N2O, NO, N2O3, NO2 N2O5, NH3
H2S, SO2, SO3
+1 -2 +2 -2 +3 -2 +4 -2 +5 -2 -3 +1
+1-2 +4 -2 +6 -2
Слайд 6
-4 -3 -2 -1
Окисление
Окислитель – атом, присоединяющий электроны ( степень окисления понижается).
Восстановитель – атом, отдающий электроны ( степень окисления повышается).
Восстановление
Слайд 7Определение степени окисления в сложных соединениях, состоящих из трех и более
Определяем степени окисления известных элементов.
H2SO4
+1 X -2
2. Для определения степени окисления неизвестного элемента составим уравнение.
(+1) · 2 + x + (-2) · 4 = 0
x = (+6)
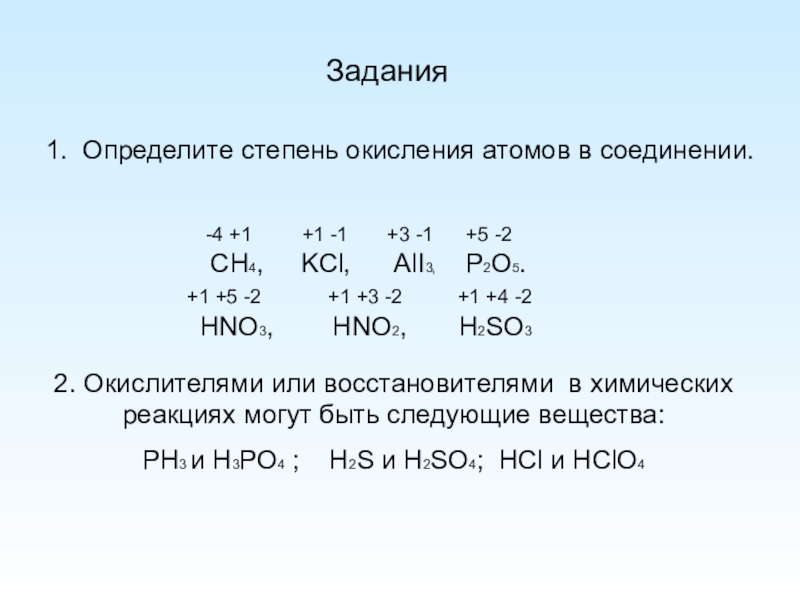
Слайд 81. Определите степень окисления атомов в соединении.
Задания
CH4, KCl,
-4 +1 +1 -1 +3 -1 +5 -2
HNO3, HNO2, H2SO3
+1 +5 -2 +1 +3 -2 +1 +4 -2
2. Окислителями или восстановителями в химических реакциях могут быть следующие вещества:
PH3 и H3PO4 ; Н2S и Н2SO4; НСl и НСlO4