УИОП
Раменский район Московской области
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Составление уравнений окислительно - восстановительных реакций
Содержание
- 1. Презентация по химии на тему Составление уравнений окислительно - восстановительных реакций
- 2. Цель: Обучиться составлению уравнений окислительно-восстановительных реакций методом электронного баланса
- 3. Алгоритм составления уравнений ОВР методом электронного балансаСоставить
- 4. Обратите внимание! Если в формуле окислителя(восстановителя)
- 5. Алгоритм5. Составить схему электронного баланса.Число электронов, отданных
- 6. Алгоритм 1. Составить схему реакции.
- 7. Алгоритм 2.Определить элементы, атомы которых изменили
- 8. Алгоритм3. Найти окислитель и восстановитель.
- 9. Алгоритм 4. Составить электронные уравнения для процессов
- 10. Алгоритм 5. Составить схему электронного баланса.Число электронов,
- 11. Алгоритм6. Найденные коэффициенты поставить перед формулами продуктов
- 12. Упражнения в классе1. Mg + HCl → MgCl2 + H2
- 13. Упражнения в классе2. CO2 + Mg → MgO + C
- 14. Упражнения в классе1. Составить схему реакции. HNO3 + Cu → Cu(NO3)2 +NO + H2O
- 15. 2.Определить элементы, атомы которых изменили степень
- 16. 3. Найти окислитель и восстановитель. +1+5-2
- 17. 4. Составить электронные уравнения для процессов окисления
- 18. 5. Составить схему электронного баланса.+1+5-2
- 19. 6. Найденные коэффициенты поставить перед формулами продуктов
- 20. а затем – перед формулами окислителя
- 21. 7. Уравнять атомы металлов и кислотные
- 22. Уравнять атомы водорода и атомы кислорода(проверка по
- 23. 8. Заменить стрелку знаком равенства, выполняя закон
- 24. Упражнения в классе 4. HCl + KMnO4 →Cl2 + KCl + MnCl2 + H2O
- 25. Упражнения в классе 5. HNO3 + P + H2O → H3PO4 + NO
- 26. 1. K2MnO4 + H2O = KMnO4 +MnO2
- 27. 9. Cr2O3 + Na2CO3 + O2 =
- 28. 17. As + Cl2 + H2O =
- 29. Домашнее задание
Цель: Обучиться составлению уравнений окислительно-восстановительных реакций методом электронного баланса
Слайд 1Составление уравнений окислительно-восстановительных реакций
Учитель химии: Шишкова Любовь Викторовна
Ново-Харитоновская СОШ №10 с
Слайд 2
Цель: Обучиться составлению уравнений окислительно-восстановительных реакций методом электронного баланса
Слайд 3Алгоритм составления уравнений ОВР методом электронного баланса
Составить схему реакции.
Определить элементы, атомы
которых изменили степень окисления в результате реакции.
Найти окислитель и восстановитель.
Составить электронные уравнения для процессов окисления и восстановления.
Найти окислитель и восстановитель.
Составить электронные уравнения для процессов окисления и восстановления.
Слайд 4Обратите внимание!
Если в формуле окислителя(восстановителя) или продукта его восстановления(окисления)указаны
два атома, изменяющие степень окисления(H2, O2, Cl2, K2Cr2O7, N2O…),то это надо учитывать в электронном
уравнении: 0 -1
Cl2 +2·1ē=2Cl
+6 +3
Cr2+2·3ē=2Cr
уравнении: 0 -1
Cl2 +2·1ē=2Cl
+6 +3
Cr2+2·3ē=2Cr
Слайд 5Алгоритм
5. Составить схему электронного баланса.
Число электронов, отданных при окислении, равно числу
электронов, принимаемых при восстановлении
Найденные множители - это коэффициенты перед формулами окислителя и восстановителя
6. Найденные коэффициенты поставить перед формулами продуктов окисления и восстановления, а затем – перед формулами окислителя и восстановителя
7. Уравнять атомы металлов и кислотные остатки, атомы водорода и атомы кислорода(проверка по кислороду)
8. Заменить стрелку знаком равенства, выполняя закон сохранения массы веществ.
Найденные множители - это коэффициенты перед формулами окислителя и восстановителя
6. Найденные коэффициенты поставить перед формулами продуктов окисления и восстановления, а затем – перед формулами окислителя и восстановителя
7. Уравнять атомы металлов и кислотные остатки, атомы водорода и атомы кислорода(проверка по кислороду)
8. Заменить стрелку знаком равенства, выполняя закон сохранения массы веществ.
Слайд 7Алгоритм
2.Определить элементы, атомы которых изменили степень окисления в результате
реакции.
+2-1 0 +3-1 0
CuCl2 + Al → AlCl3 + Cu
+2-1 0 +3-1 0
CuCl2 + Al → AlCl3 + Cu
Слайд 8Алгоритм
3. Найти окислитель и восстановитель.
+2
0
Cu + 2ē = Cu (восстановление)
окислитель
0 +3
Al - 3ē = Al (окисление)
восстановитель
Cu + 2ē = Cu (восстановление)
окислитель
0 +3
Al - 3ē = Al (окисление)
восстановитель
Слайд 9Алгоритм
4. Составить электронные уравнения для процессов окисления и восстановления.
+2-1 0 +3-1 0
CuCl2 + Al → AlCl3 + Cu
+2 0
Cu + 2ē = Cu 3
окислитель
0 +3
Al - 3ē = Al 2
восстановитель
CuCl2 + Al → AlCl3 + Cu
+2 0
Cu + 2ē = Cu 3
окислитель
0 +3
Al - 3ē = Al 2
восстановитель
Слайд 10Алгоритм
5. Составить схему электронного баланса.
Число электронов, отданных при окислении, равно
числу электронов, принимаемых при восстановлении
Найденные множители - это коэффициенты перед формулами окислителя и восстановителя.
+2-1 0 +3-1 0
3 CuCl2 + 2Al → 2AlCl3 + 3Cu
+2 0
Cu + 2 ē = Cu 3 (восстановление)
окислитель
0 +3
Al - 3 ē = Al 2 ( окисление )
восстановитель
Найденные множители - это коэффициенты перед формулами окислителя и восстановителя.
+2-1 0 +3-1 0
3 CuCl2 + 2Al → 2AlCl3 + 3Cu
+2 0
Cu + 2 ē = Cu 3 (восстановление)
окислитель
0 +3
Al - 3 ē = Al 2 ( окисление )
восстановитель
Слайд 11Алгоритм
6. Найденные коэффициенты поставить перед формулами продуктов окисления и восстановления, а
затем – перед формулами окислителя и восстановителя
3 CuCl2 + 2Al → 2AlCl3 + 3Cu
7. Заменить стрелку знаком равенства, выполняя закон сохранения массы веществ.
3CuCl2 + 2Al = 2AlCl3 + 3Cu
3 CuCl2 + 2Al → 2AlCl3 + 3Cu
7. Заменить стрелку знаком равенства, выполняя закон сохранения массы веществ.
3CuCl2 + 2Al = 2AlCl3 + 3Cu
Слайд 15
2.Определить элементы, атомы которых изменили степень окисления в результате реакции
+1+5-2
0 +2 +5 -2 +2-2 +1-2
H N O3 + Cu → Cu (N O3)2 +N O +H2 O
H N O3 + Cu → Cu (N O3)2 +N O +H2 O
Слайд 16
3. Найти окислитель и восстановитель.
+1+5-2 0
+2 +5 -2 +2-2 +1-2
H N O3 + Cu → Cu (N O3)2 +N O +H2 O
+5 +2
N + 3ē = N
окислитель
0 +2
Cu - 2ē = Cu
восстановитель
H N O3 + Cu → Cu (N O3)2 +N O +H2 O
+5 +2
N + 3ē = N
окислитель
0 +2
Cu - 2ē = Cu
восстановитель
Слайд 17
4. Составить электронные уравнения для процессов окисления и восстановления.
+1+5-2
0 +2 +5 -2 +2-2 +1-2
H N O3 + Cu → Cu (N O3)2 +N O +H2 O
+5 +2
N + 3ē = N 2 (восстановление)
окислитель
0 +2
Cu - 2ē = Cu 3 (окисление)
восстановитель
H N O3 + Cu → Cu (N O3)2 +N O +H2 O
+5 +2
N + 3ē = N 2 (восстановление)
окислитель
0 +2
Cu - 2ē = Cu 3 (окисление)
восстановитель
Слайд 18
5. Составить схему электронного баланса.
+1+5-2 0
+2 +5 -2 +2-2 +1-2
H N O3 + Cu → Cu (N O3)2 +N O +H2 O
+5 +2
N + 3ē = N 2 (восстановление)
окислитель
0 +2
Cu - 2ē = Cu 3 (окисление)
восстановитель
H N O3 + Cu → Cu (N O3)2 +N O +H2 O
+5 +2
N + 3ē = N 2 (восстановление)
окислитель
0 +2
Cu - 2ē = Cu 3 (окисление)
восстановитель
Слайд 19
6. Найденные коэффициенты поставить перед формулами продуктов окисления и восстановления, +1+5-2
0 +2 +5 -2 +2-2 +1-2
H N O3 + Cu → 3Cu (N O3)2 +2N O +H2 O
+5 +2
N + 3ē = N 2 (восстановление)
окислитель
0 +2
Cu - 2ē = Cu 3 (окисление)
восстановитель
H N O3 + Cu → 3Cu (N O3)2 +2N O +H2 O
+5 +2
N + 3ē = N 2 (восстановление)
окислитель
0 +2
Cu - 2ē = Cu 3 (окисление)
восстановитель
Слайд 20
а затем – перед формулами окислителя и восстановителя
+1+5-2
0 +2 +5 -2 +2-2 +1-2
H N O3 + 3Cu → 3Cu (N O3)2 +2N O +H2 O
+5 +2
N + 3ē = N 2 (восстановление)
окислитель
0 +2
Cu - 2ē = Cu 3 (окисление)
восстановитель
H N O3 + 3Cu → 3Cu (N O3)2 +2N O +H2 O
+5 +2
N + 3ē = N 2 (восстановление)
окислитель
0 +2
Cu - 2ē = Cu 3 (окисление)
восстановитель
Слайд 21
7. Уравнять атомы металлов и кислотные остатки, учитывая, что атомы
N(азота) вошли в состав двух продуктов реакции.
+1+5-2 0 +2 +5-2 +2-2 +1-2
8H NO3 + 3Cu → 3Cu (NO3)2 +2NO +H2 O
+1+5-2 0 +2 +5-2 +2-2 +1-2
8H NO3 + 3Cu → 3Cu (NO3)2 +2NO +H2 O
Слайд 22
Уравнять атомы водорода и атомы кислорода(проверка по кислороду)
+1+5-2
0 +2 +5-2 +2-2 +1-2
8H NO3 + 3Cu → 3Cu(NO3)2+2NO+ 4H2 O
8H NO3 + 3Cu → 3Cu(NO3)2+2NO+ 4H2 O
Слайд 23
8. Заменить стрелку знаком равенства, выполняя закон сохранения массы веществ.
+1+5-2
0 +2 +5-2 +2-2 +1-2
8H NO3 + 3Cu = 3Cu(NO3)2+2NO+ 4H2 O
8H NO3 + 3Cu = 3Cu(NO3)2+2NO+ 4H2 O
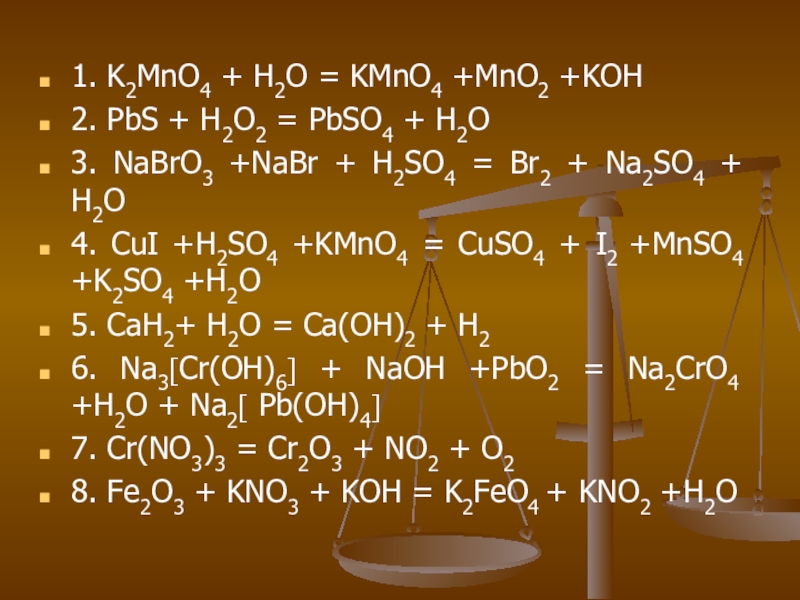
Слайд 261. K2MnO4 + H2O = KMnO4 +MnO2 +KOH
2. PbS + H2O2
= PbSO4 + H2O
3. NaBrO3 +NaBr + H2SO4 = Br2 + Na2SO4 + H2O
4. CuI +H2SO4 +KMnO4 = CuSO4 + I2 +MnSO4 +K2SO4 +H2O
5. CaH2+ H2O = Ca(OH)2 + H2
6. Na3[Cr(OH)6] + NaOH +PbO2 = Na2CrO4 +H2O + Na2[ Pb(OH)4]
7. Cr(NO3)3 = Cr2O3 + NO2 + O2
8. Fe2O3 + KNO3 + KOH = K2FeO4 + KNO2 +H2O
3. NaBrO3 +NaBr + H2SO4 = Br2 + Na2SO4 + H2O
4. CuI +H2SO4 +KMnO4 = CuSO4 + I2 +MnSO4 +K2SO4 +H2O
5. CaH2+ H2O = Ca(OH)2 + H2
6. Na3[Cr(OH)6] + NaOH +PbO2 = Na2CrO4 +H2O + Na2[ Pb(OH)4]
7. Cr(NO3)3 = Cr2O3 + NO2 + O2
8. Fe2O3 + KNO3 + KOH = K2FeO4 + KNO2 +H2O
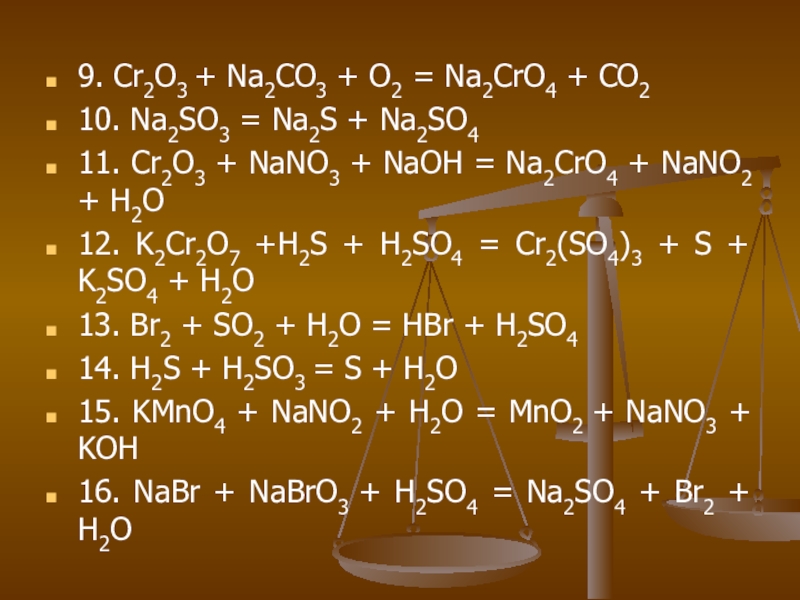
Слайд 279. Cr2O3 + Na2CO3 + O2 = Na2CrO4 + CO2
10. Na2SO3
= Na2S + Na2SO4
11. Cr2O3 + NaNO3 + NaOH = Na2CrO4 + NaNO2 + H2O
12. K2Cr2O7 +H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O
13. Br2 + SO2 + H2O = HBr + H2SO4
14. H2S + H2SO3 = S + H2O
15. KMnO4 + NaNO2 + H2O = MnO2 + NaNO3 + KOH
16. NaBr + NaBrO3 + H2SO4 = Na2SO4 + Br2 + H2O
11. Cr2O3 + NaNO3 + NaOH = Na2CrO4 + NaNO2 + H2O
12. K2Cr2O7 +H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O
13. Br2 + SO2 + H2O = HBr + H2SO4
14. H2S + H2SO3 = S + H2O
15. KMnO4 + NaNO2 + H2O = MnO2 + NaNO3 + KOH
16. NaBr + NaBrO3 + H2SO4 = Na2SO4 + Br2 + H2O
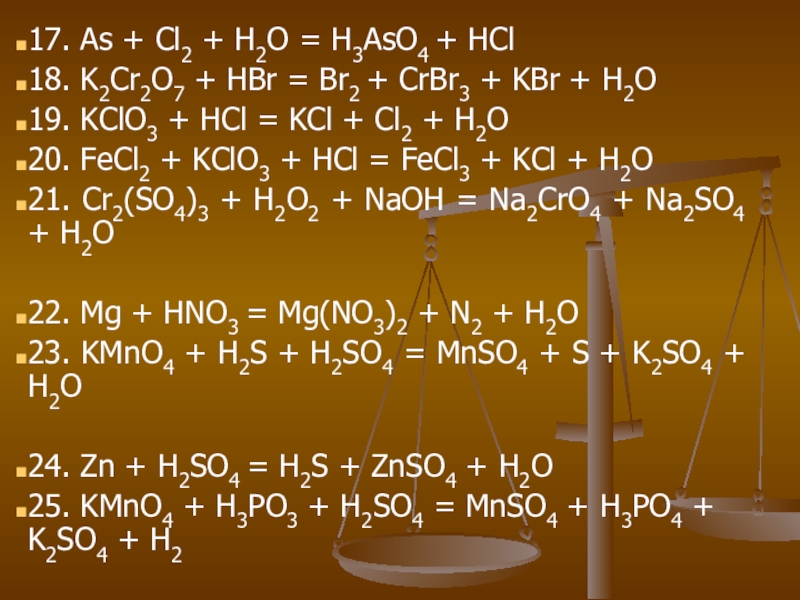
Слайд 2817. As + Cl2 + H2O = H3AsO4 + HCl
18. K2Cr2O7
+ HBr = Br2 + CrBr3 + KBr + H2O
19. KClO3 + HCl = KCl + Cl2 + H2O
20. FeCl2 + KClO3 + HCl = FeCl3 + KCl + H2O
21. Cr2(SO4)3 + H2O2 + NaOH = Na2CrO4 + Na2SO4 + H2O
22. Mg + HNO3 = Mg(NO3)2 + N2 + H2O
23. KMnO4 + H2S + H2SO4 = MnSO4 + S + K2SO4 + H2O
24. Zn + H2SO4 = H2S + ZnSO4 + H2O
25. KMnO4 + H3PO3 + H2SO4 = MnSO4 + H3PO4 + K2SO4 + H2
19. KClO3 + HCl = KCl + Cl2 + H2O
20. FeCl2 + KClO3 + HCl = FeCl3 + KCl + H2O
21. Cr2(SO4)3 + H2O2 + NaOH = Na2CrO4 + Na2SO4 + H2O
22. Mg + HNO3 = Mg(NO3)2 + N2 + H2O
23. KMnO4 + H2S + H2SO4 = MnSO4 + S + K2SO4 + H2O
24. Zn + H2SO4 = H2S + ZnSO4 + H2O
25. KMnO4 + H3PO3 + H2SO4 = MnSO4 + H3PO4 + K2SO4 + H2
Слайд 29Домашнее задание
§ 3, задание на
с. 15
По учебнику Н.С. Новошинской,
И.И.Новошинского
Выучить алгоритм
По учебнику Н.С. Новошинской,
И.И.Новошинского
Выучить алгоритм