Выполнили : Данилов Иван 9 класс
Зайнутдинова Маргарита 9 класс
Руководители :
учитель химии
Глухман Е.Ю
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Скорость развития коррозии в разных средах.
Содержание
- 1. Презентация по химии на тему Скорость развития коррозии в разных средах.
- 2. Коррозия- это самопроизвольное разрушение металлов вследствие их физико-химического взаимодействия с окружающей средой.
- 3. Актуальность проблемы: Очень большое
- 4. Цель: Изучить
- 5. Методы исследования: 1.Сравнительного анализа; 2.Физико-химические методы; 3.Наблюдение; 4.Графические методы.
- 6. Объект исследования: железные гвозди вразных средах.Предмет исследования:
- 7. Классификация видов коррозии: Электрохимическая коррозияВодородная и кислородная коррозия Химическая коррозия
- 8. По условиям протекания коррозионного процесса различаются следующие
- 9. По характеру разрушения:Сплошная коррозия, охватывающая всю поверхность:
- 10. Качественно-визуальное определение процессов коррозии в разных средах.NaOHNaClNaClNaCLH2ONaClNaClH2ONaClNaOHCuZnCuZn
- 11. Слайд 11
- 12. Коррозия в разных средах в присутствии гальванического элементаNaClNaClCuZn
- 13. Кислородная коррозия в нейтральной среде Fe0-2e=Fe+2катод: O2+4H++4e=2H2O4Fe+3O2+4H2O+2nH2O=2Fe2O3*nH2O+8HH2O
- 14. Химическая коррозия.Катод: 2H+2e=H2Анод:0Fe-2e=Fe+2NaCl
- 15. Электрохимическая коррозия- окислительное- восстановительная реакция NaCl-электролит Катод:(железо)
- 16. NaOH-ингибитор NaOHЩелочная среда:
- 17. Качественное определение Fe3+ с приближенной количественной оценкой
- 18. Слайд 18
- 19. Слайд 19
- 20. Определение наличия
- 21. Определение pH почвы. В нейтральной среде: 2H2O+O2+4e=4OHАнодный процесс: Me*mH2OВ Кислой среде: O2+4H=2H2O
- 22. Слайд 22
- 23. Выводы: 1. Скорость развития коррозии зависит от
- 24. Спасибо за внимание!
Коррозия- это самопроизвольное разрушение металлов вследствие их физико-химического взаимодействия с окружающей средой.
Слайд 1МБОУ «Средняя общеобразовательная школа № 1» Скорость развития коррозии в разных средах.
Слайд 2Коррозия- это самопроизвольное разрушение металлов вследствие их физико-химического взаимодействия с окружающей
средой.
Слайд 3
Актуальность проблемы: Очень большое количество
металлов коррозирует. Разрушаются конструкции,
ржавеют
автомобили, аппаратура, корабли. Так что ускоряет процессы
коррозии?
автомобили, аппаратура, корабли. Так что ускоряет процессы
коррозии?
Слайд 4
Цель: Изучить виды коррозии и
экспериментальным путем подтвердить, как различные среды влияют на скорость развития коррозии.
Задачи: 1.Изучить литературу и другие источники информации по теме исследования; 2. Доказать наличие непрерывного коррозийного процесса железа в разных средах; 3.Выяснить причины и условия коррозийных процессов; 4.Определить экспериментальным путем влияние различных агрессивных сред на коррозию железа.
Задачи: 1.Изучить литературу и другие источники информации по теме исследования; 2. Доказать наличие непрерывного коррозийного процесса железа в разных средах; 3.Выяснить причины и условия коррозийных процессов; 4.Определить экспериментальным путем влияние различных агрессивных сред на коррозию железа.
Слайд 5
Методы исследования:
1.Сравнительного анализа;
2.Физико-химические методы;
3.Наблюдение;
4.Графические методы.
Слайд 6
Объект исследования: железные гвозди в
разных средах.
Предмет исследования: процессы коррозии.
Гипотеза: Предположим, что
скорость развития
коррозии зависит от агрессивных сред.
коррозии зависит от агрессивных сред.
Слайд 7Классификация видов коррозии:
Электрохимическая коррозия
Водородная и кислородная коррозия
Химическая коррозия
Слайд 8По условиям протекания коррозионного процесса различаются следующие виды:
контактная коррозия;
щелевая коррозия;
коррозия при
неполном погружении;
коррозия при полном погружении;
коррозия при переменном погружении;
коррозия при трении;
межкристаллитная коррозия;
коррозия под напряжением.
коррозия при полном погружении;
коррозия при переменном погружении;
коррозия при трении;
межкристаллитная коррозия;
коррозия под напряжением.
Слайд 9По характеру разрушения:
Сплошная коррозия, охватывающая всю поверхность:
равномерная;
неравномерная;
избирательная;
Локальная (местная) коррозия, охватывающая
отдельные участки:
пятнами;
язвенная;
точечная (или питтинг);
сквозная;
Межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях)
пятнами;
язвенная;
точечная (или питтинг);
сквозная;
Межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях)
Слайд 10Качественно-визуальное определение процессов коррозии в разных средах.
NaOH
NaCl
NaCl
NaCL
H2O
NaCl
NaCl
H2O
NaCl
NaOH
Cu
Zn
Cu
Zn
Слайд 13Кислородная коррозия в нейтральной среде
Fe0-2e=Fe+2
катод: O2+4H++4e=2H2O
4Fe+3O2+4H2O+2nH2O=2Fe2O3*nH2O+8H
катод: O2+4H++4e=2H2O
4Fe+3O2+4H2O+2nH2O=2Fe2O3*nH2O+8H
H2O
Слайд 15Электрохимическая коррозия- окислительное- восстановительная реакция
NaCl-электролит
Катод:(железо) 2H+2e=H2
Анод:(цинк)
Zn-2e=Zn
Zn+2H=Zn+H2
Катод: Fe-2e=Fe+2
Анод: 2H+2e=H2
Fe+2H=Fe+H2
Zn+2H=Zn+H2
Катод: Fe-2e=Fe+2
Анод: 2H+2e=H2
Fe+2H=Fe+H2
NaCl
NaCl
Cu
Zn
Слайд 17Качественное определение Fe3+ с приближенной количественной оценкой
Метод основан на реакции:
Fe3++CNS¯?Fe(CNS)3
Ион FeSCN - ярко-красный цвет
Ион FeSCN - ярко-красный цвет
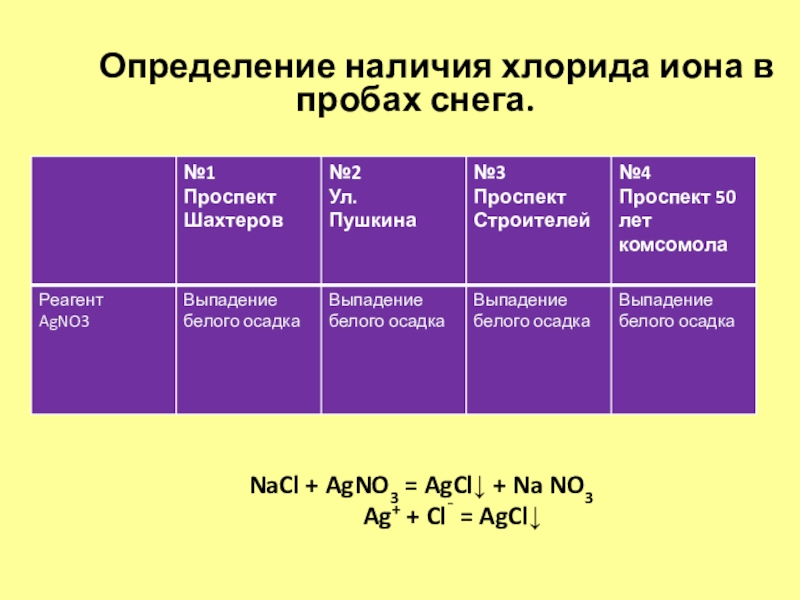
Слайд 20
Определение наличия хлорида иона в
пробах снега.
NaCl + AgNO3 = AgCl↓ + Na NO3
Ag+ + Cl¯ = AgCl↓
NaCl + AgNO3 = AgCl↓ + Na NO3
Ag+ + Cl¯ = AgCl↓
Слайд 21Определение pH почвы.
В нейтральной среде: 2H2O+O2+4e=4OH
Анодный процесс: Me*mH2O
В Кислой среде:
O2+4H=2H2O
Слайд 23Выводы:
1. Скорость развития коррозии зависит от агрессивности среды(среда кислая увеличивает коррозию);
2.Гидроксид- ионы ослабляют процесс коррозии;
3.Хлорид- ионы ускоряют процесс коррозии;
4. При контакте двух разнородных металлов коррозируют более активный металл.
3.Хлорид- ионы ускоряют процесс коррозии;
4. При контакте двух разнородных металлов коррозируют более активный металл.