- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Щелочные металлы и растворы (9 класс)
Содержание
- 1. Презентация по химии на тему Щелочные металлы и растворы (9 класс)
- 2. Цели и задачиЦель
- 3. Выберите правильное утверждение1). Металла Си; Аg ;
- 4. История открытия щелочных
- 5. Происхождение названий щелочных металлов.Li (1817) лат. «литос»
- 6. Слайд 6
- 7. Физические свойстваLi; Na; K- металлы серебристо-белого цвета.
- 8. Слайд 8
- 9. Химические свойства1). Окисление на воздухе:4Li + O2
- 10. Нахождение в природеЩелочные металлы очень активны. В
- 11. Слайд 11
- 12. Применение литияЛитий широко применяется для производства стекла,
- 13. Новосибирский завод Химконцентратов
- 14. Общая информация о
- 15. Слайд 15
- 16. Исторические даты и продукцияПредприятие было основано
- 17. Слайд 17
- 18. Производство литияЛитиевое производство представляет собой
- 19. Производство лития-7ПАО НЗХК является российским предприятием по
- 20. Производство лития-7Гидроксид лития-7 моногидрат получают электролизом водных
- 21. Фильм «НЗХК»
- 22. Ответь на вопросы:С работой какого завода вы
- 23. Закончите фразу - Сегодня на уроке я
- 24. Спасибо за урок
Цели и задачиЦель урока: Сформировать знания о физических и химических свойствах щелочных металлов.Задачи:1). Научиться давать характеристику щелочным металлам на основании их положения в Периодической системе химических элементов.2).Изучить физические и химические свойства щелочных
Слайд 2 Цели и задачи
Цель урока: Сформировать знания о
физических и химических свойствах щелочных металлов.
Задачи:
1). Научиться давать характеристику щелочным металлам на основании их положения в Периодической системе химических элементов.
2).Изучить физические и химические свойства щелочных металлов
3). Научиться применять полученные знания для решения практических задач.
Задачи:
1). Научиться давать характеристику щелочным металлам на основании их положения в Периодической системе химических элементов.
2).Изучить физические и химические свойства щелочных металлов
3). Научиться применять полученные знания для решения практических задач.
Слайд 3Выберите правильное утверждение
1). Металла Си; Аg ; Аи не взаимодействуют с
водой даже при нагревании;
2). Все металлы имеют характерный серебристо-белый цвет;
3). У атомов металлов на внешнем уровне 1-3 электрона;
4). Металлы обладают ярко выраженными окислительными свойствами
5). Металлы проводят электрический ток;
6). При взаимодействии с окислителями металлы принимают электроны
2). Все металлы имеют характерный серебристо-белый цвет;
3). У атомов металлов на внешнем уровне 1-3 электрона;
4). Металлы обладают ярко выраженными окислительными свойствами
5). Металлы проводят электрический ток;
6). При взаимодействии с окислителями металлы принимают электроны
Слайд 4История открытия щелочных металлов
Металлы Nа и К
были открыты в 1807 году английским физиком и химиком Г.Дэви электролизом твердых щелочей. Как только Дэви начал электролиз расплава аОН на отрицательном электроде, опущенном в расплав, появились маленькие шарики с металлическим блеском, похожие на ртуть. На основании эксперимента Дэви сделал вывод, что полученное вещество - металл
Слайд 5Происхождение названий щелочных металлов.
Li (1817) лат. «литос» - камень
Na (1807) араб.
«натрум» - сода
K (1807) араб «алкали» - щелочь
Rb (1861) лат. «рубидус» – темно-красный.
Cs (1860) лат. «цезиус» - небесно-голубой
Fr (1939) от названия страны Франция
K (1807) араб «алкали» - щелочь
Rb (1861) лат. «рубидус» – темно-красный.
Cs (1860) лат. «цезиус» - небесно-голубой
Fr (1939) от названия страны Франция
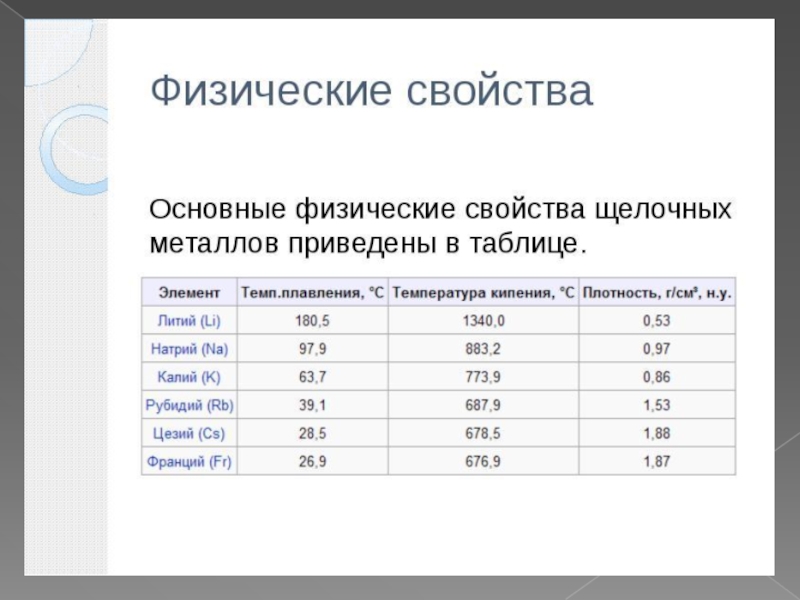
Слайд 7Физические свойства
Li; Na; K- металлы серебристо-белого цвета. Литий легко режется ножом.
Вследствие активности хранят под слоем керосина, чтобы преградить доступ воздуха и влаги во избежании взрывов и пожаров. Эти вещества взрывоопасны. Нельзя тушить водой, так как последняя энергично реагирует с ними. Обладают низкой t плавл., проводят эл.ток, пластичны. Характерна окраска, придаваемая каждым из них бесцветному пламени.
Окрашивание пламени:
Na – желтый
K – фиолетовый
Li - малиновый
Rb – красный
Cs – фиолетово-синий
Окрашивание пламени:
Na – желтый
K – фиолетовый
Li - малиновый
Rb – красный
Cs – фиолетово-синий
Слайд 9Химические свойства
1). Окисление на воздухе:
4Li + O2 --- 2Li2O
2Na + O2
--- Na2O2
2Na2O + 2Na --- 2Na2O
2). Взаимодействие с галогенами
а). При соприкосновении с бромом – взаимодействуют друг с другом.
б). В атмосфере F2 и Cl2 при наличии влажности воспламеняются; с I 2 – только при температуре
2Na + Cl2 ---2NaCl
В). Взаимодействие с водой ( Li медленно, К – со взрывом).
2Na + 2H 2 O --- 2NaOH + H 2
Г). Взаимодействие с кислотами
2Na + 2H 2 O --- 2NaOH + H 2
NaOH + HCl --- NaCl + H2O
2Na2O + 2Na --- 2Na2O
2). Взаимодействие с галогенами
а). При соприкосновении с бромом – взаимодействуют друг с другом.
б). В атмосфере F2 и Cl2 при наличии влажности воспламеняются; с I 2 – только при температуре
2Na + Cl2 ---2NaCl
В). Взаимодействие с водой ( Li медленно, К – со взрывом).
2Na + 2H 2 O --- 2NaOH + H 2
Г). Взаимодействие с кислотами
2Na + 2H 2 O --- 2NaOH + H 2
NaOH + HCl --- NaCl + H2O
Слайд 10Нахождение в природе
Щелочные металлы очень активны. В природе щелочные металлы встречаются
только в виде соединений. Na и К встречаются в виде хлоридов, сульфатов, силикатов. Li; Rb; Cs входят в состав различных минералов. Fr встречается в радиоактивных рудах Ac и U.
Слайд 12Применение лития
Литий широко применяется для производства стекла, в качестве покрытия фарфора.
Черная и цветная металлургия использует литий для придания сплавам прочности и пластичности, в изготовлении смазок. Текстильная промышленность использует этот элемент в качестве отбеливания тканей, пищевая – в роли консерванта, фармацевтическая использует в качестве косметических препаратов.
Жидкий литий нашел свое применение в ядерных реакторах. Радиоактивный литий получают при помощи изотопа лития -6. Широкое применение щелочной металл нашел в химической промышленности как катализатор многих процессов, компонент сплавов, из которых изготавливают холодные катоды, а также аноды источников тока. Фторид лития в виде монокристаллов применяется для создания . высокоточных лазеров с КПД 80%. Различные соединения с литием участвуют в дефектоскопии, пиротехнике, радиоэлектронике, оптоэлектронике.
Жидкий литий нашел свое применение в ядерных реакторах. Радиоактивный литий получают при помощи изотопа лития -6. Широкое применение щелочной металл нашел в химической промышленности как катализатор многих процессов, компонент сплавов, из которых изготавливают холодные катоды, а также аноды источников тока. Фторид лития в виде монокристаллов применяется для создания . высокоточных лазеров с КПД 80%. Различные соединения с литием участвуют в дефектоскопии, пиротехнике, радиоэлектронике, оптоэлектронике.
Слайд 14Общая информация о
НЗХК
Новосибирский завод химконцентратов – один из ведущих мировых производителей ядерного топлива для АЭС и исследовательских реакторов России и зарубежных стран. Входит в структуру Топливной компании ТВЭЛ Госкорпорации «Росатом»
Слайд 16Исторические даты и продукция
Предприятие было основано 25 сентября 1948 года.
В настоящее время 6% от общей установленной мощности энергетических ядерных реакторов работают на топливе, производимом на НЗХК.
НЗХК начал серийное изготовление топлива для АЭС с 80-х годов 20-го столетия. Технологический процесс изготовления ТВС включает изготовление порошка диоксида урана и топливных таблеток, изготовление комплектующих и сборочное производство самих ТВС. Этот вид производства в составе ПАО НЗХК действует и совершенствуется на протяжении 30 лет.
НЗХК начал серийное изготовление топлива для АЭС с 80-х годов 20-го столетия. Технологический процесс изготовления ТВС включает изготовление порошка диоксида урана и топливных таблеток, изготовление комплектующих и сборочное производство самих ТВС. Этот вид производства в составе ПАО НЗХК действует и совершенствуется на протяжении 30 лет.
Слайд 18 Производство лития
Литиевое производство представляет собой масштабный производственный комплекс, дающий
возможность высокоэффективно перерабатывать ценное литиевое сырье. Основным конкурентным преимуществом литиевой продукции НЗХК является его химическая чистота, поскольку наиболее полно полезные свойства лития проявляются при условии его максимальной очистки от сопутствующих природных и техногенных примесей.
Слайд 19Производство лития-7
ПАО НЗХК является российским предприятием по производству лития-7 (с атомной
долей изотопа лития-7 не менее 99,99%), который изготавливается исключительно в виде гидроксида лития-7 моногидрата.
Этот продукт используется в ядерной энергетике в качестве добавки в теплоноситель реактора для корректировки водно-химического режима, а также в производстве химических реагентов для ядерной энергетики.
Этот продукт используется в ядерной энергетике в качестве добавки в теплоноситель реактора для корректировки водно-химического режима, а также в производстве химических реагентов для ядерной энергетики.
Слайд 20Производство лития-7
Гидроксид лития-7 моногидрат получают электролизом водных растворов хлорида лития на
ртутном растворе. В дальнейшем раствор гидроксида лития-7 моногидрат проходит стадии очистки, кристаллизации, центрифугирования, сушки, рассева и магнитной сепарации. В результате получаются кристаллы белого цвета. Они укладываются в двойные полиэтиленовые мешки, которые запаиваются. Объем реализации этого продукта НЗХК обеспечивает более 70% мирового потребления лития-7.
Слайд 22Ответь на вопросы:
С работой какого завода вы познакомились сегодня?
Какие виды продукции
выпускает этот завод?
Как связана тема урока с продукцией, выпускаемой на данном предприятии?
Когда был основан завод?
Чем продукция данного завода отличается от аналогичной продукции других заводов? Почему это так важно?
Как связана тема урока с продукцией, выпускаемой на данном предприятии?
Когда был основан завод?
Чем продукция данного завода отличается от аналогичной продукции других заводов? Почему это так важно?
Слайд 23Закончите фразу
- Сегодня на уроке я узнал …
- Для
себя открыл новое …
- Я знаю, как лучше заботиться о своем здоровье, потому что …
- Я знаю, как лучше заботиться о своем здоровье, потому что …