- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Производство фосфорной кислоты
Содержание
- 1. Презентация по химии на тему: Производство фосфорной кислоты
- 2. Содержание:Фосфорные кислоты (определение)Физ. св-ва фосфорной кислотыЗначение фосфорной
- 3. Фосфорные кислоты — это прозрачная, бесцветная и
- 4. Физические свойства фосфорной кислоты Ортофосфорная кислота
- 5. Значение фосфорной кислоты Фосфорная кислота имеет
- 6. Применение фосфорной кислоты Применяют ортофосфорную кислоту в
- 7. Различные соли фосфорной кислоты широко применяют во
- 8. Слайд 8
- 9. История открытия и получения фосфорной кислоты
- 10. Слайд 10
- 11. ФосфатыСоли фосфорной кислоты называются фосфатами. Фосфорная кислота
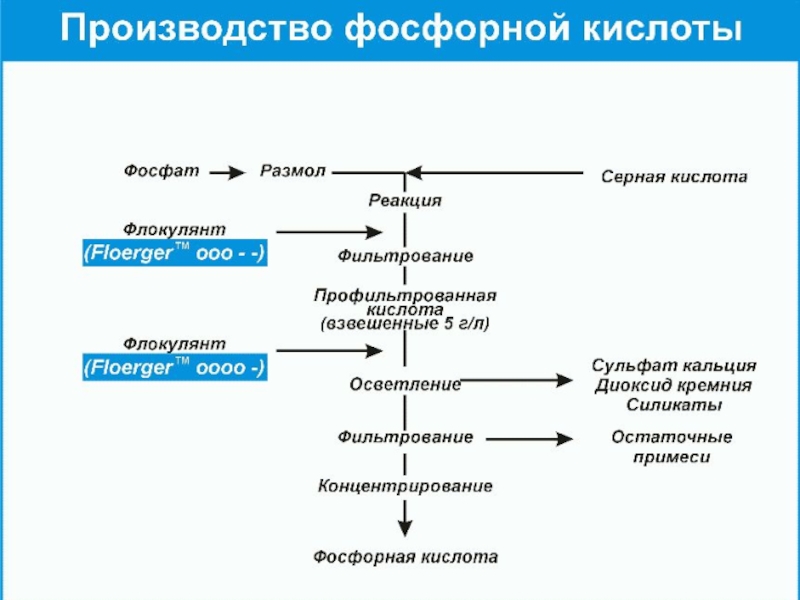
- 12. Получение фосфорной кислотыФосфорную кислоту получают из фосфорита:Можно
- 13. Схема получения фосфорной кислоты
- 14. Слайд 14
- 15. Слайд 15
- 16. Экстракционный метод производства фосфорной кислоты Фосфорную кислоту
- 17. Для удобства записи и упрощения расчетов формула
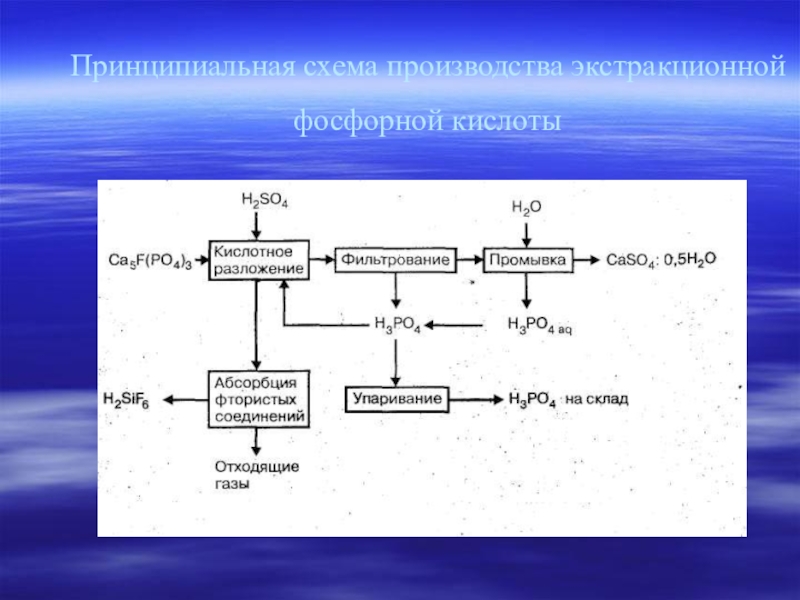
- 18. Принципиальная схема производства экстракционной фосфорной кислоты
- 19. Технологическая схема производства экстракционной фосфорной кислоты полугидратным
- 20. Слайд 20
- 21. Производство фосфорной кислоты электротермическим методомЭлектротермический метод производства
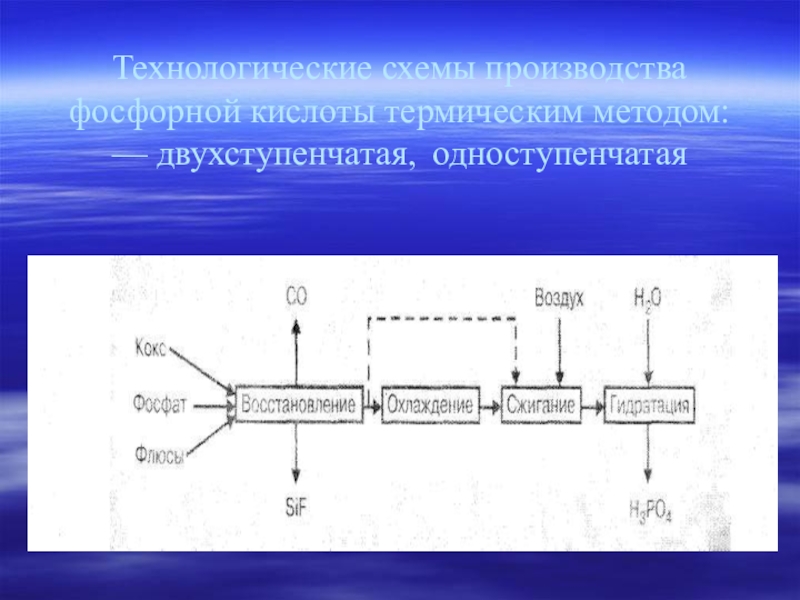
- 22. Технологические схемы производства фосфорной кислоты термическим методом: — двухступенчатая, одноступенчатая
- 23. Технологическая схема производства термической фосфорной кислоты двухстадийным
- 24. Слайд 24
- 25. Проблема получения оксида фосфора (V) непосредственно из
- 26. Технологическая схема ХТС
- 27. Технологическая схема производства экстракционной фосфорной кислоты полугидратным
- 28. Слайд 28
Содержание:Фосфорные кислоты (определение)Физ. св-ва фосфорной кислотыЗначение фосфорной кислотыПрименение фосфорной кислотыПроизводство фосфорной кислотыИстория открытия и получения фосфорной кислотыФосфатыПолучение фосфорной кислотыЭкстракционный метод производства фосфорной кислоты Производство фосфорной кислоты электротермическим методом
Слайд 2Содержание:
Фосфорные кислоты (определение)
Физ. св-ва фосфорной кислоты
Значение фосфорной кислоты
Применение фосфорной кислоты
Производство фосфорной
кислоты
История открытия и получения фосфорной кислоты
Фосфаты
Получение фосфорной кислоты
Экстракционный метод производства фосфорной кислоты
Производство фосфорной кислоты электротермическим методом
История открытия и получения фосфорной кислоты
Фосфаты
Получение фосфорной кислоты
Экстракционный метод производства фосфорной кислоты
Производство фосфорной кислоты электротермическим методом
Слайд 3Фосфорные кислоты — это прозрачная, бесцветная и вязкая жидкость без запаха.
Фосфорная кислота, также известна как ортофосфорная кислота или фосфорная (V) кислота, неорганические кислоты. Соединения фосфора в степени окисления +5, имеющие общую формулу P2O5·nH2O.
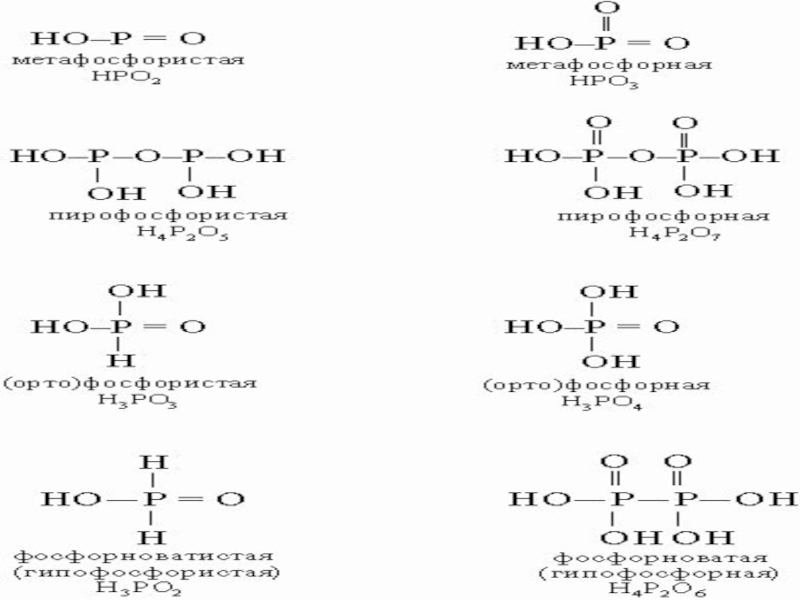
При взаимодействии высшего оксида фосфора с водой на холоде получается метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу. При разбавлении её водой образуется ортофосфорная кислота H3PO4:
При нагревании до 200—250 °C ортофосфорная кислота обезвоживается, и образуется пирофосфорная кислота H4P2O7, в результате дальнейшей дегидратации которой при 400—500 °C вновь образуется метафосфорная кислота:
Из всех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота[1] (которую часто называют просто фосфорная[2]). Для её получения используют реакции обмена фосфатов с сильными кислотами или окисление белого фосфора азотной кислотой:
Фосфорную кислоту и её соли (дигидрофосфаты, гидрофосфаты и фосфаты) широко используют при производстве минеральных удобрений. Наиболее распространёнными фосфорными удобрениями являются простой суперфосфат, преципитат и фосфоритная мука.
При взаимодействии высшего оксида фосфора с водой на холоде получается метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу. При разбавлении её водой образуется ортофосфорная кислота H3PO4:
При нагревании до 200—250 °C ортофосфорная кислота обезвоживается, и образуется пирофосфорная кислота H4P2O7, в результате дальнейшей дегидратации которой при 400—500 °C вновь образуется метафосфорная кислота:
Из всех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота[1] (которую часто называют просто фосфорная[2]). Для её получения используют реакции обмена фосфатов с сильными кислотами или окисление белого фосфора азотной кислотой:
Фосфорную кислоту и её соли (дигидрофосфаты, гидрофосфаты и фосфаты) широко используют при производстве минеральных удобрений. Наиболее распространёнными фосфорными удобрениями являются простой суперфосфат, преципитат и фосфоритная мука.
Слайд 4Физические свойства
фосфорной кислоты
Ортофосфорная кислота в чистом виде
при обычных условиях представляет
бесцветные кристаллы ромбической формы, плавящиеся при температуре 42.3оС.
Однако с такой кислотой химики встречаются редко. Гораздо чаще они имеют
дело с полугидратом Н3РО4 * 0.5 Н2О, который выпадает в виде бесцветных
гексагональных призм при охлаждении концентрированных водных растворов
ортофосфорной кислоты. Температура плавления полугидрата 29.3оС.
Чистая Н3РО4 после плавления образует вязкую маслообразную жидкость с
малой электрической проводимостью и сильно пониженной способностью к
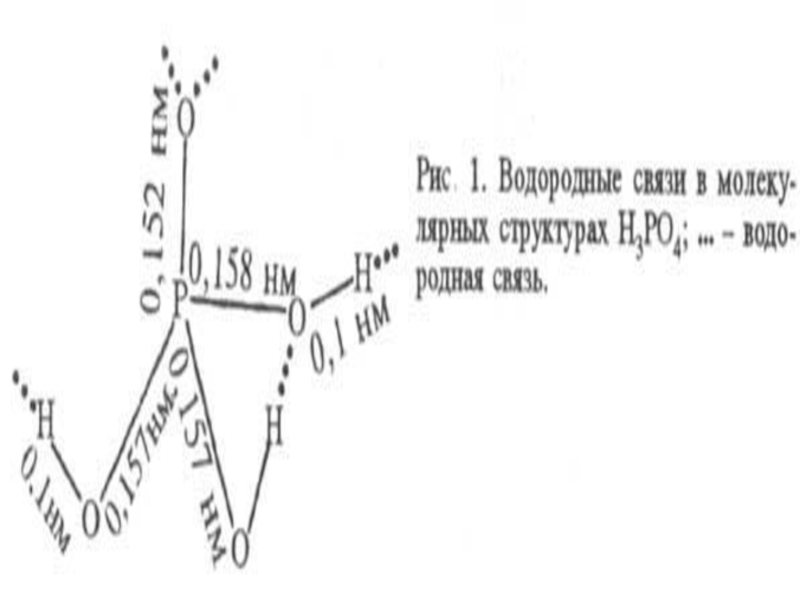
диффузии. Эти свойства, а также детальное изучение спектров показывают,
молекулы Н3РО4 в данном случае практически не диссоциированы и объединены
прочными водородными связями в единую макромолекулярную структуру. Как
правило, молекулы связаны друг с другом одной, реже двумя и очень редко
тремя водородными связями.
Если же кислоту разбавлять водой, то ее молекулы охотнее образуют
водородные связи с водой, чем друг с другом. Из-за таких "симпатий" к воде
кислота смешивается с ней в любых отношениях. Энергия гидратации здесь не
так велика, как у серной кислоты, поэтому разогревание Н3РО4 при
разбавлении не столь сильное и диссоциация выражена меньше. По первой
ступени диссоциации ортофосфорная кислота считается электролитом средней
силы ( 25 - 30%), по второй - слабым, по третьей - очень слабым.
бесцветные кристаллы ромбической формы, плавящиеся при температуре 42.3оС.
Однако с такой кислотой химики встречаются редко. Гораздо чаще они имеют
дело с полугидратом Н3РО4 * 0.5 Н2О, который выпадает в виде бесцветных
гексагональных призм при охлаждении концентрированных водных растворов
ортофосфорной кислоты. Температура плавления полугидрата 29.3оС.
Чистая Н3РО4 после плавления образует вязкую маслообразную жидкость с
малой электрической проводимостью и сильно пониженной способностью к
диффузии. Эти свойства, а также детальное изучение спектров показывают,
молекулы Н3РО4 в данном случае практически не диссоциированы и объединены
прочными водородными связями в единую макромолекулярную структуру. Как
правило, молекулы связаны друг с другом одной, реже двумя и очень редко
тремя водородными связями.
Если же кислоту разбавлять водой, то ее молекулы охотнее образуют
водородные связи с водой, чем друг с другом. Из-за таких "симпатий" к воде
кислота смешивается с ней в любых отношениях. Энергия гидратации здесь не
так велика, как у серной кислоты, поэтому разогревание Н3РО4 при
разбавлении не столь сильное и диссоциация выражена меньше. По первой
ступени диссоциации ортофосфорная кислота считается электролитом средней
силы ( 25 - 30%), по второй - слабым, по третьей - очень слабым.
Слайд 5Значение фосфорной кислоты
Фосфорная кислота имеет большое значение как
один из важнейших
компонентов питания растений. Фосфор используется растениями для построения
своих самых жизненно важных частей - семян и плодов.
Производные ортофосфорной кислоты очень нужны не только растениям, но и
животным. Кости, зубы, панцири, когти, иглы, шипы у большинства живых
организмов состоят, в основном, из ортофосфата кальция. Кроме того,
ортофосфорная кислота, образуя различные соединения с органическими
веществами, активно участвуют в процессах обмена веществ живого организма с
окружающей средой. В результате этого производные фосфора содержатся в
костях, мозге, крови, в мышечных и соединительных тканях организмов
человека и животных. Особенно много ортофосфорной кислоты в составе нервных
(мозговых) клеток, что позволило А.Е. Ферсману, известному геохимику,
назвать фосфор "элементом мысли". Весьма отрицательно (заболевание животных
рахитом, малокровие, и др.) сказывается на состоянии организма понижение
содержания в рационе питания соединений фосфора или введение их в
неусвояемой форме.
компонентов питания растений. Фосфор используется растениями для построения
своих самых жизненно важных частей - семян и плодов.
Производные ортофосфорной кислоты очень нужны не только растениям, но и
животным. Кости, зубы, панцири, когти, иглы, шипы у большинства живых
организмов состоят, в основном, из ортофосфата кальция. Кроме того,
ортофосфорная кислота, образуя различные соединения с органическими
веществами, активно участвуют в процессах обмена веществ живого организма с
окружающей средой. В результате этого производные фосфора содержатся в
костях, мозге, крови, в мышечных и соединительных тканях организмов
человека и животных. Особенно много ортофосфорной кислоты в составе нервных
(мозговых) клеток, что позволило А.Е. Ферсману, известному геохимику,
назвать фосфор "элементом мысли". Весьма отрицательно (заболевание животных
рахитом, малокровие, и др.) сказывается на состоянии организма понижение
содержания в рационе питания соединений фосфора или введение их в
неусвояемой форме.
Слайд 6Применение фосфорной кислоты
Применяют ортофосфорную кислоту в настоящее время довольно
широко. Основным ее потребителем служит производство фосфорных и комбинированных удобрений. Для этих целей ежегодно добывается во всем мире фосфоросодержащей руды около 100 млн. т. Фосфорные удобрения не только способствуют повышению урожайности различных сельскохозяйственных культур, но и придают растениям зимостойкость и устойчивость к другим неблагоприятным климатическим условиям, создают условия для более быстрого созревания урожая в районах с коротким вегетативным периодом. Они также благоприятно действуют на почву, способствуя ее структуированию, развитию почвенных бактерий, изменению растворимости других содержащихся в почве веществ и подавлению некоторых образующихся вредных органических веществ.
Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба.
Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба.
Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
Слайд 7Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в
строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств.
Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
Особое место занимают фосфорорганические соединения как экстрагенты, пластификаторы, смазочные вещества, присадки к пороху и абсорбенты в холодильных установках. Соли кислых алкилфосфатов используют как поверхностно-активные вещества, антифризы, специальные удобрения, антикоагулянты латекса и др. Кислые алкилфосфаты применяют для экстракционной переработки урановорудных щелоков.
Применение ортофосфорной кислоты в сельском хозяйстве. В звероводстве (в частности, при выращивании норок) используют выпойку р-ра ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Применение ортофосфорной кислоты в стоматологии. Ортофосфорная кислота применяется для снятия зубной эмали перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется тотальное протравливание зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после ее нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
Поэтому с появлением адгезивных материалов 5 и 6 поколения ортофосфорная кислота использоваться перестала.
Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
Особое место занимают фосфорорганические соединения как экстрагенты, пластификаторы, смазочные вещества, присадки к пороху и абсорбенты в холодильных установках. Соли кислых алкилфосфатов используют как поверхностно-активные вещества, антифризы, специальные удобрения, антикоагулянты латекса и др. Кислые алкилфосфаты применяют для экстракционной переработки урановорудных щелоков.
Применение ортофосфорной кислоты в сельском хозяйстве. В звероводстве (в частности, при выращивании норок) используют выпойку р-ра ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Применение ортофосфорной кислоты в стоматологии. Ортофосфорная кислота применяется для снятия зубной эмали перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется тотальное протравливание зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после ее нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
Поэтому с появлением адгезивных материалов 5 и 6 поколения ортофосфорная кислота использоваться перестала.
Слайд 9История открытия и получения фосфорной кислоты
Фосфорную кислоту открыл Р.
Бойль с помощью индикаторов. Сжигая фосфор и
растворяя образовавшийся белый продукт в воде он получил неизвестную
химикам кислоту. По исходному веществу он назвал её фосфорной.
Технически фосфорную кислоту впервые получили более 100 лет назад
разложением низкокачественных фосфоритов, содержащих значительные
количества соединений трехвалентных металлов, разбавленной (5-10% ) серной
кислотой, в которой соединения железа и особенно алюминия переходят в
раствор в незначительной степени.
Раствор с концентрацией 8-10% Р2О5 упаривали до содержания в нем примерно
40% Р2О5. При разложении фосфатной породы более концентрированной (30-40%)
серной кислотой выделяются игольчатые кристаллы гипса. Они удерживают
значительное количество жидкой фазы и плохо промываются. Вследствие этого
потери Р2О5 велики.
Существенным шагом вперед в производстве фосфорной кислоты был переход к
установкам непрерывного действия и разбавления 75 и 93% ной серной кислоты
не водой или слабыми промывочными водами, а раствором фосфорной кислоты,
т.е. проведение процесса с применением раствора разбавления. В этих
условиях выделяются ромбические кристаллы, которые хорошо фильтруются и
отмываются.
растворяя образовавшийся белый продукт в воде он получил неизвестную
химикам кислоту. По исходному веществу он назвал её фосфорной.
Технически фосфорную кислоту впервые получили более 100 лет назад
разложением низкокачественных фосфоритов, содержащих значительные
количества соединений трехвалентных металлов, разбавленной (5-10% ) серной
кислотой, в которой соединения железа и особенно алюминия переходят в
раствор в незначительной степени.
Раствор с концентрацией 8-10% Р2О5 упаривали до содержания в нем примерно
40% Р2О5. При разложении фосфатной породы более концентрированной (30-40%)
серной кислотой выделяются игольчатые кристаллы гипса. Они удерживают
значительное количество жидкой фазы и плохо промываются. Вследствие этого
потери Р2О5 велики.
Существенным шагом вперед в производстве фосфорной кислоты был переход к
установкам непрерывного действия и разбавления 75 и 93% ной серной кислоты
не водой или слабыми промывочными водами, а раствором фосфорной кислоты,
т.е. проведение процесса с применением раствора разбавления. В этих
условиях выделяются ромбические кристаллы, которые хорошо фильтруются и
отмываются.
Слайд 11Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и
трехзамещенные соли.
Н3РО4 + NaOH = NaH2PO4 + H2O (дигидрофосфат натрия)
H3PO4 + 2NaOH = Na2HPO4 + 2H2O (гидрофосфат натрия)
H3PO4 + 3NaOH = Na3PO4 + 3H2O (фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
NaH2PO4 = NaPO3 + H2O
2Na2HPO4 = Na4P2O7 + H2O
Фосфаты при прокаливании не разлагаются, исключение составляет (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Н3РО4 + NaOH = NaH2PO4 + H2O (дигидрофосфат натрия)
H3PO4 + 2NaOH = Na2HPO4 + 2H2O (гидрофосфат натрия)
H3PO4 + 3NaOH = Na3PO4 + 3H2O (фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
NaH2PO4 = NaPO3 + H2O
2Na2HPO4 = Na4P2O7 + H2O
Фосфаты при прокаливании не разлагаются, исключение составляет (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Слайд 12Получение фосфорной кислоты
Фосфорную кислоту получают из фосфорита:
Можно получить гидролизом пентахлорида фосфора:
Или
взаимодействием с водой оксид фосфора(V), полученного сжиганием фосфора в кислороде:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Слайд 16Экстракционный метод производства фосфорной кислоты
Фосфорную кислоту в лабораторных условиях легко
получить окислением фосфора 32%-ным раствором азотной кислоты:
Экстракционный метод производства фосфорной кислоты основан на реакции разложения природных фосфатов серной кислотой. Процесс состоит из двух стадий: разложения фосфатов и фильтрования образовавшейся фосфорной кислоты и промывки сульфата кальция водой.
Сернокислотное разложение фосфата кальция представляет гетерогенный необратимый процесс, протекающий в системе «твердое тело - жидкость» и описываемый уравнением: Ca5(PO4)3F + 5H2SO4 + nH3PO4 + 5mH2O = (n + 3)Н3РО4 + 5CaSO4 · mH2O + HF
Экстракционный метод производства фосфорной кислоты основан на реакции разложения природных фосфатов серной кислотой. Процесс состоит из двух стадий: разложения фосфатов и фильтрования образовавшейся фосфорной кислоты и промывки сульфата кальция водой.
Сернокислотное разложение фосфата кальция представляет гетерогенный необратимый процесс, протекающий в системе «твердое тело - жидкость» и описываемый уравнением: Ca5(PO4)3F + 5H2SO4 + nH3PO4 + 5mH2O = (n + 3)Н3РО4 + 5CaSO4 · mH2O + HF
Слайд 17Для удобства записи и упрощения расчетов формула двойной соли фторапатита 3Са3(РО4)2·СаF2
записывается в виде Ca5(PO4)3F.
Часть образовавшейся фосфорной кислоты возвращается в процесс. Фактически фосфат разлагается смесью серной и фосфорной кислот. В зависимости от концентрации фосфорной кислоты в системе и температуры образующийся сульфат кальция может осаждаться в виде ангидрита (m = 0), полу гидрата (m = 0,5) и дигидрата (m = 2). В соответствии с этим различают три варианта экстракционного метода производства фосфорной кислоты: ангидридный, полугидратный и дигидратный.
Температурный режим зависит от варианта экстракционного процесса. В дигидратном методе гидратированный сульфат кальция осаждается в форме дигидрата при 70 - 80°С и концентрации кислоты в реакционной смеси 20 -32% Р2О5, в полугидратном методе - в форме полугидрата при 90 - 100°С и концентрации кислоты 35 - 42% Р2О5
Часть образовавшейся фосфорной кислоты возвращается в процесс. Фактически фосфат разлагается смесью серной и фосфорной кислот. В зависимости от концентрации фосфорной кислоты в системе и температуры образующийся сульфат кальция может осаждаться в виде ангидрита (m = 0), полу гидрата (m = 0,5) и дигидрата (m = 2). В соответствии с этим различают три варианта экстракционного метода производства фосфорной кислоты: ангидридный, полугидратный и дигидратный.
Температурный режим зависит от варианта экстракционного процесса. В дигидратном методе гидратированный сульфат кальция осаждается в форме дигидрата при 70 - 80°С и концентрации кислоты в реакционной смеси 20 -32% Р2О5, в полугидратном методе - в форме полугидрата при 90 - 100°С и концентрации кислоты 35 - 42% Р2О5
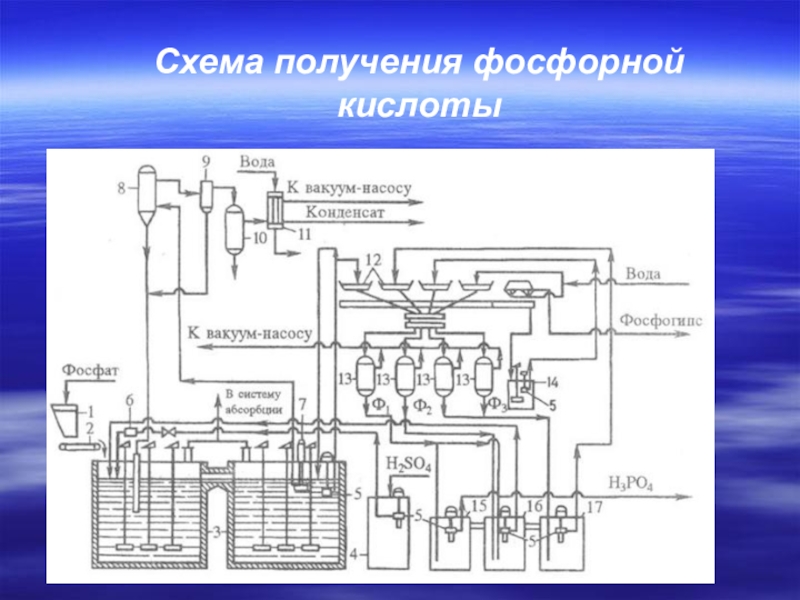
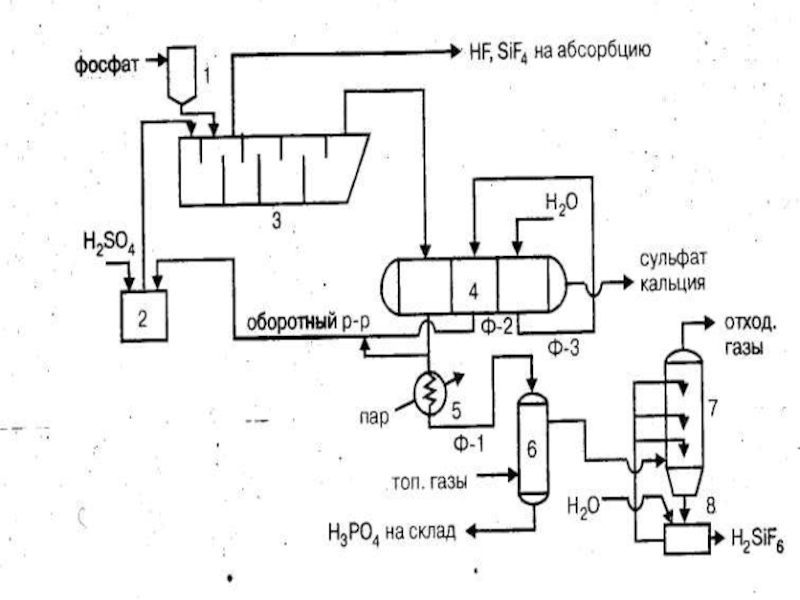
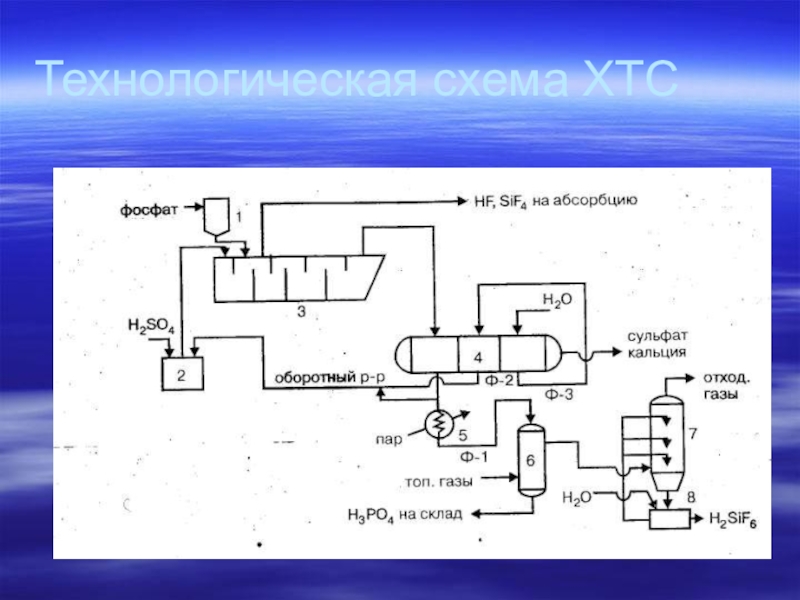
Слайд 19Технологическая схема производства экстракционной фосфорной кислоты полугидратным методом:
1 - бункер фосфата,
2 - сборник серной кислоты,
3 - экстрактор,
4 - вакуум-фильтр,
5 - подогреватель фосфорной кислоты,
6 - концентратор,
7 - промывной скруббер,
8 -сборник промывной жидкости.
Слайд 21Производство фосфорной кислоты электротермическим методом
Электротермический метод производства фосфорной кислоты основан на
восстановлении фосфатов до элементарного фосфора, его последующем окислении до оксида фосфора (V) и гидратации оксида до фосфорной кислоты:
Ca5(PO4)3F→ Рn → Р2О5 → Н3РО4.
В отсутствии флюсов реакция восстановления протекает при 1400°С в течение 20 минут. Для снижения температуры процесса и смещения равновесия реакции вправо в систему вводят оксид кремния, оксид алюминия или алюмосиликаты, связывающие образующийся оксид кальция в виде легко удаляемого шлака:
2Ca5(PO4)3F + 15С + 6SiO2 ↔ЗР2 + 15СО + 3(3CaO·2SiO2) + CaF2 + ΔН
ΔН = 1730 кДж.
Сжигание фосфора - гетерогенный экзотермический процесс, протекает по уравнению:
Р4 жидк. + 5О2 газ = Р4О10 тв - ΔН; ΔН = 753кДж
Гидратация оксида фосфора (V) протекает через ряд стадии. На первой стадии процесса, вследствие высокой температуры в системе, взаимодействие паров оксида фосфора с водой дает метафосфорную кислоту.
Р4Н10 + 2Н2О = 4НРО3 - ΔН.
При понижении температуры метафосфорная кислота через полифосфорные кислоты превращается в фосфорную (ортофосфорную) кислоту:
НРОз + Н2О = Н3РО4 - ΔН.
Ca5(PO4)3F→ Рn → Р2О5 → Н3РО4.
В отсутствии флюсов реакция восстановления протекает при 1400°С в течение 20 минут. Для снижения температуры процесса и смещения равновесия реакции вправо в систему вводят оксид кремния, оксид алюминия или алюмосиликаты, связывающие образующийся оксид кальция в виде легко удаляемого шлака:
2Ca5(PO4)3F + 15С + 6SiO2 ↔ЗР2 + 15СО + 3(3CaO·2SiO2) + CaF2 + ΔН
ΔН = 1730 кДж.
Сжигание фосфора - гетерогенный экзотермический процесс, протекает по уравнению:
Р4 жидк. + 5О2 газ = Р4О10 тв - ΔН; ΔН = 753кДж
Гидратация оксида фосфора (V) протекает через ряд стадии. На первой стадии процесса, вследствие высокой температуры в системе, взаимодействие паров оксида фосфора с водой дает метафосфорную кислоту.
Р4Н10 + 2Н2О = 4НРО3 - ΔН.
При понижении температуры метафосфорная кислота через полифосфорные кислоты превращается в фосфорную (ортофосфорную) кислоту:
НРОз + Н2О = Н3РО4 - ΔН.
Слайд 22Технологические схемы производства фосфорной кислоты термическим методом:
— двухступенчатая, одноступенчатая
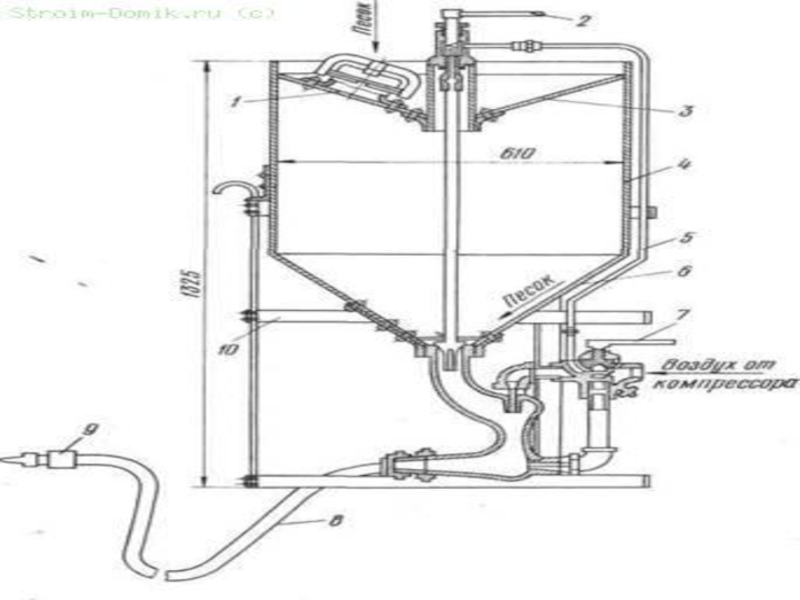
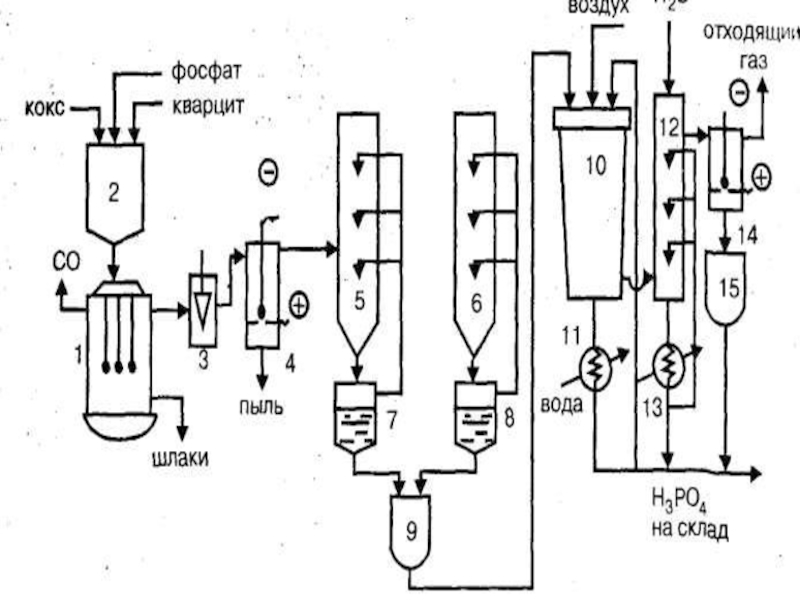
Слайд 23Технологическая схема производства термической фосфорной кислоты двухстадийным методом:
1 - электропечь,
2 - бункер шихты,
3 - газоотсекатель,
4, 14 - электрофильтры,
5 -горячий конденсатор,
6 - холодный конденсатор,
7, 8 - сборник жидкого фосфора,
9 -отстойник жидкого фосфора,
10 - башня сгорания,
11, 13 - холодильники,
12 - башня гидратации,
15 - сборник фосфорной кислоты.
Слайд 25Проблема получения оксида фосфора (V) непосредственно из фосфатов термической диссоциацией трикалийфосфата:
Са3(РО4)2 → ЗСаО + Р2О5 + ΔН
По аналогии с промышленным процессом диссоциации карбоната кальция:
СаСОз → СаО + СО2+ΔН, где ΔН = 178 кДж.
Химическая схема ХТС:
Ca5(PO4)3F + 5H2SO4 + nH3PO4 + 5mH2O=(n + 3)Н3РО4 + 5CaSO4 · mH2O + HF
При действии на металлическую поверхность раствором фосфорной кислоты с добавками Zn или Mn образуется защитная пленка (фосфатирование). Фосфорная кислота при нагревании теряет воду с образованием последовательно пиро- и метафосфорных кислот:
От других фосфорных кислот H3PO4 можно отличить по реакции с AgNO3 - выпадает желтый осадок Ag3PO4. Остальные фосфорные кислоты образуют белые осадки.
Слайд 27Технологическая схема производства экстракционной фосфорной кислоты полугидратным методом:
1 - бункер фосфата,
2 - сборник серной кислоты,
3 - экстрактор,
4 - вакуум-фильтр,
5 - подогреватель фосфорной кислоты,
6 - концентратор,
7 - промывной скруббер,
8 -сборник промывной жидкости.