- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Основания
Содержание
- 1. Презентация по химии на тему Основания
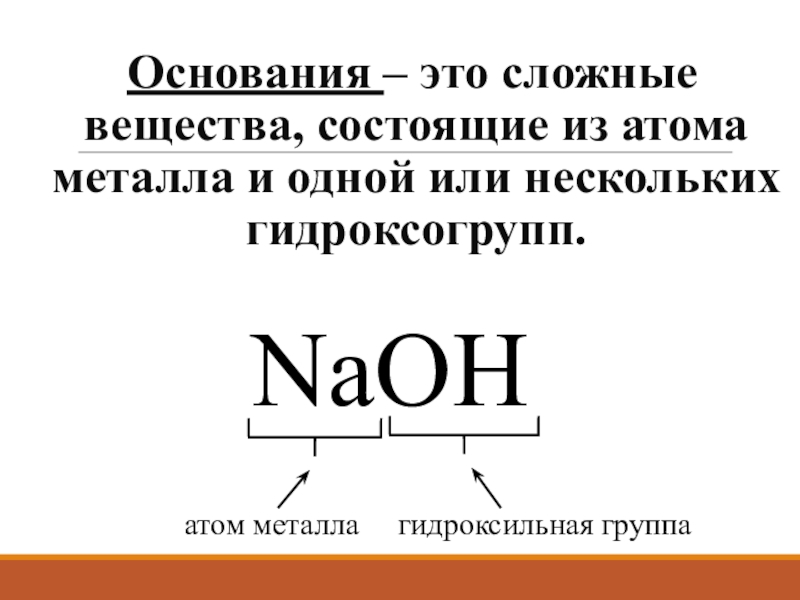
- 2. Основания – это сложные вещества, состоящие из
- 3. Состав оснований: Ме(ОН)хКоличество гидроксогрупп определяется валентностью металла, образующего основание.+х
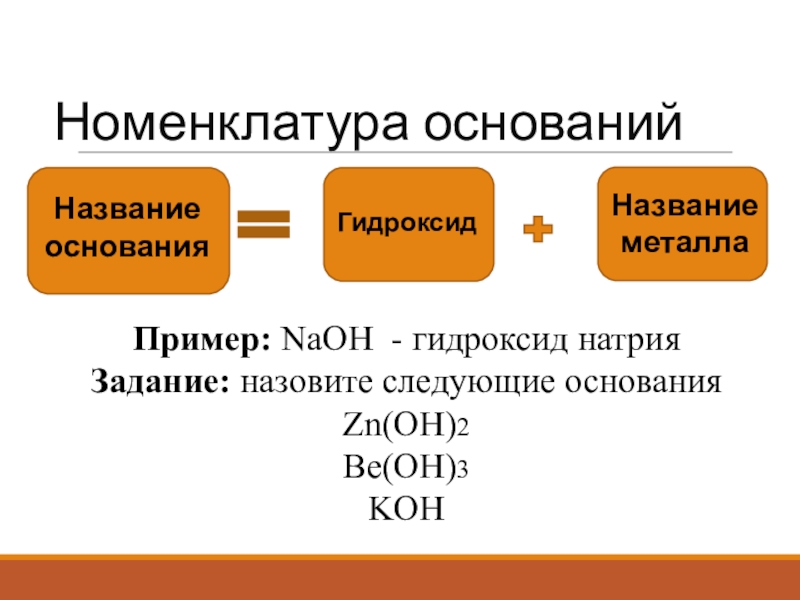
- 4. Номенклатура основанийНазвание основанияГидроксидНазвание металлаПример: NaOH - гидроксид натрияЗадание: назовите следующие основанияZn(OH)2 Be(OH)3KOH
- 5. Выберите формулы оснований. Назовите их. НСl
- 6. Классификация оснований
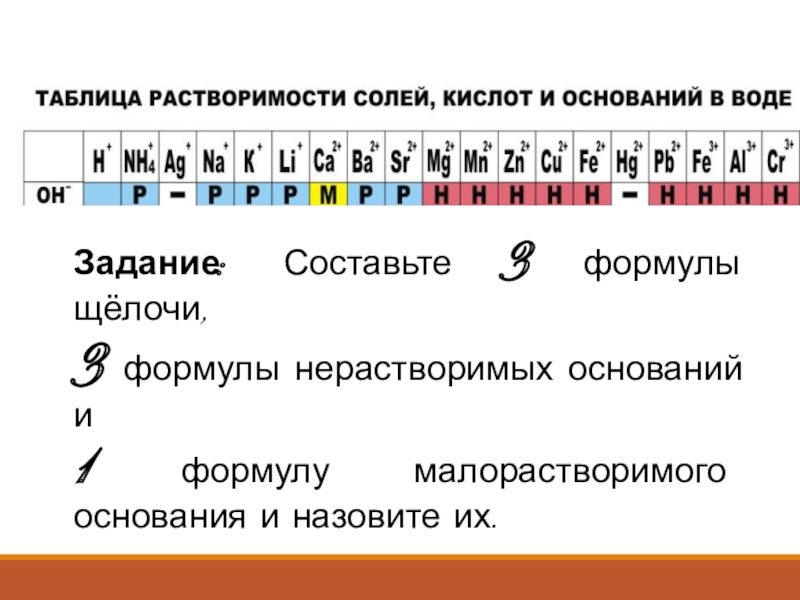
- 7. Задание: Составьте 3 формулы щёлочи, 3 формулы
- 8. Физические свойства основанийЦвет:Белый – КОН Голубой – Cu(OH)2Красно-бурый – Fe(OH)3КОНCu(OH)2Fe(OH)3
- 9. 1. Термическое разложение нерастворимых оснований:Химические свойства нерастворимых оснований
- 10. 2. Основание + кислота: Mg(OH)2 + 2HCl → MgCl2 + 2H2O Химические свойства нерастворимых оснований
- 11. Минутка релаксации
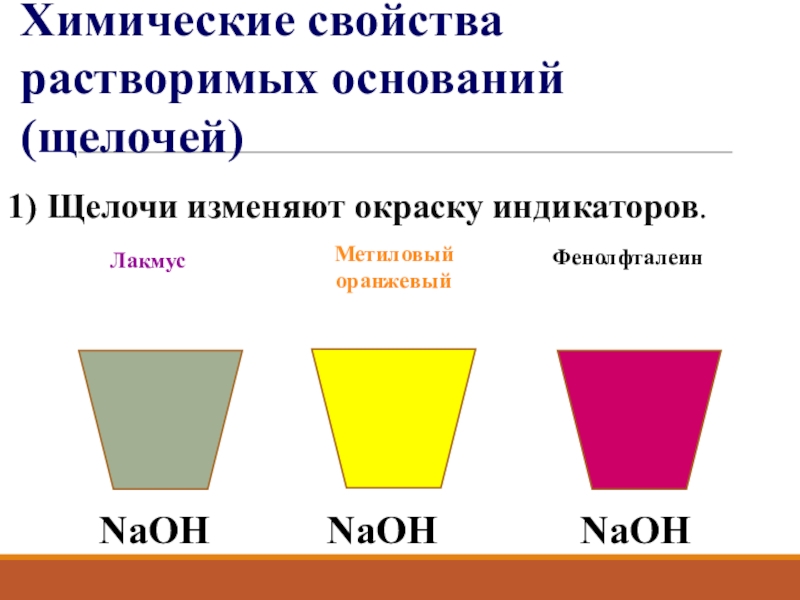
- 12. 1) Щелочи изменяют окраску индикаторов.NaOHЛакмус Метиловый оранжевыйФенолфталеинХимические свойства растворимых оснований (щелочей)NaOHNaOH
- 13. 2. Взаимодействие с кислотами В ходе реакции
- 14. 3. Взаимодействие с кислотными оксидами В ходе
- 15. Условия протекания реакции: 1)Исходные вещества должны быть
- 16. Выполните задание. Допишите уравнения реакций. Назовите вещества.1
- 17. Способы получения оснований1. Общим методом получения оснований
- 18. Применение основанийГидроксид натрия Самая популярная и востребованная в
- 19. Вопросы для самоконтроляДайте определение основаниям.На какие группы делят основания?Где применяются основания?
- 20. Выберите афоризм, характеризующий ваше состояние в конце занятия Светлая головаКаша в головеНи в зуб ногой
- 21. Домашнее задание.1) Рефераты:Серная кислота – «хлеб химической промышленности».Использование
Слайд 2Основания – это сложные вещества, состоящие из атома металла и одной
NaОН
атом металла гидроксильная группа
Слайд 3Состав оснований:
Ме(ОН)х
Количество гидроксогрупп определяется валентностью металла, образующего основание.
+х
Слайд 4Номенклатура оснований
Название основания
Гидроксид
Название металла
Пример: NaOH - гидроксид натрия
Задание: назовите следующие основания
Zn(OH)2
Be(OH)3
KOH
Слайд 5Выберите формулы оснований. Назовите их.
НСl NaOH Na2O
Fe(OH)3 MgO Cu(OH)2
Слайд 7Задание: Составьте 3 формулы щёлочи,
3 формулы нерастворимых оснований и
1
Слайд 8Физические свойства оснований
Цвет:
Белый – КОН
Голубой – Cu(OH)2
Красно-бурый – Fe(OH)3
КОН
Cu(OH)2
Fe(OH)3
Слайд 91. Термическое разложение нерастворимых оснований:
Химические свойства нерастворимых оснований
Слайд 102. Основание + кислота:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Химические свойства нерастворимых оснований
Слайд 121) Щелочи изменяют окраску индикаторов.
NaOH
Лакмус
Метиловый оранжевый
Фенолфталеин
Химические свойства растворимых оснований (щелочей)
NaOH
NaOH
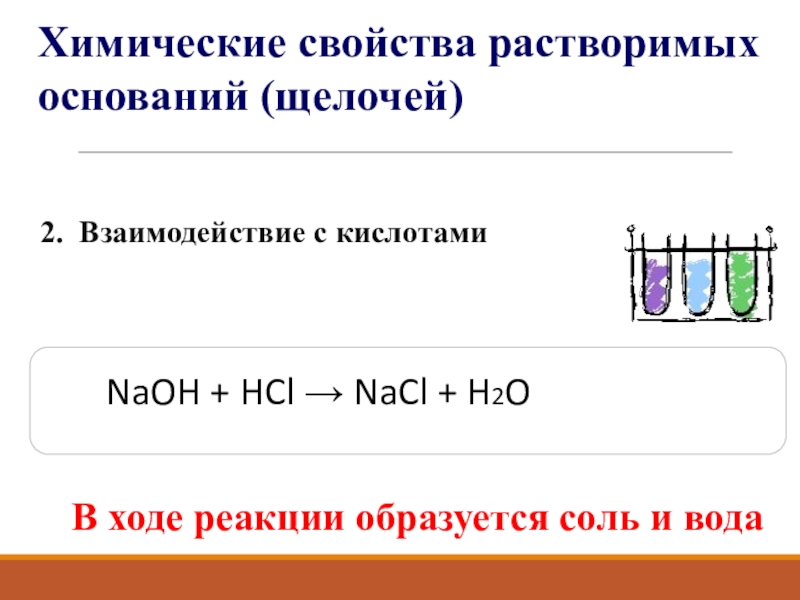
Слайд 132. Взаимодействие с кислотами
В ходе реакции образуется соль и вода
NaOH
Химические свойства растворимых оснований (щелочей)
Слайд 143. Взаимодействие с кислотными оксидами
В ходе реакции образуется соль и
Ca(OH)2 + CO2 → CaCO3 + H2O
Химические свойства растворимых оснований (щелочей)
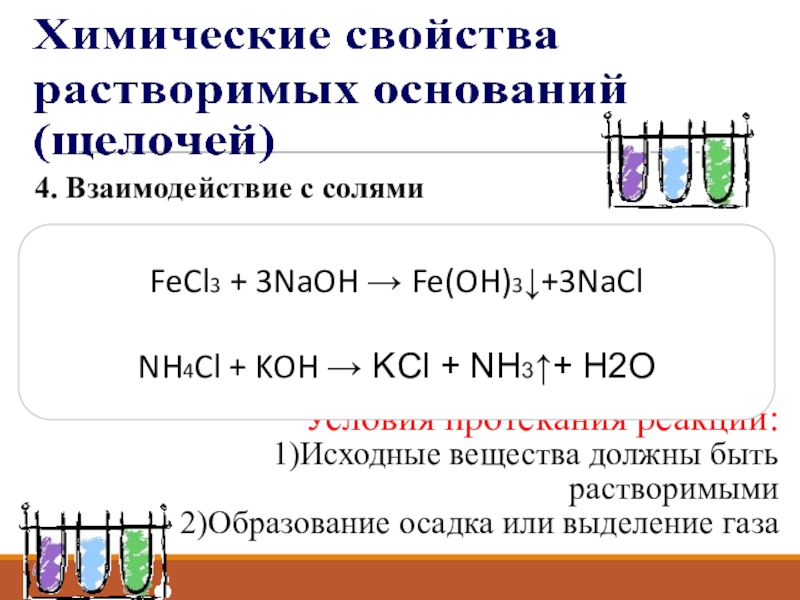
Слайд 15Условия протекания реакции: 1)Исходные вещества должны быть растворимыми 2)Образование осадка или выделение газа
4. Взаимодействие с солями
FeCl3 + 3NaOH → Fe(OH)3↓+3NaCl
NH4Cl + KOH → KCl + NH3↑+ H2O
Слайд 16Выполните задание. Допишите уравнения реакций. Назовите вещества.
1 ВАРИАНТ
1) NaOH + H2SO4
2) NaOH + фенолфталеин =
3) Mg(OH)2 →
2 ВАРИАНТ
1) КOH + HNO3 =
2) KOH + лакмус =
3) Pb(OH)2 →
t
t
Слайд 17Способы получения оснований
1. Общим методом получения оснований является реакция обмена:
CuSO4 +
K2SO4 + Ba(OH)2 = 2KOH + BaCO3↓.
2. Щелочи в технике обычно получают электролизом водных растворов хлоридов:
2NaCl + 2H2O = 2NaOH + H2 + Cl2.
3. Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой:
2Li + 2H2O = 2LiOH + H2↑,
SrO + H2O = Sr(OH)2.
Слайд 18Применение оснований
Гидроксид натрия
Самая популярная и востребованная в мире щелочь.
Применяется в производстве
Гидроксид калия
Применяется для производства мыла, калийных удобрений, в производстве батареек и аккумуляторов.
КОН
Слайд 19Вопросы для самоконтроля
Дайте определение основаниям.
На какие группы делят основания?
Где применяются основания?
Слайд 20Выберите афоризм, характеризующий ваше состояние в конце занятия
Светлая голова
Каша
Ни в зуб ногой
Слайд 21Домашнее задание.
1) Рефераты:
Серная кислота – «хлеб химической промышленности».
Использование минеральных кислот на предприятиях
2) Несколькими словами описать применение следующих оснований:
1 вариант: гидроксид алюминия, гидроксид магния, гидроксид железа
2 вариант: гидроксид меди, гидроксид кальция, гидроксид кобальта