им. И. А. Бунина Шипилова Н.В.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Основания в свете ТЭД
Содержание
- 1. Презентация по химии на тему Основания в свете ТЭД
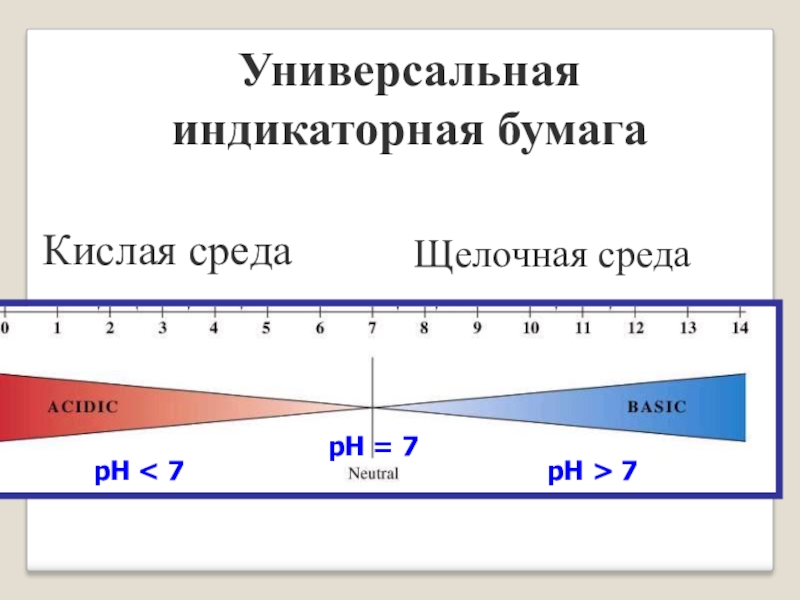
- 2. рН < 7рН = 7рН > 7Универсальная индикаторная бумагаКислая средаЩелочная среда
- 3. ОСНОВАНИЯ в свете ТЭД
- 4. Основания, в свете теории электролитической диссоциации
- 5. 1) познакомить практически с химическими свойствами оснований
- 6. Т Э Д
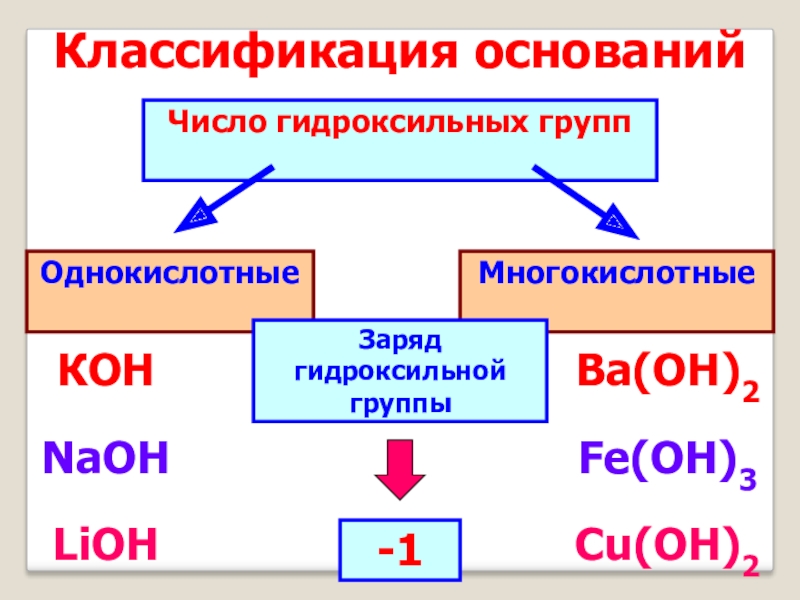
- 7. Классификация основанийЧисло гидроксильных группОднокислотные Многокислотные КОНNaOHLiOHBa(ОН)2Fe(OH)3Cu(OH)2Заряд гидроксильной группы-1
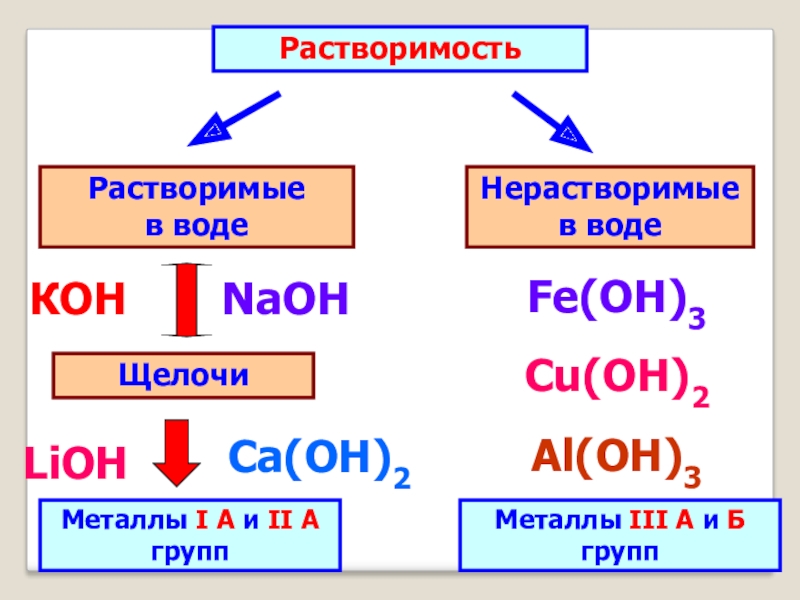
- 8. РастворимостьРастворимые в воде Нерастворимые
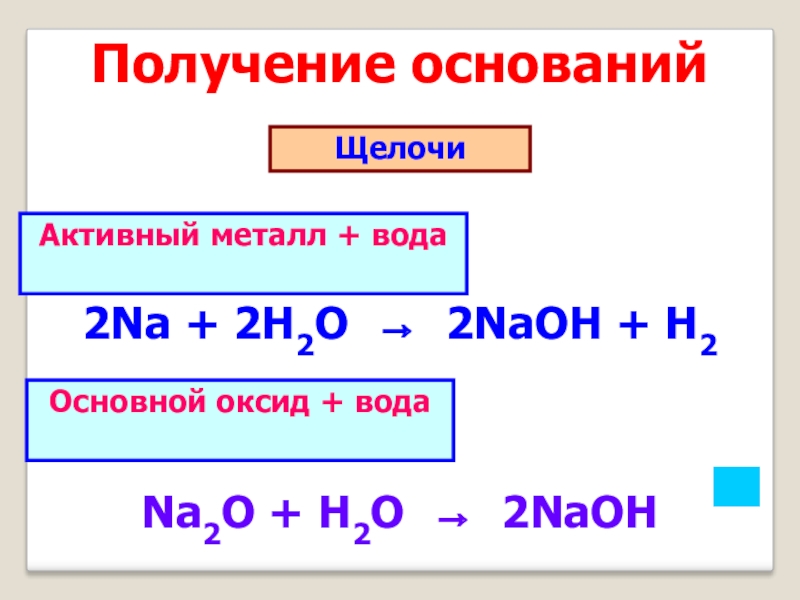
- 9. Получение основанийЩелочи 2Na + 2H2O → 2NaOH
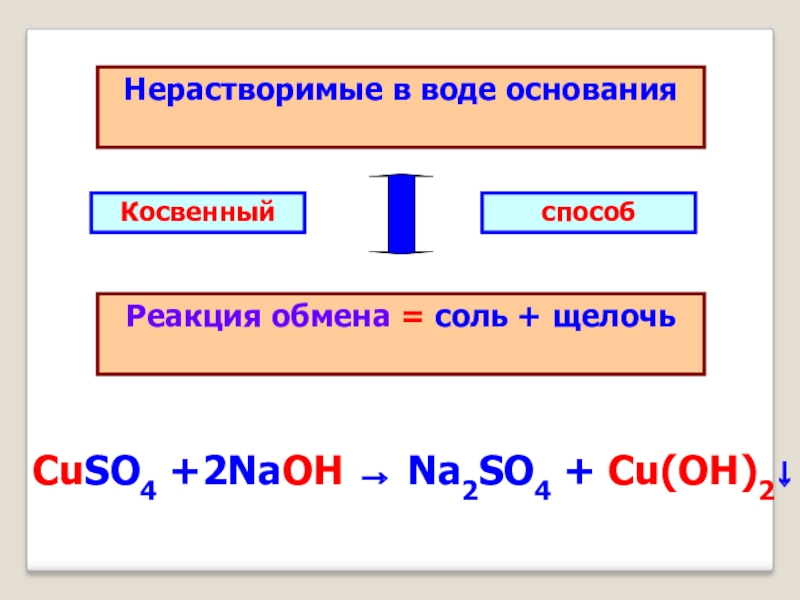
- 10. Нерастворимые в воде основанияРеакция обмена = соль + щелочьКосвенный способCuSO4 +2NaOH → Na2SO4 + Cu(OH)2↓
- 11. Химические свойства основанийЩелочи изменяют окраску индикаторовЛакмус Метиловый оранжевыйФенолфталеиновыйСинийЖелтыйМалиновый
- 12. Техникабезопасности
- 13. Изучение химических свойств оснований Опыт №1. Взаимодействие
- 14. Можно ли использовать при стирке в качестве дополнительного средства к порошку вещества, содержащие кислую среду?Вопрос
- 15. Опыт №2. Пример №1 Взаимодействие щелочей
- 16. Опыт №2. Пример №2 Взаимодействие щелочей с
- 17. Опыт №3. Взаимодействие щелочей с оксидами неметаллов.Запишите
- 18. Рефлексия:Вариант 1
- 19. Выбрать оксиды, с которыми реагирует:
- 20. ДОМАШНЕЕ ЗАДАНИЕП.39 №3 (закончить уравнения реакций до конца, написать сокращенные ионные уравнения).№4 (решить задачу) ПИСЬМЕННО!
рН < 7рН = 7рН > 7Универсальная индикаторная бумагаКислая средаЩелочная среда
Слайд 51) познакомить практически с химическими свойствами оснований в свете теории электролитической
диссоциации;
развивать умения и навыки работы с химическими реактивами и химическим оборудованием;
2) учить сравнивать, анализировать, делать выводы;
3) совершенствовать умения и навыки в написании формул веществ и уравнений химических реакций.
развивать умения и навыки работы с химическими реактивами и химическим оборудованием;
2) учить сравнивать, анализировать, делать выводы;
3) совершенствовать умения и навыки в написании формул веществ и уравнений химических реакций.
ЦЕЛИ УРОКА:
Слайд 7Классификация оснований
Число гидроксильных групп
Однокислотные
Многокислотные
КОН
NaOH
LiOH
Ba(ОН)2
Fe(OH)3
Cu(OH)2
Заряд гидроксильной группы
-1
Слайд 8Растворимость
Растворимые в воде
Нерастворимые в воде
Щелочи
Металлы
I А и II А групп
КОН
NaOH
Ca(ОН)2
LiOH
Fe(OH)3
Cu(OH)2
Al(ОН)3
Металлы III А и Б групп
Слайд 9Получение оснований
Щелочи
2Na + 2H2O → 2NaOH + H2
Na2O + H2O
→ 2NaOH
Активный металл + вода
Основной оксид + вода
Слайд 10Нерастворимые в воде основания
Реакция обмена = соль + щелочь
Косвенный
способ
CuSO4 +2NaOH
→ Na2SO4 + Cu(OH)2↓
Слайд 11Химические свойства оснований
Щелочи изменяют окраску индикаторов
Лакмус
Метиловый оранжевый
Фенолфталеиновый
Синий
Желтый
Малиновый
Слайд 13Изучение химических свойств оснований
Опыт №1. Взаимодействие оснований(щелочей) с кислотами.
Возьмите пробирку. Налейте в нее 1 мл раствора гидроксида натрия.
Добавьте в нее 1 каплю фенолфталеина. Что наблюдаете? Затем в нее
прилейте 2 мл соляной кислоты. Что наблюдаете? Запишите уравнение
реакции в молекулярной, полной и сокращенной ионной форме. Объясните, за счет каких ионов произошло химическое взаимодействие?
Добавьте в нее 1 каплю фенолфталеина. Что наблюдаете? Затем в нее
прилейте 2 мл соляной кислоты. Что наблюдаете? Запишите уравнение
реакции в молекулярной, полной и сокращенной ионной форме. Объясните, за счет каких ионов произошло химическое взаимодействие?
Слайд 14Можно ли использовать при стирке в качестве дополнительного средства к порошку
вещества, содержащие кислую среду?
Вопрос
Слайд 15 Опыт №2. Пример №1 Взаимодействие щелочей с солями.
В пробирку с сульфатом железа (II) налейте 1 мл гидроксида натрия.
Что наблюдаете? Запишите уравнение этой реакции в молекулярной, полной и сокращенной ионной форме. Объясните, за счет каких ионов произошло химическое взаимодействие?
Что наблюдаете? Запишите уравнение этой реакции в молекулярной, полной и сокращенной ионной форме. Объясните, за счет каких ионов произошло химическое взаимодействие?
Слайд 16Опыт №2. Пример №2 Взаимодействие щелочей с солями
В пробирку с хлоридом железа (III) наливаем 1-2 мл раствора гидроксида натрия.
Какие изменения произошли? Запишите уравнение реакции в молекулярной, полной и сокращенной ионной форме. Объясните, за счет каких ионов произошло химическое взаимодействие?
Какие изменения произошли? Запишите уравнение реакции в молекулярной, полной и сокращенной ионной форме. Объясните, за счет каких ионов произошло химическое взаимодействие?
Слайд 17Опыт №3. Взаимодействие щелочей с оксидами неметаллов.
Запишите уравнение реакции в молекулярной,
полной и сокращенной ионной форме. Объясните, за счет каких ионов произошло химическое взаимодействие?
Слайд 18Рефлексия:
Вариант 1
Вариант2
Данны вещества: CaO, AI(OH)3, HCI, KOH, Na2SO4, MgO, BA(OH)2, H2SO4, N2O5, NaOH, HNO3, Ca(OH)2, MgCO3, Fe(OH)3.
Выбрать щелочи Выбрать нерастворимые
2. В растворах щелочей
Фенолфталеин Лакмус
а)бесцветный; б)синий; в) малиновый;
г) красный
Данны вещества: CaO, AI(OH)3, HCI, KOH, Na2SO4, MgO, BA(OH)2, H2SO4, N2O5, NaOH, HNO3, Ca(OH)2, MgCO3, Fe(OH)3.
Выбрать щелочи Выбрать нерастворимые
2. В растворах щелочей
Фенолфталеин Лакмус
а)бесцветный; б)синий; в) малиновый;
г) красный
Слайд 20ДОМАШНЕЕ ЗАДАНИЕ
П.39
№3 (закончить уравнения реакций до конца, написать сокращенные ионные
уравнения).
№4 (решить задачу) ПИСЬМЕННО!
№4 (решить задачу) ПИСЬМЕННО!