- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Основания
Содержание
- 1. Презентация по химии на тему: Основания
- 2. Определение основанийМе(ОН)nКОН Ca(ОН)2 Al(ОН)3
- 3. Классификация основанийЧисло гидроксильных группОднокислотные Многокислотные КОНNaOHLiOHBa(ОН)2Fe(OH)3Cu(OH)2Заряд гидроксильной группы-1
- 4. РастворимостьРастворимые в воде Нерастворимые
- 5. Сильные и слабые основания
- 6. Получение основанийЩелочи 2Na + 2H2O → 2NaOH
- 7. Нерастворимые в воде основанияРеакция обмена = соль
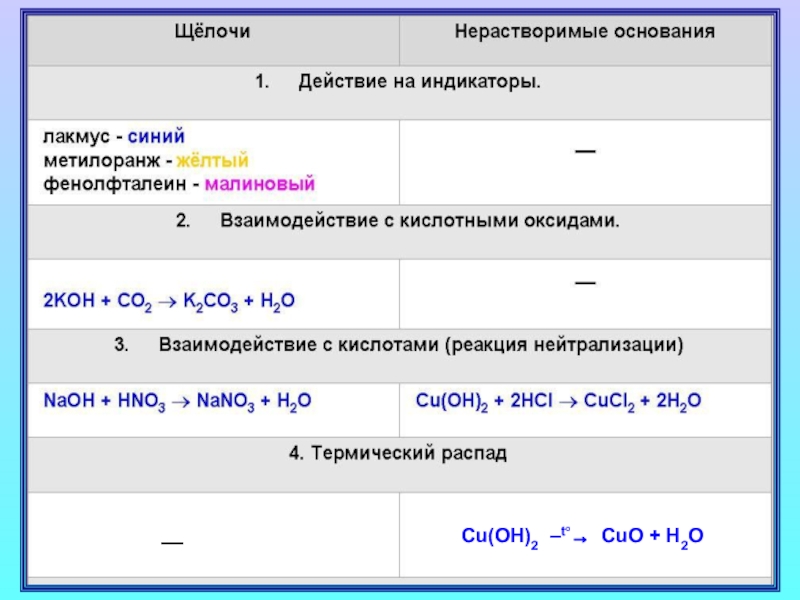
- 8. Химические свойства основанийЩелочи изменяют окраску индикаторовЛакмус Метиловый оранжевыйФенолфталеиновыйСинийЖелтыйМалиновый
- 9. Фенолфталеиновый в щелочах малиновыйИндикатор фиксирует
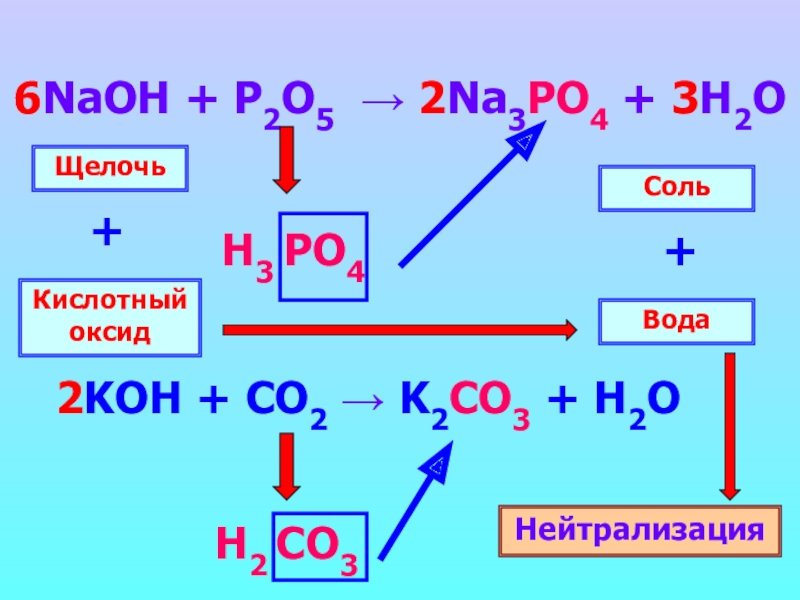
- 10. Основания реагируют с кислотамиНейтрализациящелочинерастворимыеоснованиесолькислотавода
- 11. Слайд 11
- 12. Индикатор Изменение рН среды
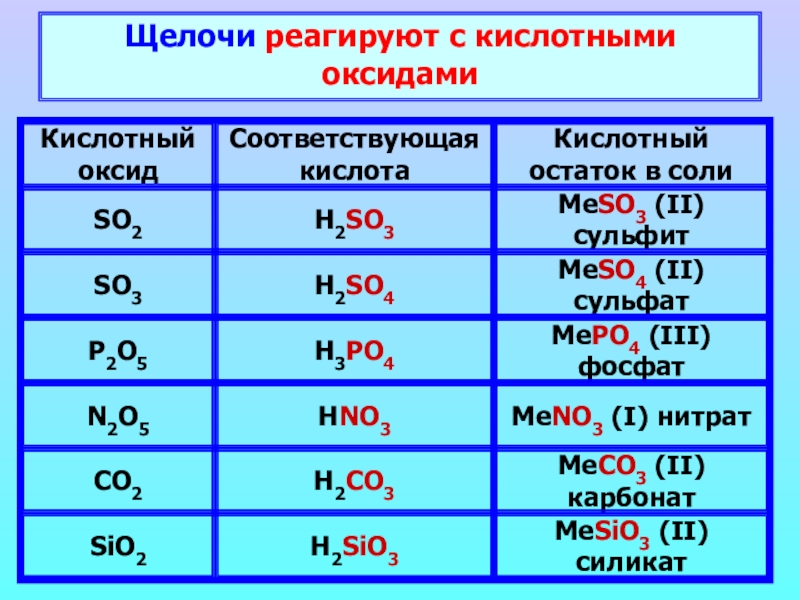
- 13. Щелочи реагируют с кислотными оксидами
- 14. 6NaOH + P2O5 → 2Na3PO4 + 3H2O Н3 PO4Н2 CO3Щелочь Кислотный оксид+Вода Соль +Нейтрализация
- 15. Нерастворимые основания
- 16. Cu(OH)2 –t°→ CuO + H2O––
Слайд 2Определение оснований
Ме(ОН)n
КОН Ca(ОН)2 Al(ОН)3 Ba(ОН)2
Гидроксиды
KOH →
Ba(ОН)2 → Ba+2 + 2 OH-1
Основания – вещества, в растворах которых содержатся гидроксильные ионы
Слайд 3Классификация оснований
Число гидроксильных групп
Однокислотные
Многокислотные
КОН
NaOH
LiOH
Ba(ОН)2
Fe(OH)3
Cu(OH)2
Заряд гидроксильной группы
-1
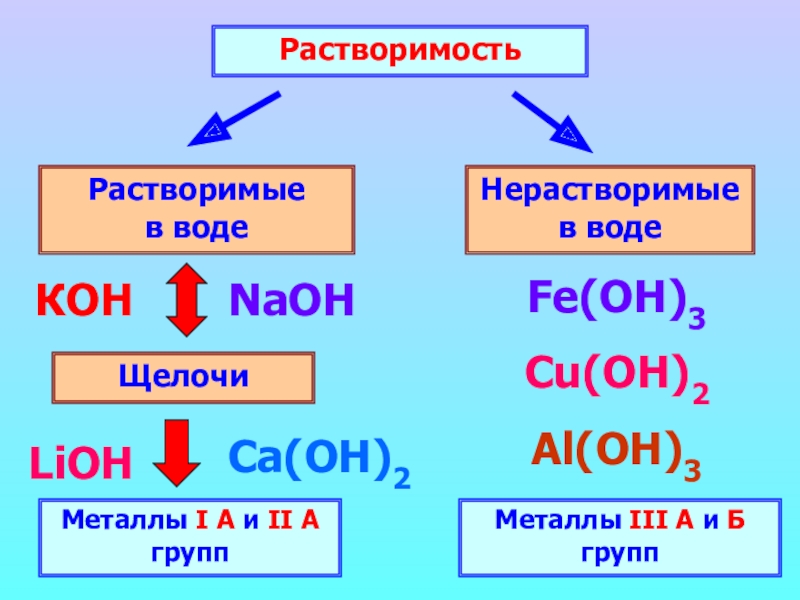
Слайд 4Растворимость
Растворимые в воде
Нерастворимые в воде
Щелочи
Металлы
КОН
NaOH
Ca(ОН)2
LiOH
Fe(OH)3
Cu(OH)2
Al(ОН)3
Металлы III А и Б групп
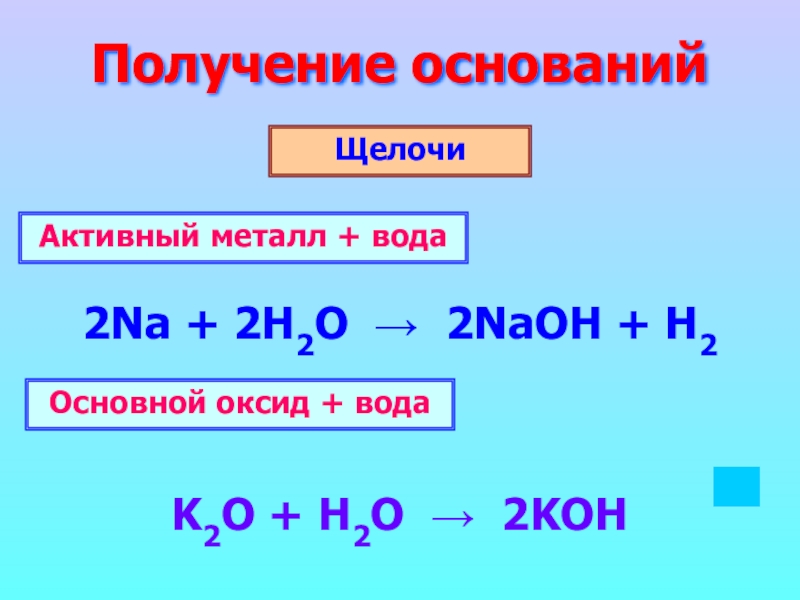
Слайд 6Получение оснований
Щелочи
2Na + 2H2O → 2NaOH + H2
K2O + H2O
Активный металл + вода
Основной оксид + вода
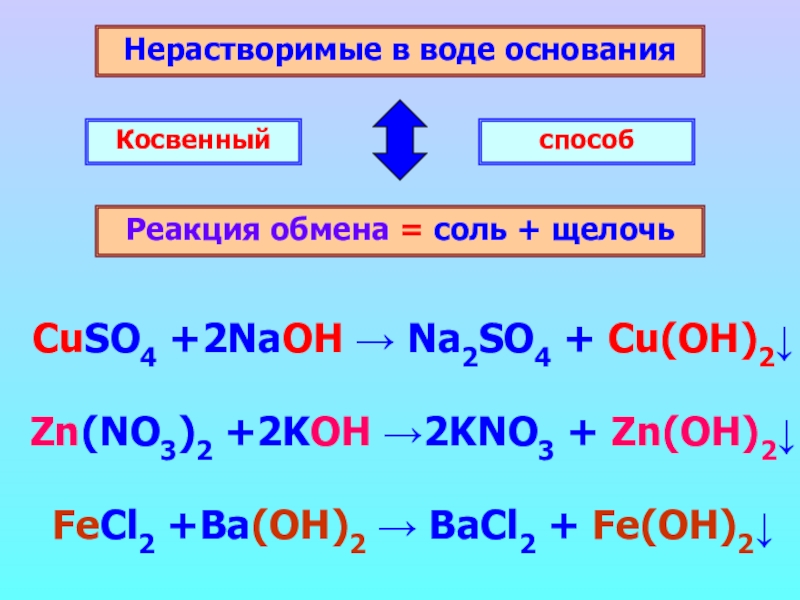
Слайд 7Нерастворимые в воде основания
Реакция обмена = соль + щелочь
Косвенный
способ
CuSO4 +2NaOH
Zn(NO3)2 +2KOH →2KNO3 + Zn(OH)2↓
FeCl2 +Ba(OH)2 → BaCl2 + Fe(OH)2↓
Слайд 8Химические свойства оснований
Щелочи изменяют окраску индикаторов
Лакмус
Метиловый оранжевый
Фенолфталеиновый
Синий
Желтый
Малиновый
Слайд 9Фенолфталеиновый в щелочах
малиновый
Индикатор фиксирует наличие ионов ОН- в
рН < 7
рН = 7
рН > 7
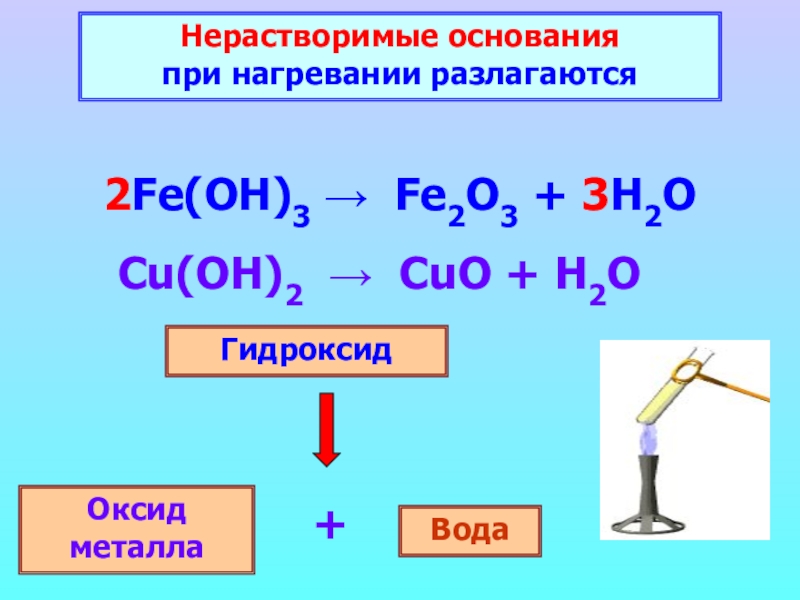
Слайд 15Нерастворимые основания
2Fe(OH)3 → Fe2O3 + 3H2O
Гидроксид
Оксид металла
Вода
+