- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Оксиды, их классификация и свойства
Содержание
- 1. Презентация по химии на тему Оксиды, их классификация и свойства
- 2. А что в этой шкатулке? Газ, необходимый растениям для фотосинтеза
- 3. А что в последней шкатулке?«…На рукомойнике моем
- 4. ТЕМА: «Оксиды, их классификация и свойства».
- 5. ЦЕЛЬ: рассмотреть классификацию оксидов и изучить
- 6. Ход урока: 1. оргмомент 2. изучение нового
- 7. Оксиды-это сложные вещества состоящие из двух видов
- 8. ПРОВЕРИМ:AL2O3 - оксид алюминия. CuO - оксид меди.N2O3- оксид азота(III).К2О3 - оксид калия
- 9. МОЛОДЦЫ
- 10. Что общего?Н2ОCuO CO2
- 11. Чем отличаются?Н2О CuO CO2
- 12. Н2О СО2НеметаллыКислотные оксиды
- 13. МеталлыОсновныеоксидыСаОMgOК2О
- 14. ДвуликиеГреч. «амфо» - двоякий, двойнойАмфора – древнегреческий сосуд с двумя ручкамиАмфибии – земноводные животные
- 15. АмфотерностьАмфотерность – способность элементов и веществ
- 16. ОКСИДЫСолеобразующие НесолеобразующиеCuO
- 17. 1. Способы получения оксидовВзаимодействие простых веществ с
- 18. 2. Горение сложных веществ:
- 19. 3. Разложение нерастворимых оснований при нагревании:
- 20. 4. Разложение солей:
- 21. Типичные реакции основных оксидов1. Основный оксид +
- 22. 2.Основный оксид + кислотный оксид
- 23. Типичные реакции кислотных оксидов1. Кислотный оксид +
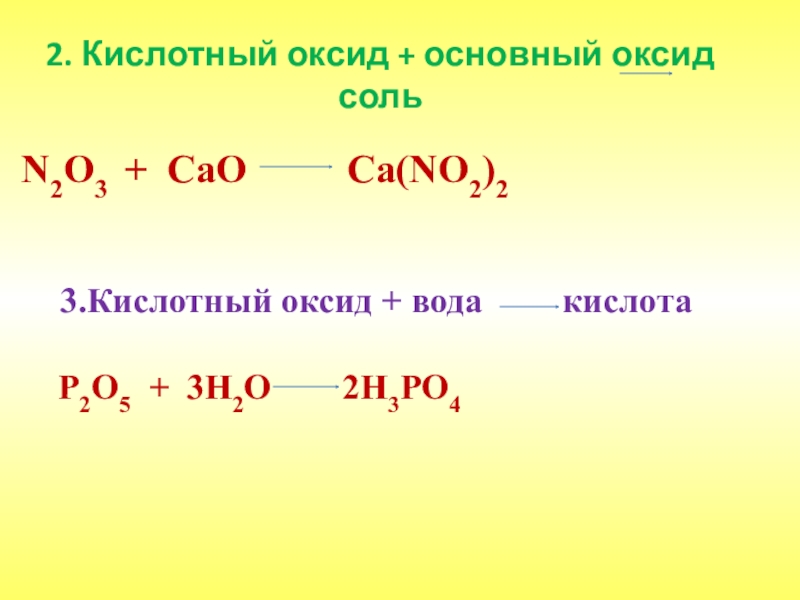
- 24. 2. Кислотный оксид + основный оксид
- 25. Типичные реакции амфотерных оксидов:ZnO,AI2O3,Cr2O3
- 26. Закрепление изученного материалаПроверим свои знания - тест1.
- 27. 2. Оксиды – это:а) вещества, в состав
- 28. 3. Как называется оксид SO2?в) оксид серы
- 29. 4. Какие вещества получим при разложении CaCO3?а)
- 30. Домашнее задание
- 31. ТЕСТС + О2
- 32. Задача № 1 CaBr2 найти
- 33. Найди ошибкуAg ( I )
- 34. Работа в паре (закончить уравнения реакции)
- 35. ТВОРЧЕСКАЯ РАБОТА «ПИРАМИДА» CaCuCr2S Na2O5ZnO2AI2ВеMgОFe2O3P2Li2K2OBaOAg2H2CBN2
- 36. Игра «Кто быстрее ?»Б А Л
Слайд 1Угадай, что находится
в первой шкатулке?
«Первое начало и сущность всего –
Слайд 3А что в последней шкатулке?
«…На рукомойнике моем
позеленела медь,
что весело глядеть…»
А. Ахматова
Слайд 5ЦЕЛЬ:
рассмотреть классификацию оксидов и изучить свойства данного класса соединений
Задачи:
-научить
-уметь составлять типичные реакции оксидов
Слайд 6Ход урока: 1. оргмомент 2. изучение нового материала 3. закрепление 4.самостоятельная работа 5. итог урока.
Слайд 7Оксиды
-это сложные вещества состоящие из двух видов атомов, один из которых
ПРИМЕРЫ:
AL2O3; СuO; N2O3; К2О
Назвать эти оксиды
Слайд 14 Двуликие
Греч. «амфо» - двоякий, двойной
Амфора – древнегреческий сосуд с двумя
Амфибии – земноводные животные
Слайд 15 Амфотерность
Амфотерность – способность элементов и веществ проявлять двойственные свойства.
Be
Примеры:
Al2O3 Fe2O3 ZnO
Слайд 16ОКСИДЫ
Солеобразующие Несолеобразующие
CuO ,Na2O , SO3, N2O5
кислотные основные амфотерные
SO2 P2O5 K2O MgO CuO Al2O3
Слайд 171. Способы получения оксидов
Взаимодействие простых веществ с кислородом:
С
2Сu + О2 = 2CuO
Слайд 193. Разложение нерастворимых оснований при нагревании:
СU(ОН)2 = СuO + Н2О
t
2Fe(ОН)3 = Fe2O3 + 3H2O
Слайд 21Типичные реакции основных оксидов
1. Основный оксид + кислота
K2O + H2SO4 K2SO4 + H2O
Слайд 222.Основный оксид + кислотный оксид соль
MgO +
3. Основный оксид + вода щелочь
Na2O + H2O 2NaOH
Слайд 23Типичные реакции кислотных оксидов
1. Кислотный оксид + основание
SO3 + 2KOH K2SO4 + H2O
Слайд 242. Кислотный оксид + основный оксид соль
N2O3
3.Кислотный оксид + вода кислота
P2O5 + 3H2O 2H3PO4
Слайд 25 Типичные реакции амфотерных оксидов:
ZnO,AI2O3,Cr2O3 ,BeO – амфотерные оксиды.
ZnO
ZnO + 2NaOH = Na2ZnO2 + H2O
цинкат
натрия
Слайд 26
Закрепление изученного материала
Проверим свои знания - тест
1. При нормальных условиях оксиды
а) только газообразные
б) только жидкие в) газообразные, жидкие и твердые г) только твердые
Слайд 272. Оксиды – это:
а) вещества, в состав которых
входит водород
б) вещества,
входит кислород
в) вещества, в состав которых
входят металлы
Слайд 283. Как называется оксид SO2?
в) оксид серы
г) оксид серы(II)
д) оксид серы
е) оксид серы (VI)
Слайд 294. Какие вещества получим при разложении
CaCO3?
а) СаО и СО2
б) Са
в) Са и СО2
г) С и СаО
Слайд 32
Задача № 1
CaBr2 найти массовые доли
Задача № 2
SO3 найти массовые доли элементов в соединений
№ 1 Ca – 20%. Br -80%
№ 2 S -40%. ,O – 60%
Слайд 33Найди ошибку
Ag ( I )
C ( I ) O ( III)
АI (I ) Zn ( II )
S (III) Cu ( II )
К ( III) Ве ( I )
Правильный ответ
Ag ( I ) H ( I)
C ( IV ) O ( II)
АI (III ) Zn ( II )
S (II) Cu ( II )
Слайд 34Работа в паре (закончить уравнения реакции)
___ + I2
Fe + ___ = FeCI3
___ + H2 = CH4
Ba + ___ = BaO
__ + Br2 = AIBr3
ОТВЕТ
2 AI + 3I2 = 2AI I3
2Fe + 3CI2 = 2FeCI3
C + 2H2 = CH4
2Ba + O2 = 2BaO
2AI + 3 Br2 = 2AIBr3