- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Оксиды (8 класс)
Содержание
- 1. Презентация по химии на тему: Оксиды (8 класс)
- 2. План урока: Повторение опорных знаний
- 3. План характеристики класса неорганических соединенийОпределение класса, общая формула.Классификация.Номенклатура соединений.Способы получения.Химические свойства.Применение.
- 4. состав, номенклатура, получениеО К С И Д Ы:
- 5. О к с и д ы-сложные вещества, состоящие из ______ _________, один из которых _____________.
- 6. О к с и д ы-сложные вещества, состоящие из двух элементов, один из которых кислород.
- 7. Общая формула оксидовЭхОу
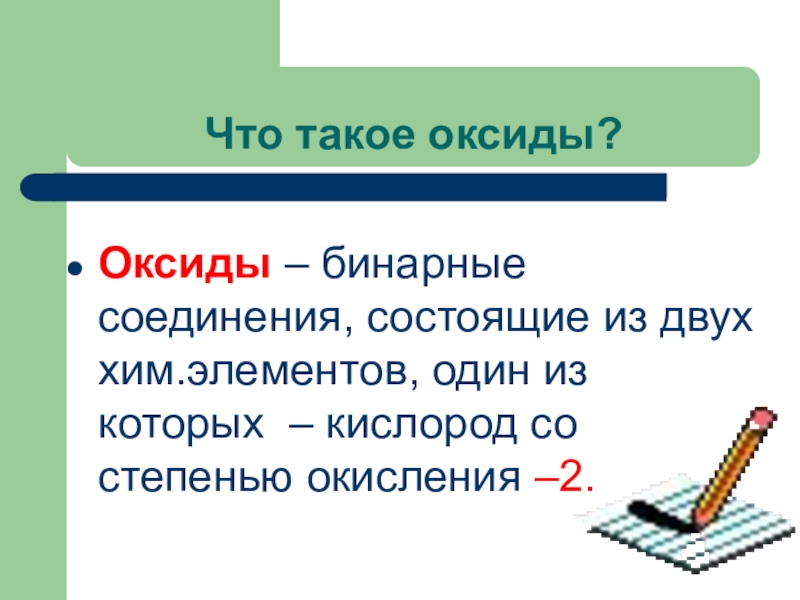
- 8. Что такое оксиды?Оксиды – бинарные соединения, состоящие
- 9. «Третий лишний» SO3 NaOH H2O HCl Cl2O7 Fe2O3
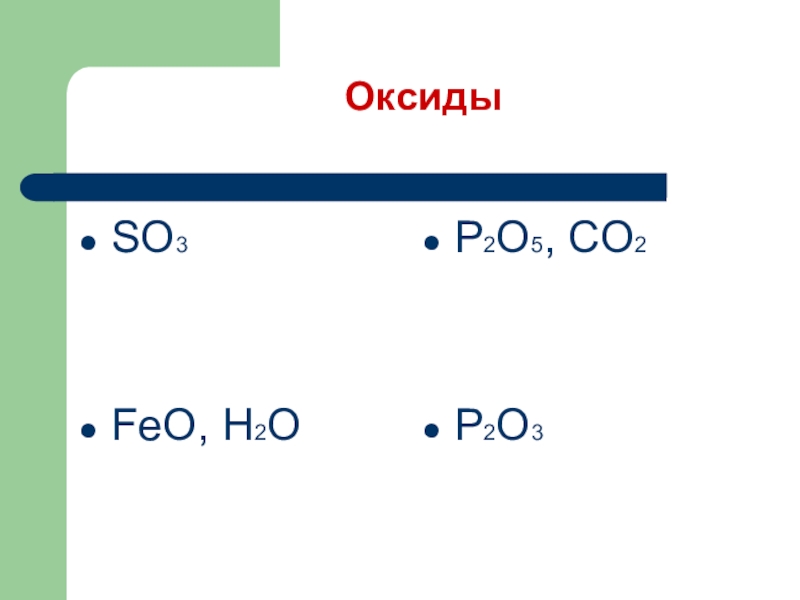
- 10. Выбрать формулы оксидовSO3, Ca(OH)2FeO, H2O H2CO3, KOHP2O5, CO2 FeCl3, P2O3H2SO4, HCl
- 11. ОксидыSO3FeO, H2OP2O5, CO2P2O3
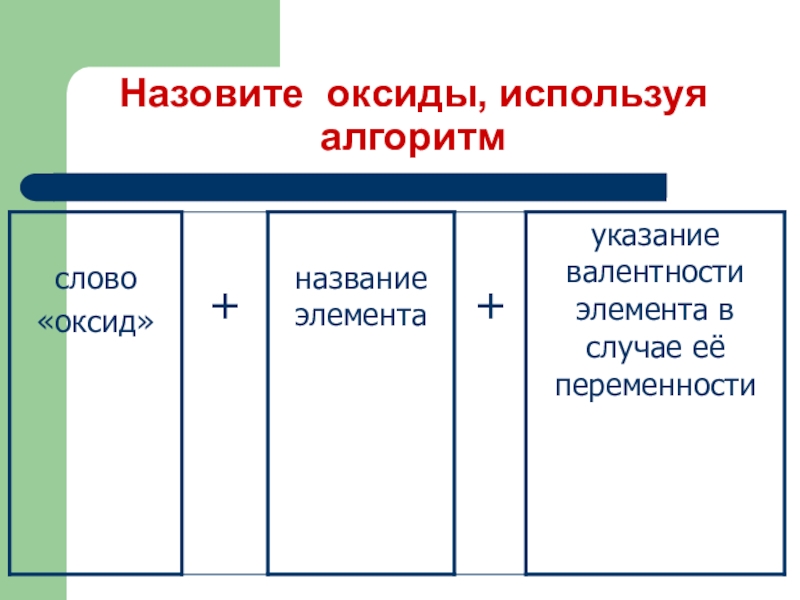
- 12. Назовите оксиды, используя алгоритм
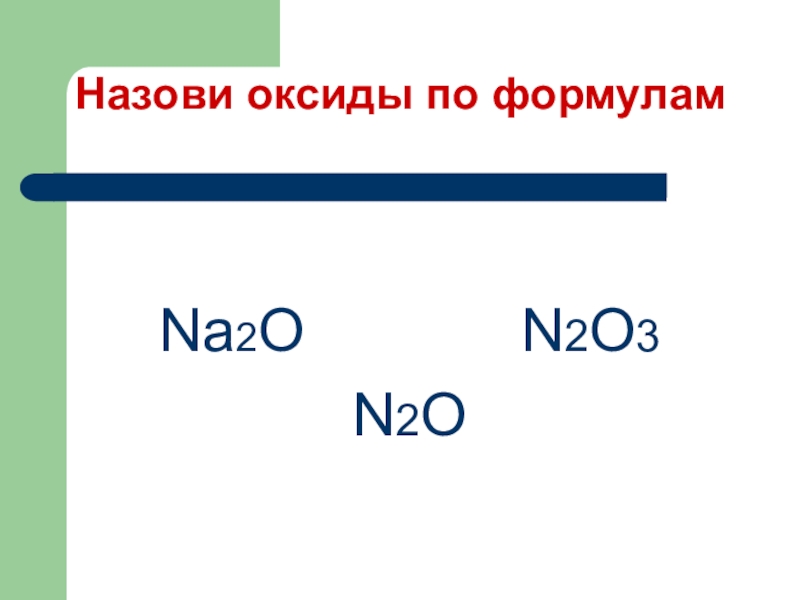
- 13. Назови оксиды по формуламNa2O N2O3N2O
- 14. Na2O – оксид натрияN2O – оксид азота (I)N2O3 – оксид азота (III)
- 15. Названия оксидовSO3 - оксид серы (VI)FeO –
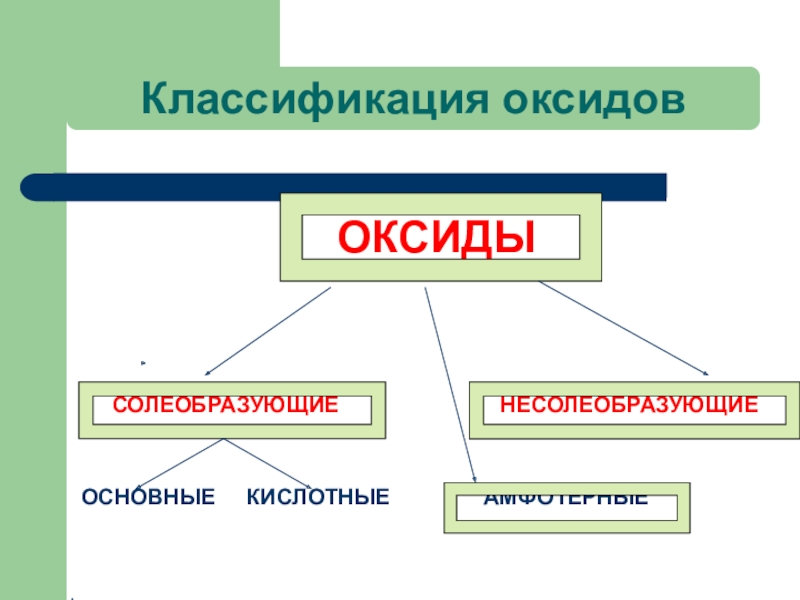
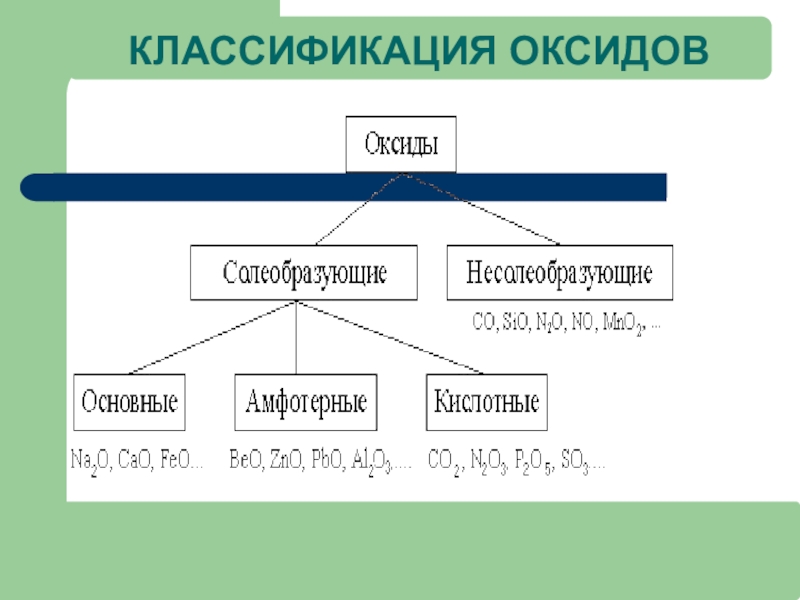
- 16. Классификация оксидов ОКСИДЫ
- 17. КЛАССИФИКАЦИЯ ОКСИДОВ Несолеобразующие: (оксиды неметаллов со степенью
- 18. КЛАССИФИКАЦИЯ ОКСИДОВ
- 19. Кислотные оксиды Например:
- 20. Основные оксиды Например: Na2O –оксид натрия
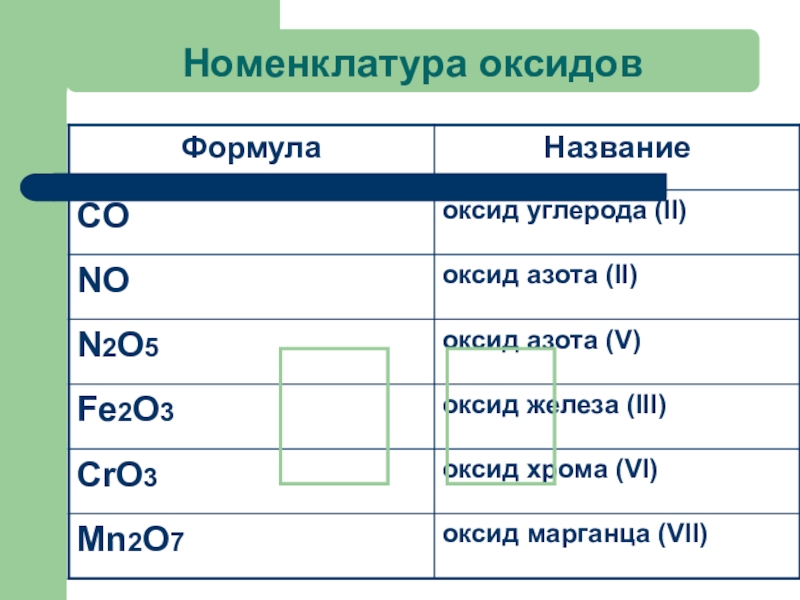
- 21. Номенклатура оксидов?
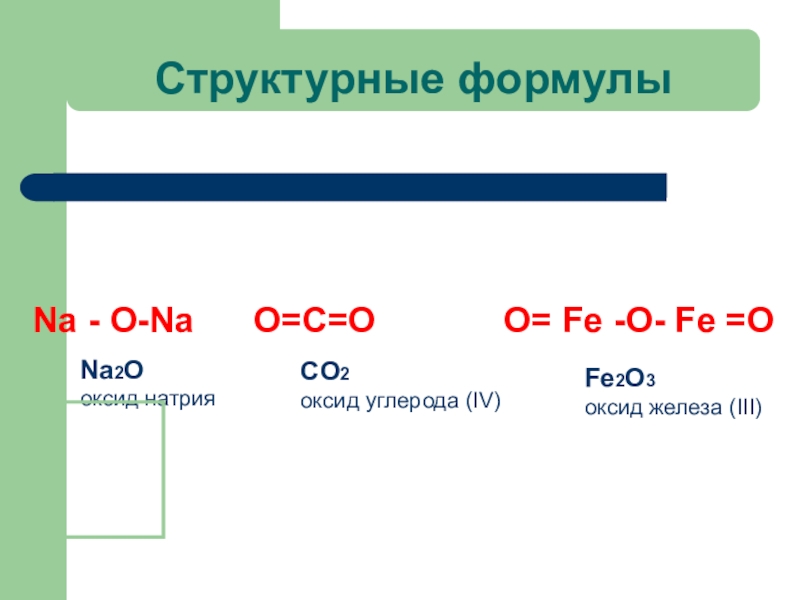
- 22. Структурные формулы Na - О-Na
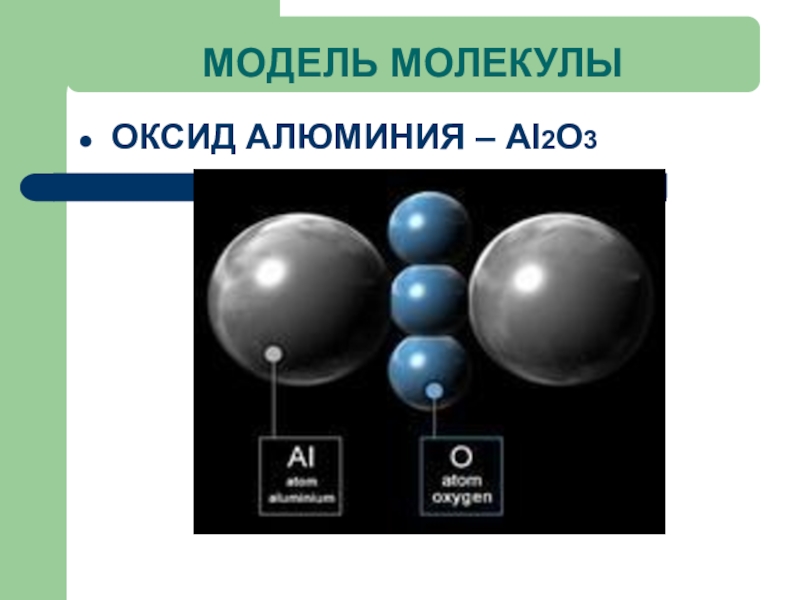
- 23. МОДЕЛЬ МОЛЕКУЛЫОКСИД АЛЮМИНИЯ – Al2O3
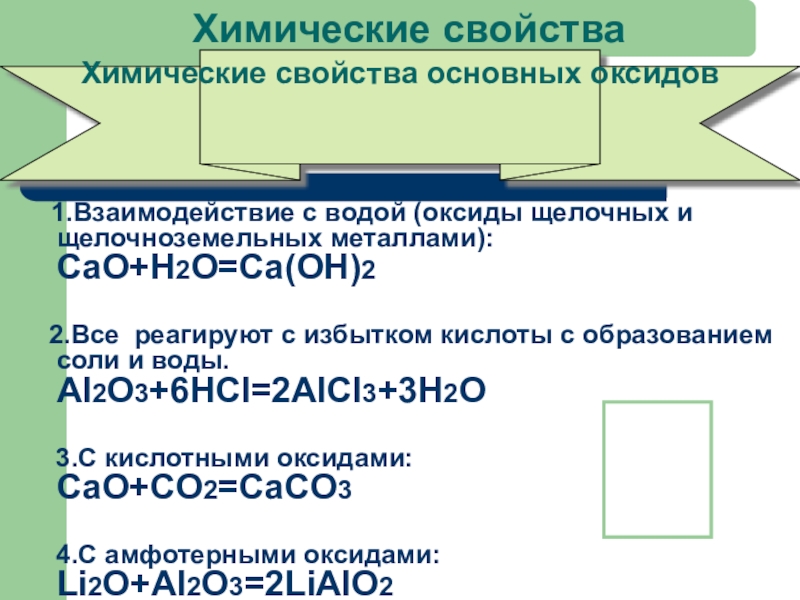
- 24. Химические свойства 1.Взаимодействие с водой
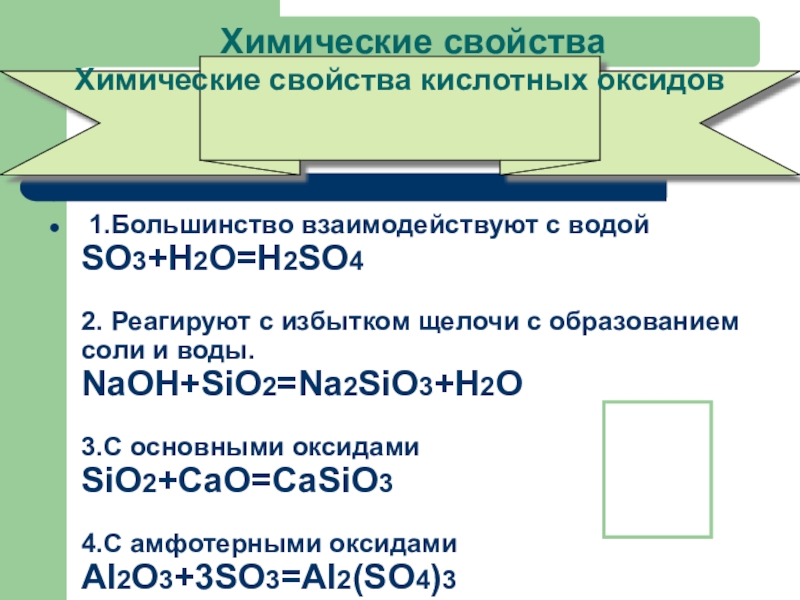
- 25. Химические свойства 1.Большинство взаимодействуют с водой SO3+H2O=H2SO4
- 26. Химические свойстваАмфотерные( ZnO, Al2O3,Cr2O3, MnO2,ВеО) 1.Взаимодействуют как
- 27. Реакции окисления -реакции взаимодействия веществ с ________, в результате которых образуются _________.
- 28. Реакции окисления -реакции взаимодействия веществ с кислородом, в результате которых образуются оксиды.
- 29. ПОЛУЧЕНИЕ ОКСИДОВ 1. Окисление кислородом: а)простых
- 30. ПОЛУЧЕНИЕ ОКСИДОВДаже железо способно гореть в атмосфере
- 31. Способы получения оксидовЛесные пожары – один из
- 32. Важнейшие представители и их применениеВажнейшие представителиСО2 –
- 33. Глазурованная посуда из белой глины. Китай, 2-1
- 34. стеклоДамасская ваза XIV векаПарфюмерный флакон работы Рене ЛаликаРусское стекло. Бокал. Вторая половина XVIII века
- 35. НефелинБоксит
- 36. ?
- 37. Слайд 37
- 38. ЗаданиеСреди перечисленных веществ найдите оксиды:
- 39. ЗаданиеКислотным и основным оксидом являются соответственно: 1)
- 40. ЗаданиеКакие из приведённых утверждений верны:
- 41. ЗаданиеТолько кислотные оксиды расположены в ряду:
- 42. ЗаданиеОксид серы (VI) взаимодействует с каждым из
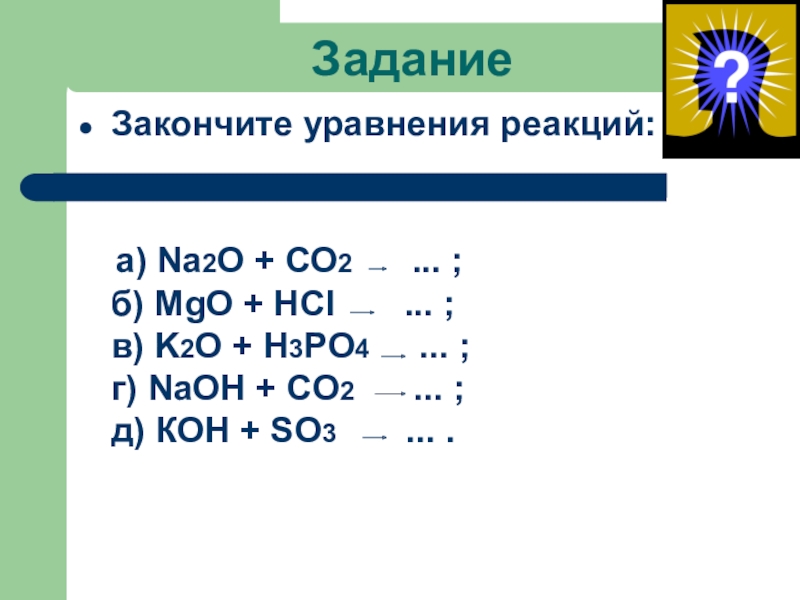
- 43. ЗаданиеЗакончите уравнения реакций: а) Na2O +
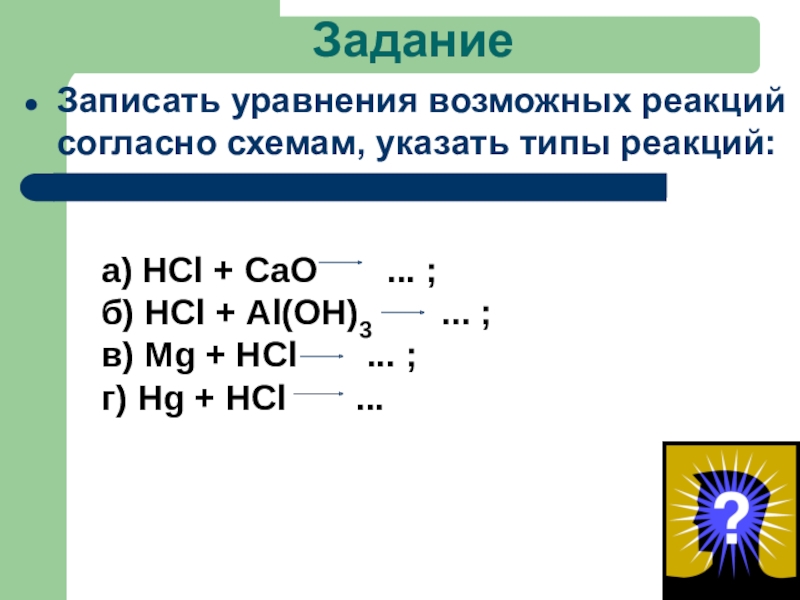
- 44. ЗаданиеЗаписать уравнения возможных реакций согласно схемам, указать
- 45. Домашнее задание § 40, №1
- 46. Оцените, насколько удалось нам достичь поставленной цели.Что
- 47. СПАСИБО ЗА УРОК!
- 48. Слайд 48
Слайд 2
План урока:
Повторение опорных знаний о классификации оксидов
Составление блок схемы и работа
Закрепление материала
Слайд 3План характеристики класса неорганических соединений
Определение класса, общая формула.
Классификация.
Номенклатура соединений.
Способы получения.
Химические свойства.
Применение.
Слайд 8Что такое оксиды?
Оксиды – бинарные соединения, состоящие из двух хим.элементов, один
Слайд 15Названия оксидов
SO3 - оксид серы (VI)
FeO – оксид железа (II)
H2O –
P2O5 – оксид фосфора (V)
CO2 - оксид углерода (IV)
P2O3 – оксид фосфора (III)
Слайд 17КЛАССИФИКАЦИЯ ОКСИДОВ
Несолеобразующие: (оксиды неметаллов со степенью окисления +1, +2) NO,
Солеобразующие: кислотные и основные
Амфотерные оксиды –это оксиды металлов в с.о. +3, +4 , а также оксиды цинка, бериллия, свинца, олова в с.о. + 2.
Например: Fe2O3 –оксид железа (III) (соответствует амфотерный гидроксид железа (III) Fe(OH)3
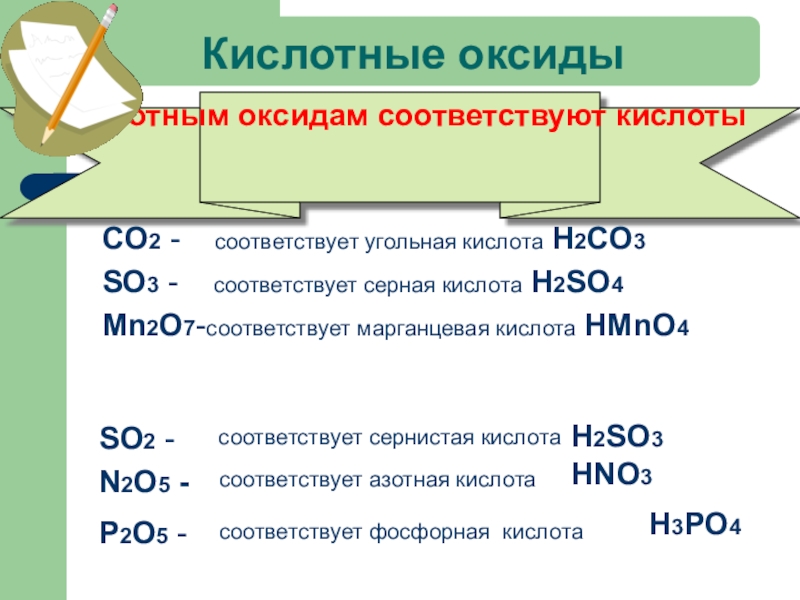
Слайд 19Кислотные оксиды
Например:
CO2 -
SO3 - соответствует серная кислота H2SO4
Mn2O7-соответствует марганцевая кислота HMnO4
SO2 -
H2SO3
соответствует сернистая кислота
N2O5 -
соответствует азотная кислота
HNO3
H3РO4
Р2O5 -
соответствует фосфорная кислота
Кислотным оксидам соответствуют кислоты
Слайд 20Основные оксиды
Например:
Na2O –оксид натрия
соответствует гидроксид натрия NaOН
CаO–оксид кальция
соответствует гидроксид кальция Cа(OН)2
Основные оксиды – это оксиды металлов со степенью окисления +1, +2 , им соответствуют основания
Слайд 22Структурные формулы
Na - О-Na O=C=О
Na2O
оксид натрия
CO2
оксид углерода (IV)
Fe2O3
оксид железа (III)
?
Слайд 24Химические свойства
1.Взаимодействие с водой (оксиды щелочных и щелочноземельных
2.Все реагируют с избытком кислоты с образованием соли и воды. AI2O3+6HCl=2AlCl3+3H2O
3.С кислотными оксидами: CaO+CO2=CaCO3
4.С амфотерными оксидами: Li2O+Al2O3=2LiAlO2
Химические свойства основных оксидов
?
Слайд 25Химические свойства
1.Большинство взаимодействуют с водой
SO3+H2O=H2SO4
2. Реагируют с избытком щелочи
Химические свойства кислотных оксидов
?
Слайд 26Химические свойства
Амфотерные( ZnO, Al2O3,Cr2O3, MnO2,ВеО)
1.Взаимодействуют как с кислотами, так и с
Химические свойства амфотерных оксидов
?
Слайд 27Реакции окисления -
реакции взаимодействия
веществ с ________,
в результате которых образуются
Слайд 28Реакции окисления -
реакции взаимодействия
веществ с кислородом,
в результате которых образуются
Слайд 29ПОЛУЧЕНИЕ ОКСИДОВ
1. Окисление кислородом:
а)простых веществ: 2MgO +O2=2MgO
2. Разложение:
а)нагреванием солей: СaCO3=CaO+CO2↑
б)нагреванием оснований: Cu(OH)2=CuO+H2О
в)нагреванием кислородсодержащих кислот: H2SO3=H2O+SO2↑
г)нагреванием высших оксидов:4CrO3=Cr2O3+3O2↑
3. Окисление низших оксидов:4FeO+O2=2Fe2O3
4. Вытеснение летучего оксида менее летучим Na2CO3+SiO2=Na2SiO3+CO2 ↑
Слайд 30ПОЛУЧЕНИЕ ОКСИДОВ
Даже железо способно гореть в атмосфере чистого кислорода.
Если сильно нагреть кончик железной проволоки и опустить ее в сосуд с кислородом, то железо загорится, разбрасывая в виде ярких искр частички раскаленной железной окалины:
Слайд 31Способы получения оксидов
Лесные пожары – один из источников углекислоты
C +
CO2 + H2O H2CO3
Слайд 32Важнейшие представители и их применение
Важнейшие представители
СО2 – оксид углерода (IV) или
Газ бесцветный, без запаха, тяжелее воздуха. Растворим в воде. Не поддерживает дыхания и горения. Содержится в воздухе (около 0,03%). Образуется в результате сгорания топлива и при дыхании. Используется при получении газированных напитков, при тушении пожаров, в твердом виде (сухой лед) используется в морозильных установках.
СаO – оксид кальция или негашеная известь.
Белый порошок. При его растворении в воде выделяется большое количество тепла и образует щелочь (гашеная известь). Применяется в строительстве
Слайд 33Глазурованная
посуда из белой
глины. Китай, 2-1
тыс. до н.э.
«Птица».
Музей
искусства. Каир.
Фарфор. Императорский
фарфоровый завод.
1830-е годы.
керамика
Слайд 34стекло
Дамасская ваза XIV века
Парфюмерный флакон работы Рене Лалика
Русское стекло. Бокал.
Вторая
Слайд 38Задание
Среди перечисленных веществ найдите оксиды:
NO2, HNO2,
Слайд 39Задание
Кислотным и основным оксидом являются соответственно:
1) SO2 и MgO;
2)
3) Na2O и FeO;
4) ZnO и SO3.
Слайд 40Задание
Какие из приведённых утверждений верны:
А. Основным оксидам соответствуют основания.
В.
Слайд 41Задание
Только кислотные оксиды расположены в ряду:
1) CO2, Mn2O7, SO3;
2)
Слайд 42Задание
Оксид серы (VI) взаимодействует с каждым из двух веществ :
1)
Слайд 43Задание
Закончите уравнения реакций:
а) Na2O + СО2 ...
Слайд 44Задание
Записать уравнения возможных реакций согласно схемам, указать типы реакций:
а) НСl
Слайд 46Оцените, насколько удалось нам достичь поставленной цели.
Что было самым сложным на
Что нового вы узнали?
Как вы считаете, где могут пригодиться вам новые знания?
2
1
3
4













![Презентация по химии на тему: Оксиды (8 класс) Химические свойстваАмфотерные( ZnO, Al2O3,Cr2O3, MnO2,ВеО) 1.Взаимодействуют как с кислотами, так и Химические свойстваАмфотерные( ZnO, Al2O3,Cr2O3, MnO2,ВеО) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl2+H2O ZnO+2NaOH+H2O=Na2[Zn(OH)4] 2.Реагируют с](/img/tmb/5/455576/0d76d1e9268a051f14eb46e0056ef839-800x.jpg)