№ 1352 г. Москвы
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Окислительно-восстановительные реакции (9 класс)
Содержание
- 1. Презентация по химии на тему Окислительно-восстановительные реакции (9 класс)
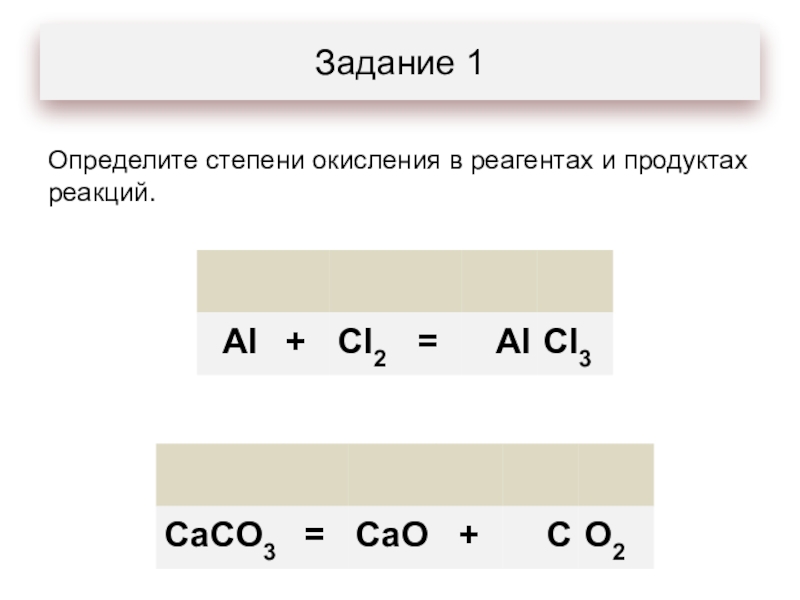
- 2. Задание 1Определите степени окисления в реагентах и продуктах реакций.
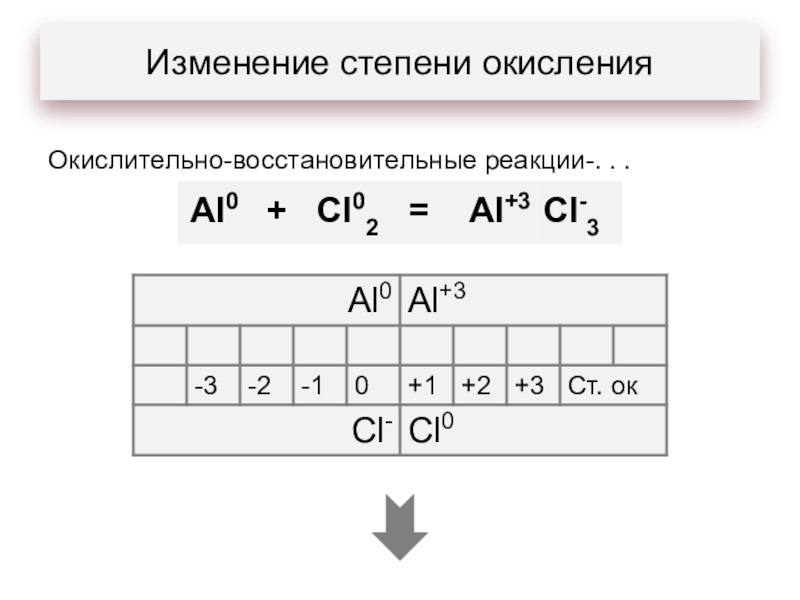
- 3. Изменение степени окисленияОкислительно-восстановительные реакции-. . .
- 4. Процессы Окислительно-восстановительные реакции-. . .
- 5. Окислитель
- 6. Окислитель
- 7. Окисление-восстановление
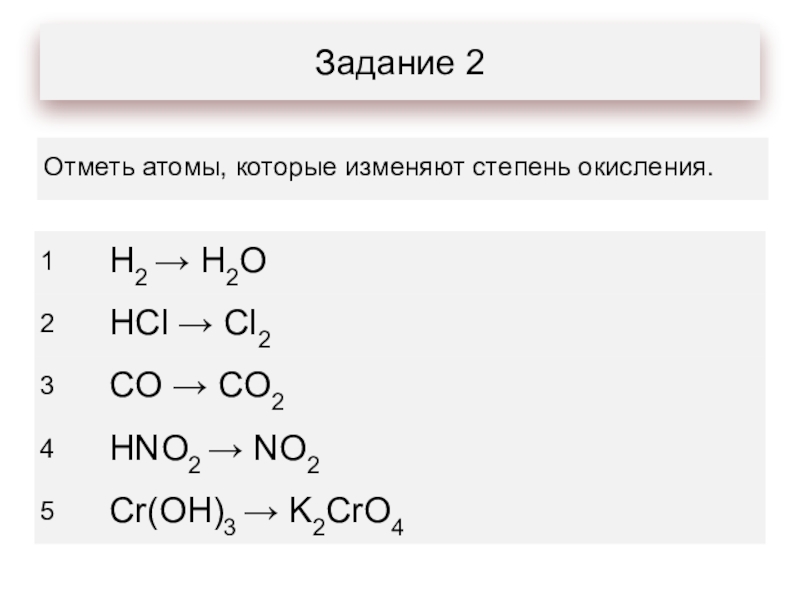
- 8. Задание 2
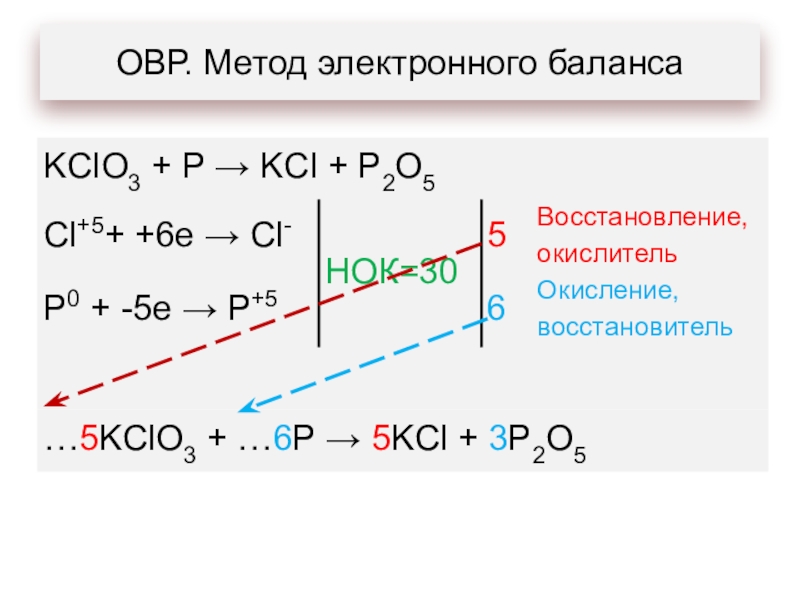
- 9. ОВР. Метод электронного баланса
- 10. ОВР. Метод электронного баланса
- 11. ОВР. Метод электронного баланса
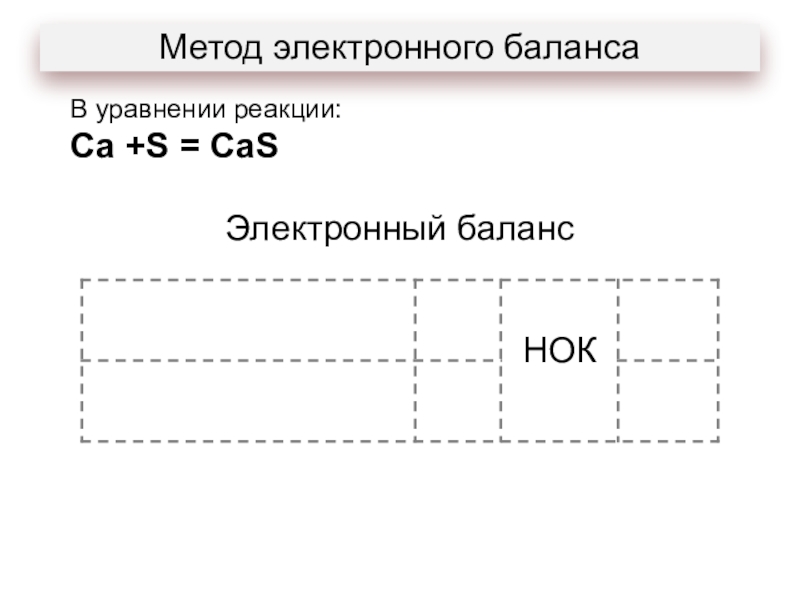
- 12. Метод электронного балансаВ уравнении реакции: Ca +S = CaS
- 13. Метод электронного балансаУравнению реакции: Ca +S =
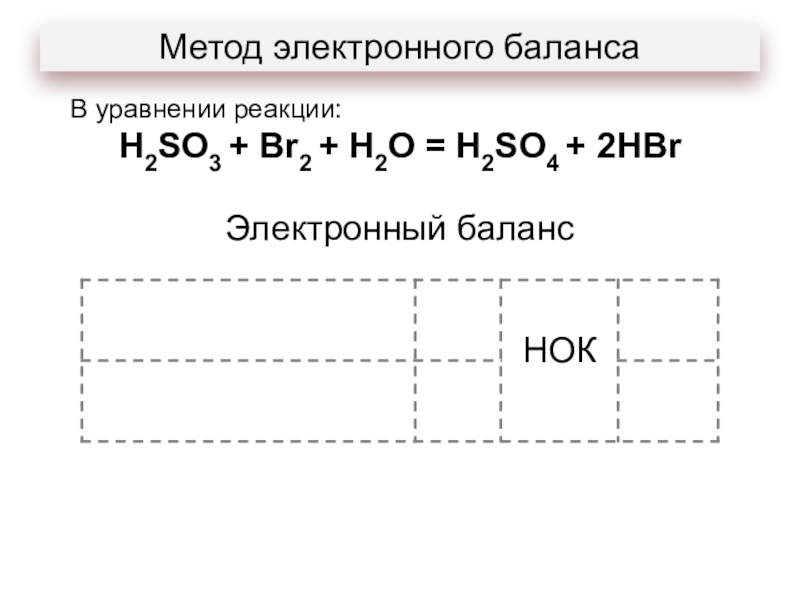
- 14. Метод электронного балансаВ уравнении реакции: H2SO3 + Br2 + H2O = H2SO4 + 2HBr
- 15. Метод электронного балансаВ уравнении реакции: H2SO3 +
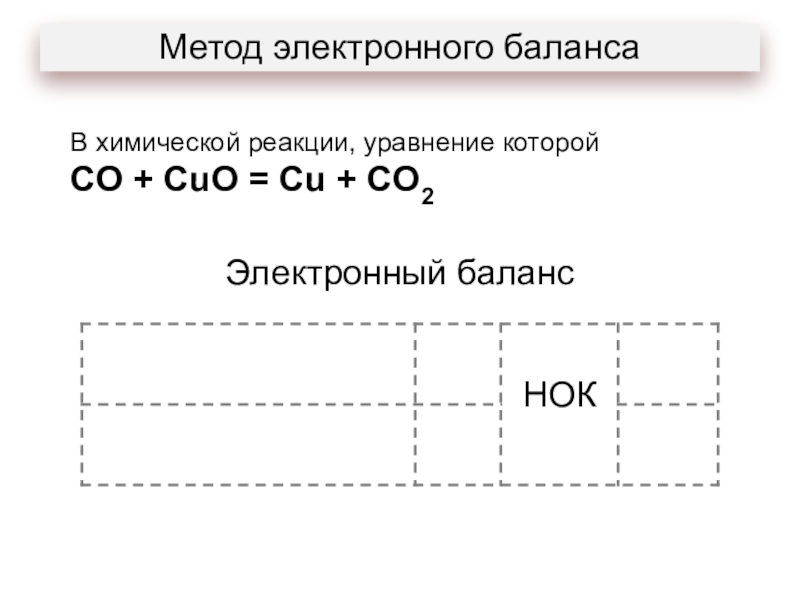
- 16. Метод электронного балансаВ химической реакции, уравнение которойCO + CuO = Cu + CO2
- 17. Метод электронного балансаВ химической реакции, уравнение которойCO
- 18. Важнейшие восстановителиМеталлы, Н2, уголь,СО – оксид углерода(II)H2S,
- 19. Важнейшие окислителиГалогеныKMnO4, K 2MnO4, MnO2, K2Cr2O7,K2CrO4HNO3-азотная кислотаH2O2
Задание 1Определите степени окисления в реагентах и продуктах реакций.
Слайд 1Окислительно-восстановительные реакции
Урок 23-24
Политова Светлана Викторовна,
учитель химии высшей квалификационной категории
ГБОУ Школа
Слайд 13Метод электронного баланса
Уравнению реакции:
Ca +S = CaS
соответствует схема превращения:
1) Ca+2
Ca0
2) S-2 S0
3) Ca0 Ca+2
4) S0 S+4
2) S-2 S0
3) Ca0 Ca+2
4) S0 S+4
Слайд 15Метод электронного баланса
В уравнении реакции:
H2SO3 + Br2 + H2O =
H2SO4 + 2HBr
сера:
является окислителем;
является восстановителем;
понижает степень окисления;
повышает степень окисления.
Слайд 17Метод электронного баланса
В химической реакции, уравнение которой
CO + CuO = Cu
+ CO2
восстановителем является:
1) Cu+2 в оксиде меди (II);
2) C+2 в оксиде углерода (II);
3) O-2 в оксиде углерода (II);
4) O-2 в оксиде меди (II).
Слайд 18Важнейшие восстановители
Металлы, Н2, уголь,
СО – оксид углерода(II)
H2S, SO2, H2SO3 и её
соли
HJ,HBr,HCl
SnCl2 ,FeSO4 ,MnSO4,
Cr2(SO4)3
HNO2-азотистая кислота
NH3 –аммиак
NO- оксид азота (II)
Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза
Катод при электролизе
HJ,HBr,HCl
SnCl2 ,FeSO4 ,MnSO4,
Cr2(SO4)3
HNO2-азотистая кислота
NH3 –аммиак
NO- оксид азота (II)
Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза
Катод при электролизе
Слайд 19Важнейшие окислители
Галогены
KMnO4, K 2MnO4, MnO2, K2Cr2O7,
K2CrO4
HNO3-азотная кислота
H2O2 – пероксид водорода
О3 –
озон, О2
H2SO4 – конц., H2SеO4
CuO, Ag2O, PbO2
Ионы благородных металлов (Ag+,
Au3+ )
FeCl3
Гипохлориты, хлораты и перхлораты
«Царская водка»
Анод при электролизе
H2SO4 – конц., H2SеO4
CuO, Ag2O, PbO2
Ионы благородных металлов (Ag+,
Au3+ )
FeCl3
Гипохлориты, хлораты и перхлораты
«Царская водка»
Анод при электролизе