- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Металлы и неметаллы
Содержание
- 1. Презентация по химии на тему Металлы и неметаллы
- 2. Металлы В ПС располагаются под диагональю бор-астат и в восьмой группе побочной подгруппе
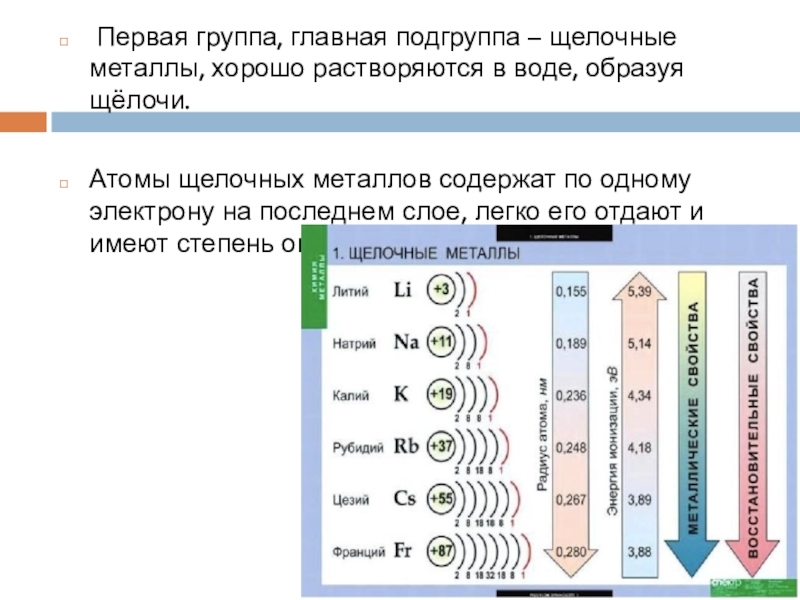
- 3. Первая группа, главная подгруппа – щелочные
- 4. Металлы второй группы главной подгруппы – щёлочно-земельные металлы, их оксиды при растворении в воде образуют щёлочи.
- 5. Атомы металлов имеют большие размеры, их внешние
- 6. Физические свойства металлов
- 7. электропроводность
- 8. теплопроводность
- 9. Пластичность (ковкость)
- 10. Слайд 10
- 11. Химические свойства металлов- взаимодействие с кислородом:4Li +
- 12. - взаимодействие с неметаллами:2Al + 3Cl2 = 2AlCl3Hg + S =HgS
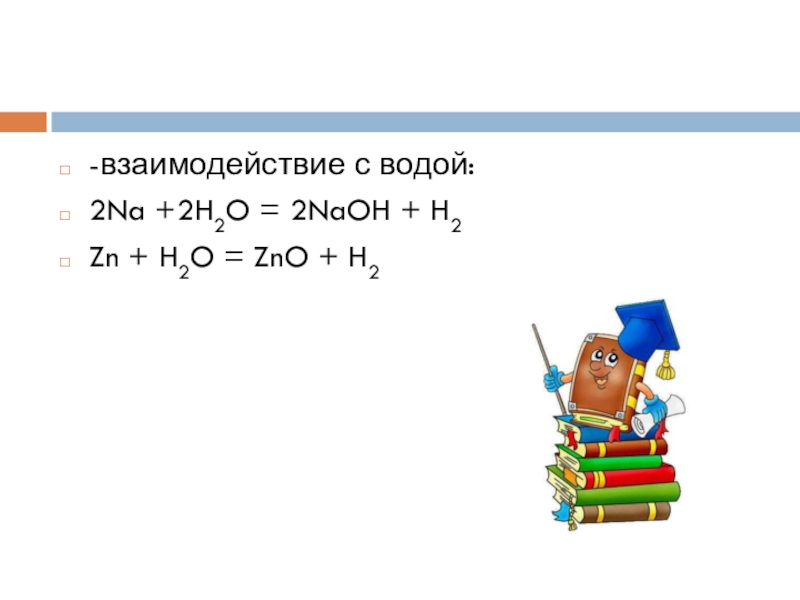
- 13. -взаимодействие с водой:2Na +2H2O = 2NaOH + H2Zn + H2O = ZnO + H2
- 14. - взаимодействие с кислотами (согласно ряду напряжения
- 15. - взаимодействие с солями:Fe + CuSO4 =
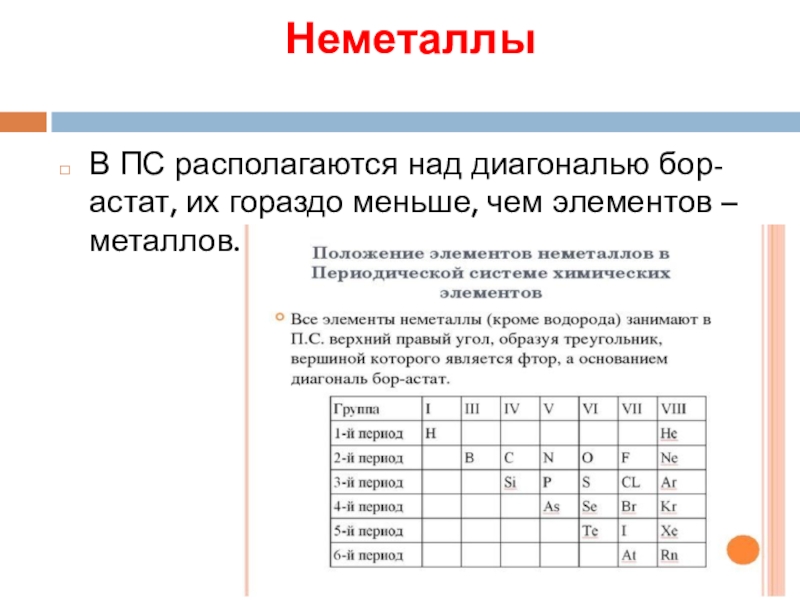
- 16. Неметаллы В ПС располагаются над диагональю бор-астат, их гораздо меньше, чем элементов – металлов.
- 17. Имеют маленький атомный радиус, число электронов на внешнем уровне от 4 до 8, проявляют окислительные свойства.
- 18. По физическим свойствам разнообразны:- агрегатное состояние: газы
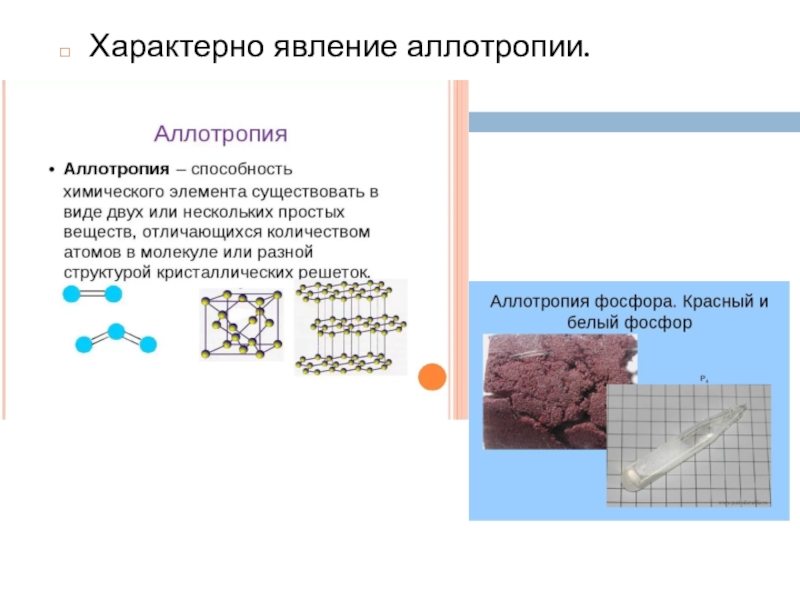
- 19. Характерно явление аллотропии.
- 20. Химические свойства неметаллов- взаимодействие с металлами:2Na +
- 21. ЗаданиеОсуществить превращение:Fe→FeCl2 →Fe(OH)2 →FeOS→SO2→Na2SO3
- 22. Список использованных источников1. Ерохин, Ю.М. Химия [Текст]:
Металлы В ПС располагаются под диагональю бор-астат и в восьмой группе побочной подгруппе
Слайд 3 Первая группа, главная подгруппа – щелочные металлы, хорошо растворяются в
воде, образуя щёлочи.
Атомы щелочных металлов содержат по одному электрону на последнем слое, легко его отдают и имеют степень окисления +1
Атомы щелочных металлов содержат по одному электрону на последнем слое, легко его отдают и имеют степень окисления +1
Слайд 4Металлы второй группы главной подгруппы – щёлочно-земельные металлы, их оксиды при
растворении в воде образуют щёлочи.
Слайд 5Атомы металлов имеют большие размеры, их внешние электроны слабо связаны с
ядром, на внешнем уровне в атомах – 1-3 электрона, следовательно, самое характерное свойство металлов – это их восстановительная способность.
Слайд 11Химические свойства металлов
- взаимодействие с кислородом:
4Li + O2 = 2Li2O (при
обычной температуре)
2Ca + O2 = 2CaO
2Zn + O2 = 2ZnO (при нагревании)
2Ca + O2 = 2CaO
2Zn + O2 = 2ZnO (при нагревании)
Слайд 14- взаимодействие с кислотами (согласно ряду напряжения металлов):
Zn + 2HCl =
ZnCl2 + H2 (должна образоваться растворимая соль, азотная и серная кислоты реагируют по особому)
Щелочные металлы не взаимодействуют с растворами кислот, так как, в первую очередь они взаимодействуют с водой.
Щелочные металлы не взаимодействуют с растворами кислот, так как, в первую очередь они взаимодействуют с водой.
Слайд 15- взаимодействие с солями:
Fe + CuSO4 = FeSO4 + Cu (должна
образоваться растворимая соль, металл должен быть более активным, чем металл, входящий в состав соли).
Слайд 16Неметаллы
В ПС располагаются над диагональю бор-астат, их гораздо меньше, чем элементов
– металлов.
Слайд 17Имеют маленький атомный радиус, число электронов на внешнем уровне от 4
до 8, проявляют окислительные свойства.
Слайд 18По физическим свойствам разнообразны:
- агрегатное состояние: газы (водород, кислород); тв. вещества
(сера, кремний); жидкость (бром)
- разные по окраске: жёлтый цвет (сера); чёрный (углерод); зелёный (хлор)
- разные температуры плавления: графит – 3800 градусов; азот - -210 градусов
- разные кристаллические решётки: молекулярная (водород, кислород); атомные (кремний, углерод).
- разные по окраске: жёлтый цвет (сера); чёрный (углерод); зелёный (хлор)
- разные температуры плавления: графит – 3800 градусов; азот - -210 градусов
- разные кристаллические решётки: молекулярная (водород, кислород); атомные (кремний, углерод).
Слайд 20Химические свойства неметаллов
- взаимодействие с металлами:
2Na + S = Na2S
- взаимодействие
с другими неметаллами:
Окислительные свойства: H2 + S = H2S
Восстановительные свойства: S + O2 = SO2
Окислительные свойства: H2 + S = H2S
Восстановительные свойства: S + O2 = SO2
Слайд 22Список использованных источников
1. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф.
учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с.
2. Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с.
3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с.
4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz
2. Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с.
3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с.
4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz
















![Презентация по химии на тему Металлы и неметаллы Список использованных источников1. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. Список использованных источников1. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под](/img/thumbs/3dd16cd61d5db0d011b9d2e9f97206cc-800x.jpg)





