- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Комплексные соединения
Содержание
- 1. Презентация по химии на тему: Комплексные соединения
- 2. ЦЕЛИ УРОКА:Цели урока:Формирование знаний о комплексных соединениях;Рассмотрение
- 3. Содержание урока1. Понятие :Комплексные соединения2. Строение комплексных соединений3. Номенклатура комплексных соединений4. Химические свойства5. Применение6. Закрепление
- 4. Комплексные называют соединения, содержащие сложные ионы и
- 5. Швейцарский химик Альфред Вернер, лауреат Нобелевской премии.Его
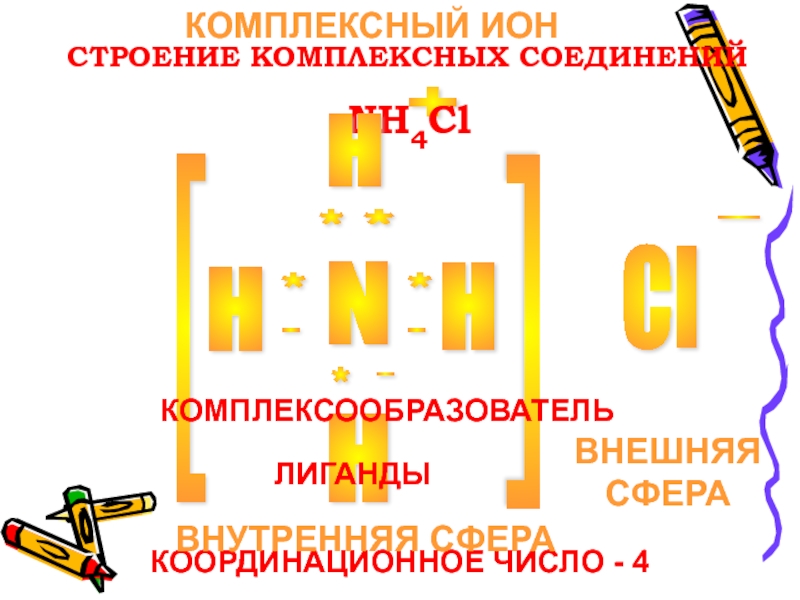
- 6. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙN H H H Cl
- 7. [N-3H+14]Cl-1КОМПЛЕКСНЫЙ ИОН[NH4]+ВНУТРЕННЯЯ СФЕРА:КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3ЛИГАНДЫH+ВНЕШНЯЯ СФЕРААНИОНCl-
- 8. Лигандами могут быть: а) полярные молекулы:
- 9. (OH)-4[Zn+xNa+(+1)+ x+ (-1)]2·2·4 = 0x = 0-2+4x = +2Na+[Zn+2(OH)-4]
- 10. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]Ответ: Na+3[Al+3F-6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Ответ: Na+[Al+3(OH)-4]Ответ: K+[Mg+2Cl-3]Ответ:Na+4[Fe+2(CN)-6]
- 11. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ2-4-3-5-6-ди-три-тетра-пента-гекса-ЧИСЛИТЕЛЬНЫЕ:НАЗВАНИЯ ЛИГАНДОВ:H2O - акваNH3 -
- 12. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙНАЗВАНИЯ КАТИОНОВ:Fe - ферратCu -
- 13. тетрагидроксоцинкатНОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙNa+24](OH)-[Zn+2натрия[Cr+3(H2O)06]Cl-3хлоридаквагексаxрома (III)K+2[Hg+2I-4]тетрайодомеркурат (II)калия
- 14. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]Гексафтороалюминат натрияТетрагидроксоалюминат натрияГексационоферрат (II) калия
- 15. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)[Ag(NH3)2]ClХлорид диамминсеребраХлорид гексааквахрома (III)[Cr(H2O)6]Cl3
- 16. Ответ: K2[PtCl6]Гексахлороплатинат (IV) калияГексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВОтвет: Na3[Cr(OH)6]
- 17. ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация комплексных соединений.
- 18. Химические свойства2. Комплексные соединения взаимодействуют с оксидом
- 19. Химические свойства3. Комплексные соединения взаимодействуют с кислотами:[Cu(NH3)4]SO4
- 20. Химические свойства4. Комплексные соединения взаимодействуют с солями
- 21. Химические свойства5 .Комплексные соединения вступают в окислительно-восстановительные
- 22. Практическое применение комплексных соединений1) в аналитической химии
- 23. Закрепление Задание 2Заполните пропуски в листе
- 24. Домашнее задание Напишите формулы следующих соединений:1) сульфат
Слайд 2ЦЕЛИ УРОКА:
Цели урока:
Формирование знаний о комплексных соединениях;
Рассмотрение химических свойства комплексных соединений;
Углубление
Проверить степень усвоения знаний учащихся о комплексных соединениях;
Ознакомить учащихся с применением комплексных соединений;
Продолжить формирование мировоззренческих понятий: о познаваемости природы, причинно – следственной зависимости между составом и свойствами соединений.
Слайд 3Содержание урока
1. Понятие :
Комплексные соединения
2. Строение комплексных соединений
3. Номенклатура комплексных соединений
4.
5. Применение
6. Закрепление
Слайд 4Комплексные называют соединения, содержащие сложные ионы и молекулы, способные к существованию,
Слайд 5
Швейцарский химик Альфред Вернер, лауреат Нобелевской премии.
Его научная деятельность проходила в
Ученый синтезировал много новых комплексных соединений,
систематизировал ранее известные и вновь полученные
комплексные соединения и разработал экспериментальные методы
доказательства его строения
Слайд 6СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
N
H
H
H
Cl
+
-
[
[
*
*
*
*
*
.
.
.
NH4Cl
H
КОМПЛЕКСООБРАЗОВАТЕЛЬ
ЛИГАНДЫ
КООРДИНАЦИОННОЕ ЧИСЛО - 4
ВНУТРЕННЯЯ СФЕРА
ВНЕШНЯЯ СФЕРА
КОМПЛЕКСНЫЙ ИОН
Слайд 7[N-3H+14]Cl-1
КОМПЛЕКСНЫЙ ИОН
[NH4]+
ВНУТРЕННЯЯ СФЕРА:
КОМПЛЕКСООБРАЗОВАТЕЛЬ
N-3
ЛИГАНДЫ
H+
ВНЕШНЯЯ СФЕРА
АНИОН
Cl-
Слайд 8Лигандами могут быть: а) полярные молекулы: NH3 H2O CO NO б) простые ионы
Слайд 10РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:
Na3[AlF6]
Ответ: Na+3[Al+3F-6]
K[MgCl3]
Na[Al(OH)4]
Na4[Fe(CN)6]
Ответ: Na+[Al+3(OH)-4]
Ответ: K+[Mg+2Cl-3]
Ответ:Na+4[Fe+2(CN)-6]
Слайд 11НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
2-
4-
3-
5-
6-
ди-
три-
тетра-
пента-
гекса-
ЧИСЛИТЕЛЬНЫЕ:
НАЗВАНИЯ ЛИГАНДОВ:
H2O - аква
NH3 - амин
СO - карбонил
OН- -
(СN)- - циано
F-, Cl-, Br-, I- - фторо-, хлоро-, бромо-, йодо-
(NO3)- - нитро
Слайд 12НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
НАЗВАНИЯ КАТИОНОВ:
Fe - феррат
Cu - купрат
Ag - аргентат
Au -
Hg - меркурат
Al - алюминат
Zn - цинкат
Слайд 13тетра
гидроксо
цинкат
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Na+2
4]
(OH)-
[Zn+2
натрия
[Cr+3
(H2O)0
6]
Cl-3
хлорид
аква
гекса
xрома (III)
K+2
[Hg+2
I-
4]
тетра
йодо
меркурат (II)
калия
Слайд 14НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Na3[AlF6]
Na[Al(OH)4]
K4[Fe(CN)6]
Гексафтороалюминат натрия
Тетрагидроксоалюминат натрия
Гексационоферрат (II) калия
Слайд 15НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
[Cu(NH3)4]SO4
Сульфат тетраамминмеди (II)
[Ag(NH3)2]Cl
Хлорид диамминсеребра
Хлорид гексааквахрома (III)
[Cr(H2O)6]Cl3
Слайд 16Ответ: K2[PtCl6]
Гексахлороплатинат (IV) калия
Гексагидроксохромат (III) натрия
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ
Ответ: Na3[Cr(OH)6]
Слайд 17ХИМИЧЕСКИЕ СВОЙСТВА
1. Диссоциация комплексных соединений.
[Cu(NH3)4](OH)2. = [Cu(NH3)4]2++2ОН-.
[Cu(NH3)4]2+ ↔ Cu2++ 4NH3
Слайд 18Химические свойства
2. Комплексные соединения взаимодействуют с оксидом углерода (IV):
Na[AL(OH) 4] +
Слайд 19Химические свойства
3. Комплексные соединения взаимодействуют с кислотами:
[Cu(NH3)4]SO4 + BaCl2 = BaSO4
FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 3KCl
Na[AL(OH) 4] + HCL = NaCL + AL(OH) 3 + H2O
Na[AL(OH) 4] + 4HCL = NaCL + 4H2O + ALCL3
Слайд 20Химические свойства
4. Комплексные соединения взаимодействуют с солями – реакции обмена:
Na[AL(OH) 4]
[Ag(NH3)2]CL + KJ = AgJ↓+ NH3 + KCL
Слайд 21Химические свойства
5 .Комплексные соединения вступают в окислительно-восстановительные реакции:
K3[Fe3+(CN)6]3 + H2O2 +
2K4[Fe2+(CN)6]4 + O2 + 2H2O
Слайд 22Практическое применение комплексных соединений
1) в аналитической химии для определения многих ионов
2)
3) для получения металлов высокой степени чистоты (золота, серебра, никеля и др.)
4) в качестве красителей
5) для устранения жесткости
Слайд 23Закрепление
Задание 2
Заполните пропуски в листе рассказа «Комплексные соединения».
Строение
Согласно названной теории в комплексном соединении различают две сферы – …
В комплексных соединениях центральный ион или атом металла, называется …, он удерживает вокруг себя некоторое число ионов или молекул, называемых … (от лат. ligo – «связываю»).
Совокупность … и … называется … сферой комплекса (комплексным ионом).
Комплексообразователь связан с лигандами … связями, образованными по … механизму.
Слайд 24Домашнее задание
Напишите формулы следующих соединений:
1) сульфат гексаамминхрома (II);
2) нитрат гидроксодиамминакваплатины
3) гексацианоферрат (II) калия;
4) тетрагидроксокупрат (II) натрия;
5) трихлоротриамминкобальт (III).
Определите: а) заряд внутренней сферы, б) степень окисления комплексообразователя; в) координационное число комплексообразователя;





![Презентация по химии на тему: Комплексные соединения [N-3H+14]Cl-1КОМПЛЕКСНЫЙ ИОН[NH4]+ВНУТРЕННЯЯ СФЕРА:КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3ЛИГАНДЫH+ВНЕШНЯЯ СФЕРААНИОНCl- [N-3H+14]Cl-1КОМПЛЕКСНЫЙ ИОН[NH4]+ВНУТРЕННЯЯ СФЕРА:КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3ЛИГАНДЫH+ВНЕШНЯЯ СФЕРААНИОНCl-](/img/thumbs/bc26ea9feff4fbbe728c88aef77b6104-800x.jpg)

![Презентация по химии на тему: Комплексные соединения (OH)-4[Zn+xNa+(+1)+ x+ (-1)]2·2·4 = 0x = 0-2+4x = +2Na+[Zn+2(OH)-4] (OH)-4[Zn+xNa+(+1)+ x+ (-1)]2·2·4 = 0x = 0-2+4x = +2Na+[Zn+2(OH)-4]](/img/thumbs/875b2679b3cfb598f48c428003005833-800x.jpg)
![Презентация по химии на тему: Комплексные соединения РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]Ответ: Na+3[Al+3F-6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Ответ: Na+[Al+3(OH)-4]Ответ: K+[Mg+2Cl-3]Ответ:Na+4[Fe+2(CN)-6] РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]Ответ: Na+3[Al+3F-6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Ответ: Na+[Al+3(OH)-4]Ответ: K+[Mg+2Cl-3]Ответ:Na+4[Fe+2(CN)-6]](/img/thumbs/b4994de6c26a3e2c3533be7b5a5b0dfb-800x.jpg)


-[Zn+2натрия[Cr+3(H2O)06]Cl-3хлоридаквагексаxрома (III)K+2[Hg+2I-4]тетрайодомеркурат (II)калия тетрагидроксоцинкатНОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙNa+24](OH)-[Zn+2натрия[Cr+3(H2O)06]Cl-3хлоридаквагексаxрома (III)K+2[Hg+2I-4]тетрайодомеркурат (II)калия](/img/thumbs/450d71deb6fc429844a119dacc509046-800x.jpg)
![Презентация по химии на тему: Комплексные соединения НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]Гексафтороалюминат натрияТетрагидроксоалюминат натрияГексационоферрат (II) калия НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]Гексафтороалюминат натрияТетрагидроксоалюминат натрияГексационоферрат (II) калия](/img/thumbs/843c4d9561a1f994e4fbb5a02957c5a4-800x.jpg)
![Презентация по химии на тему: Комплексные соединения НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)[Ag(NH3)2]ClХлорид диамминсеребраХлорид гексааквахрома (III)[Cr(H2O)6]Cl3 НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)[Ag(NH3)2]ClХлорид диамминсеребраХлорид гексааквахрома (III)[Cr(H2O)6]Cl3](/img/thumbs/8116140b9fad0dc5c40a809f844b30df-800x.jpg)
![Презентация по химии на тему: Комплексные соединения Ответ: K2[PtCl6]Гексахлороплатинат (IV) калияГексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВОтвет: Na3[Cr(OH)6] Ответ: K2[PtCl6]Гексахлороплатинат (IV) калияГексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВОтвет: Na3[Cr(OH)6]](/img/thumbs/80519e6de90069c8652e28e7d8640b85-800x.jpg)
2. = [Cu(NH3)4]2++2ОН-.[Cu(NH3)4]2+ ↔ Cu2++ 4NH3 ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация комплексных соединений. [Cu(NH3)4](OH)2. = [Cu(NH3)4]2++2ОН-.[Cu(NH3)4]2+ ↔ Cu2++ 4NH3](/img/thumbs/335f495a171b601c32a53e48d06aa7ff-800x.jpg)
![Презентация по химии на тему: Комплексные соединения Химические свойства2. Комплексные соединения взаимодействуют с оксидом углерода (IV):Na[AL(OH) 4] + Химические свойства2. Комплексные соединения взаимодействуют с оксидом углерода (IV):Na[AL(OH) 4] + CO2 = AL(OH) 3 + NaHCO3](/img/thumbs/34ba61b8abe14d87cbd71ebae5bce9ca-800x.jpg)
![Презентация по химии на тему: Комплексные соединения Химические свойства3. Комплексные соединения взаимодействуют с кислотами:[Cu(NH3)4]SO4 + BaCl2 = BaSO4 Химические свойства3. Комплексные соединения взаимодействуют с кислотами:[Cu(NH3)4]SO4 + BaCl2 = BaSO4 + [Cu(NH3)4]Cl2 FeCl3 + K4[Fe(CN)6]](/img/thumbs/609a7f9b41a693ee32b04de4158e063b-800x.jpg)
![Презентация по химии на тему: Комплексные соединения Химические свойства4. Комплексные соединения взаимодействуют с солями – реакции обмена:Na[AL(OH) 4] Химические свойства4. Комплексные соединения взаимодействуют с солями – реакции обмена:Na[AL(OH) 4] + ALCL3 = 4AL(OH) 3 +](/img/thumbs/b6984b8f473e25a9b191ca9782c2e6c8-800x.jpg)
![Презентация по химии на тему: Комплексные соединения Химические свойства5 .Комплексные соединения вступают в окислительно-восстановительные реакции:K3[Fe3+(CN)6]3 + H2O2 + Химические свойства5 .Комплексные соединения вступают в окислительно-восстановительные реакции:K3[Fe3+(CN)6]3 + H2O2 + 2KOH = 2K4[Fe2+(CN)6]4 + O2 +](/img/thumbs/1db4016ae240b466dfb6ebc68075c5cc-800x.jpg)








