- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Ионные уравнения 8 класс
Содержание
- 1. Презентация по химии на тему Ионные уравнения 8 класс
- 2. Задание 2 Распределить и дать названия ионам
- 3. Фронтальный опросКакие вещества называются электролитами? Какие вещества
- 4. Слайд 4
- 5. Демонстрационный эксперимент1. Сливаем попарно растворы:А) сульфата железа
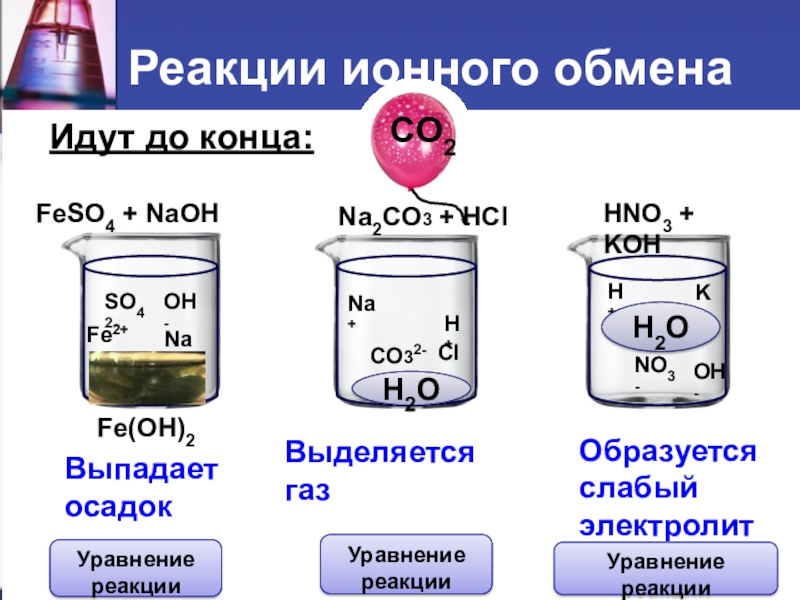
- 6. Идут до конца:FeSO4 + NaOH
- 7. Алгоритм составления уравненийМолекулярное уравнение FeSO4+2NaOH = Fe(OH)2
- 8. ПравилаПростые вещества, вода, оксиды, а также нерастворимые
- 9. H2O CO2Молекулярное уравнениеNa2CO3 + 2HNO3=2NaNO3 + H2CO3
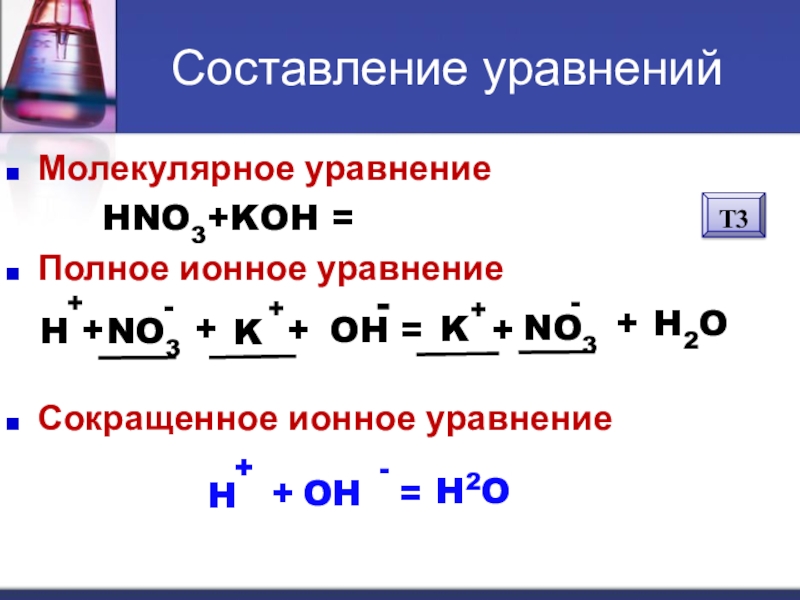
- 10. Составление уравненийМолекулярное уравнение HNO3+KOH = KNO3 + H2OПолное ионное уравнениеСокращенное ионное уравнениеH++NO3-+K++OH-=H2O+K++NO3-H ++OH-=H2OТ3
- 11. Обратимые реакцииNa2SO4 + KNO3Na+SO42-K+NO3-1.Нет осадка2.Не выделяется газ3.Не образуется слабый электролит
- 12. Составление уравненийМолекулярное уравнение Na2SO4+2KNO3 2NaNO3 +
- 13. Слайд 13
- 14. Правила техники безопасности1. Приступать к эксперименту можно
- 15. Лабораторная работаГруппа 1: Взаимодействие растворов хлорид натрия
- 16. 1) NaOH + HCl
- 17. Внимание! Правильный ответNaOH + HCl
- 18. Внимание! Правильный ответ (продолжение) 4) ZnSO4 +
- 19. Домашнее задание О.С. Габриелян, п. 38, упр. 1,2Спасибо за внимание!!!
Слайд 1Задание 1
Выбрать из данного перечня веществ электролиты и неэлектролиты:
KCl, CuO,
Для электролитов написать уравнения диссоциации
Слайд 2Задание 2
Распределить и дать названия ионам К+, CO32– ,
Составить молекулярные формулы веществ-электролитов, состоящих из ионов, записанных в таблице.
Слайд 3Фронтальный опрос
Какие вещества называются электролитами? Какие вещества к ним относятся?
Что такое
Что такое ионы?
Какие ионы образуются при диссоциации, оснований?
Какие ионы образуются при диссоциации кислот?
Какие ионы образуются при диссоциации солей?
Какие реакции называют реакциями обмена?
Слайд 5Демонстрационный эксперимент
1. Сливаем попарно растворы:
А) сульфата железа (II) и гидроксида натрия
Б)
В) гидроксида калия (добавьте несколько капель фенолфталеина) и азотной кислоты
Г) карбоната калия и хлорида натрия
Слайд 6 Идут до конца:
FeSO4 + NaOH
Na2CO3 + HCl
HNO3 +
Fe2+
SO42-
Na+
OH-
Na+
CO32-
H+
Cl-
H+
NO3-
K+
OH-
Fe(OH)2
CO2
H2O
Выпадает
осадок
Выделяется газ
Образуется
слабый
электролит
Реакции ионного обмена
Уравнение
реакции
Уравнение
реакции
Уравнение реакции
H2O
Слайд 7Алгоритм составления уравнений
Молекулярное уравнение
FeSO4+2NaOH = Fe(OH)2 + Na2SO4
Полное ионное уравнение
Сокращенное
Fe
2+
+
SO4
2-
+
2
Na
+
+
2
OH
-
=
Fe(OH)2
+
2
Na
+
+
SO4
2-
Fe
2+
+
2OH
-
=
Fe(OH)2
1.Записать уравнение реакции в
молекулярном виде
2.По таблице растворимости определить
растворимость каждого вещества
3.Составить полное ионное уравнение (записать
диссоциацию растворимых исходных веществ
и продуктов реакции)
4.Найти одинаковые ионы в левой и
правой частях, сократить их и записать
сокращенное ионное уравнение
Слайд 8Правила
Простые вещества, вода, оксиды, а также нерастворимые кислоты, основания и соли
Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части.
Слайд 9H2O
CO2
Молекулярное уравнение
Na2CO3 + 2HNO3=2NaNO3 + H2CO3
Полное ионное уравнение
Сокращенное
Составление уравнений
Na
+
+
CO3
2-
+
2H
+
+
2
NO3
-
=
H2O
+
2
Na
+
+
-
=
2
Т2
2
NO3
CO2
+
CO2
+
H2O
CO3
+
2-
2H
+
Слайд 10Составление уравнений
Молекулярное уравнение
HNO3+KOH = KNO3 + H2O
Полное
Сокращенное ионное уравнение
H
+
+
NO3
-
+
K
+
+
OH
-
=
H2O
+
K
+
+
NO3
-
H
+
+
OH
-
=
H2O
Т3
Слайд 11Обратимые реакции
Na2SO4 + KNO3
Na+
SO42-
K+
NO3-
1.Нет осадка
2.Не выделяется газ
3.Не образуется
слабый электролит
Слайд 12Составление уравнений
Молекулярное уравнение
Na2SO4+2KNO3 2NaNO3 + K2SO4
Полное ионное уравнение
2Na
+
+
SO4
2-
+
2
K
+
+
2
NO3
-
+
2
K
+
+
SO4
2-
2
NO3
-
Na
+
+
2
Обратимые реакции – реакции, идущие
во взаимно
противоположных направлениях
Т4
Слайд 14Правила техники безопасности
1. Приступать к эксперименту можно только с разрешения учителя.
2.Категорически
3.Нюхать их можно лишь направляя легким движением руки испарения к носу, при этом нельзя вдыхать полной грудью.
Слайд 15Лабораторная работа
Группа 1: Взаимодействие растворов хлорид натрия и нитрат серебра (I)
Группа 2: Взаимодействие растворов карбоната натрия и соляной кислоты.
Группа 3: Взаимодействие растворов азотной кислоты и гидроксида калия.
Группа 4: Взаимодействие растворов хлорида магния и сульфата натрия.
.
Слайд 161) NaOH + HCl NaCl +
2) MgCl2 + Na2SO3 MgSO3 + 2NaCl
3) K2SO3 + HNO3 KNO3 + H2O + SO2
4) ZnSO4 + 2NaOH Zn(OH)2 + Na2SO4
5) Al(OH)3 + 3HNO3 Al(NO3)3 + 3H2O
6) CaCO3 + 2 HCl CaCl2 + H2O + CO2
Михаил и Алексей делали домашнее задание. Они составили уравнения реакций, но случайно на лист бумаги пролили чернила. Помогите ученикам восстановить запись. Составьте к восстановленным уравнениям полные и сокращенные ионные уравнения
Слайд 17Внимание! Правильный ответ
NaOH + HCl NaCl
Na+1 + OH-1 + H+1 + Cl-1 Na+1 + Cl-1 + H2O
OH-1 + H+1 H2O
2) MgCl2 + Na2SO3 MgSO3 + 2NaCl
Mg+2 + 2Cl-1 + 2Na+1 + SO3-2 MgSO3 + 2Na+1 +2Cl-1
Mg+2 + SO3-2 MgSO3
3) K2SO3 + 2HNO3 2KNO3 + H2O + SO2
2K+1 + SO3-2 + 2H+1 + 2NO3-1 2K+1 + 2NO3-1 + H2O + SO2
SO3-2 + 2H+1 H2O + SO2
Слайд 18Внимание!
Правильный ответ (продолжение)
4) ZnSO4 + 2NaOH
Zn+2 + SO4-2 + 2Na+1 + 2OH-1 2Na+1 + SO4-2 + Zn(OH)2
Zn+2 + 2OH-1 Zn(OH)2
5) Al(OH)3 + 3HNO3 Al(NO3)3 + 3H2O
Al(OH)3 + 3H+1 + 3NO3-1 Al+3 + 3NO3-1 + 3H2O
Al(OH)3 + 3H+1 Al+3 + 3H2O
6) CaCO3 + 2 HCl CaCl2 + H2O + CO2
CaCO3 + 2H+1 + 2Cl-1 Ca+2 + 2Cl-1 + H2O + CO2
CaCO3 + 2H+1 Ca+2 + H2O + CO2