- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Ионная связь
Содержание
- 1. Презентация по химии на тему Ионная связь
- 2. Тема урока: Химическая связьОт берега до берегаМожно сделать мост. Соединить два атома В молекулу – вопрос…
- 3. Цели урока:Развивающие: развивать учебно-информационные навыки: умение
- 4. Цели урока:ОбразовательныеПознакомить обучающихся с типами химической связи.Изучить
- 5. Цели урока:ВоспитательныеСовершенствовать коммуникативные умения в ходе коллективного обсуждения.Развивать умение формулировать и аргументировать собственное мнение.Развивать самостоятельность.
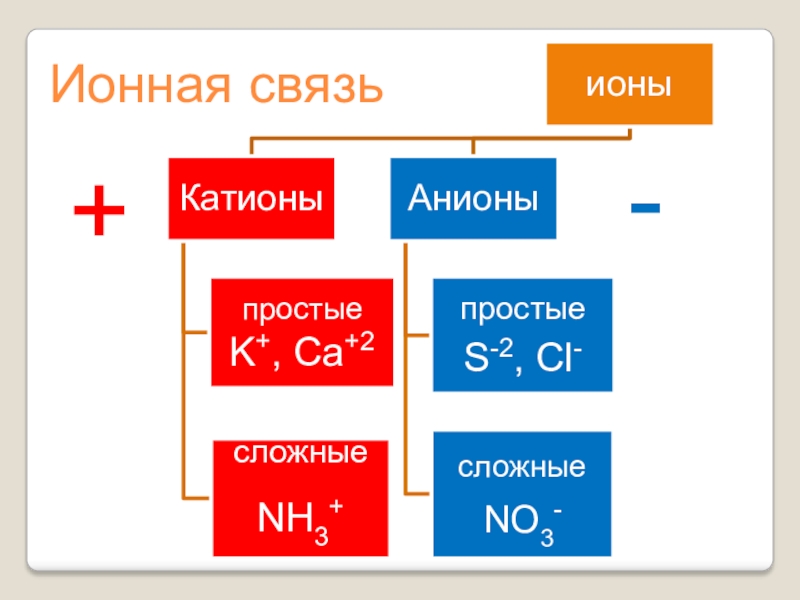
- 6. Содержание урока:Механизм образования ионной связи. Понятие катионов
- 7. Средства обучения:Компьютер, мультимедийное сопровождение.Таблица «Периодическая система химических элементов Д.И. Менделеева»Алгоритм определения типов химических связей.
- 8. Содержание деятельности преподавателя1. Наглядно-иллюстративное обучение, при котором
- 9. Содержание деятельности учеников:Носит репродуктивный характер:1. Заучивание готового
- 10. Способы мотивации учащихсяСвязь темы с повседневной жизнью.Реализация
- 11. Формы организации учебной деятельности:Общеклассная;Групповая;Самостоятельная.
- 12. Ионная связь+-
- 13. Образование катионов 11+(-11)=0
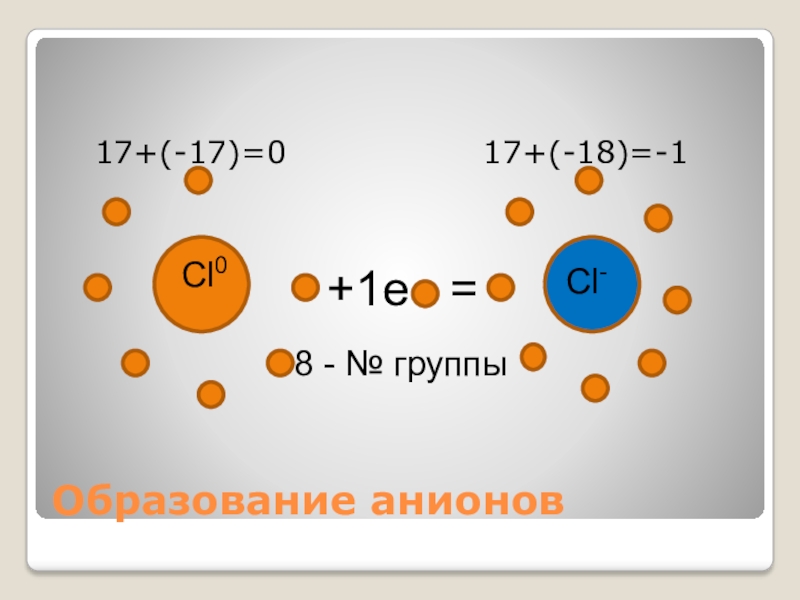
- 14. Образование анионов 17+(-17)=0
- 15. Электроотрицательность (ЭО)Способность присоединять электроныЭО(ме)
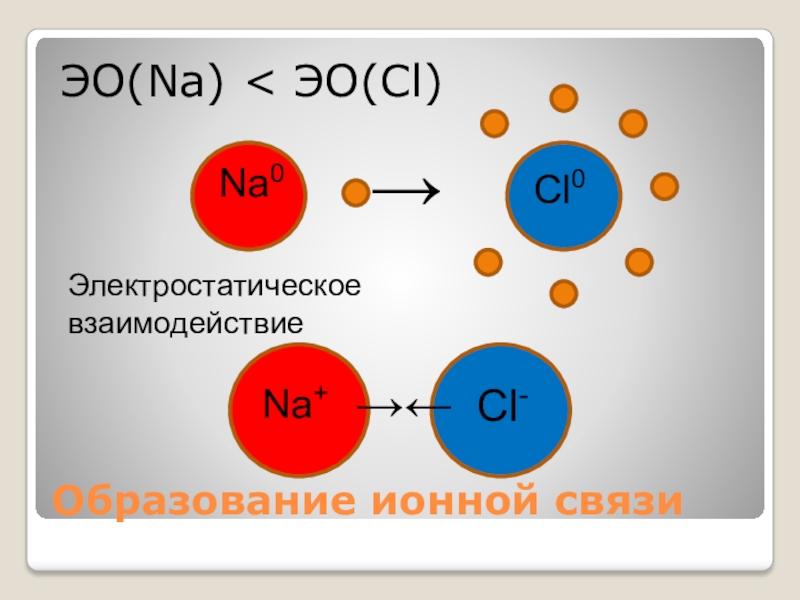
- 16. Образование ионной связиЭО(Na) < ЭО(Cl)Na0Cl0→Na+Cl-Электростатическое взаимодействие→←
- 17. Связь между заряженными частицами (ионами) за счёт электростатического взаимодействия+-
- 18. Алгоритм записи образования ионной связиЭО(Са)
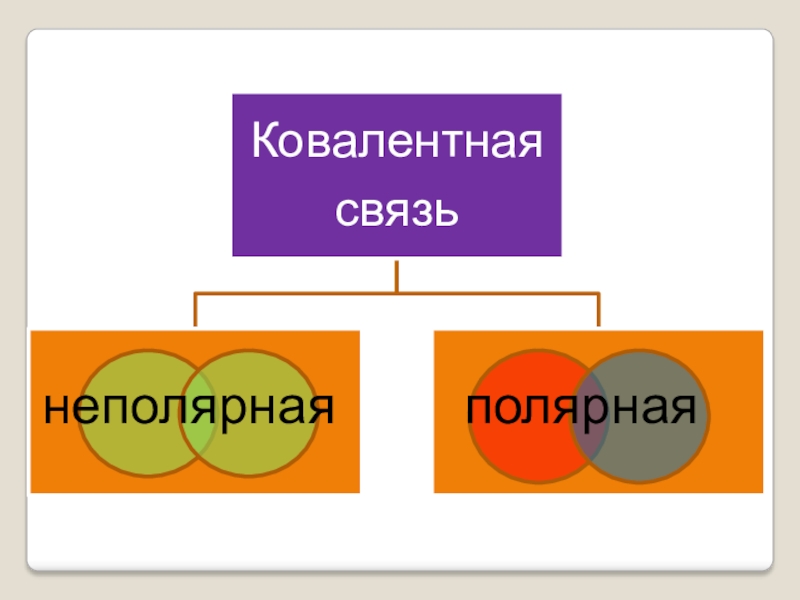
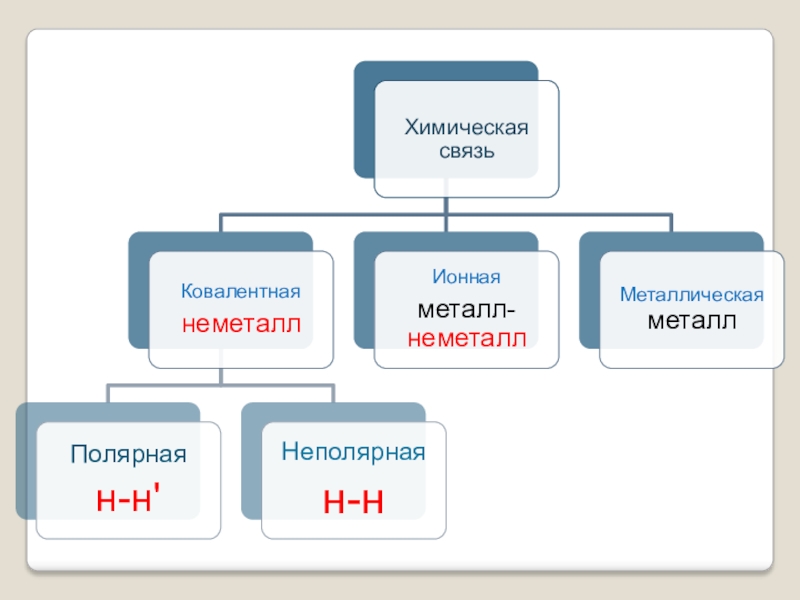
- 19. неполярнаяполярная
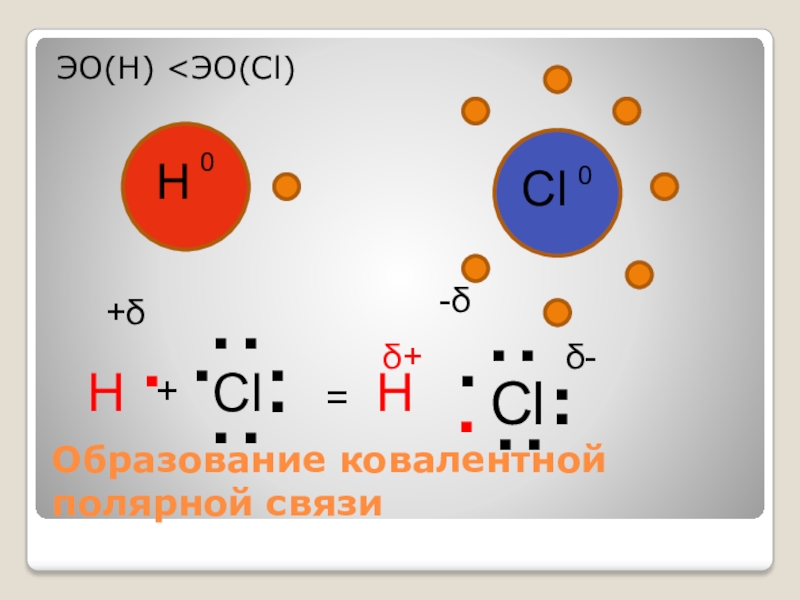
- 20. .Образование ковалентной полярной связи..ClЭО(Н)
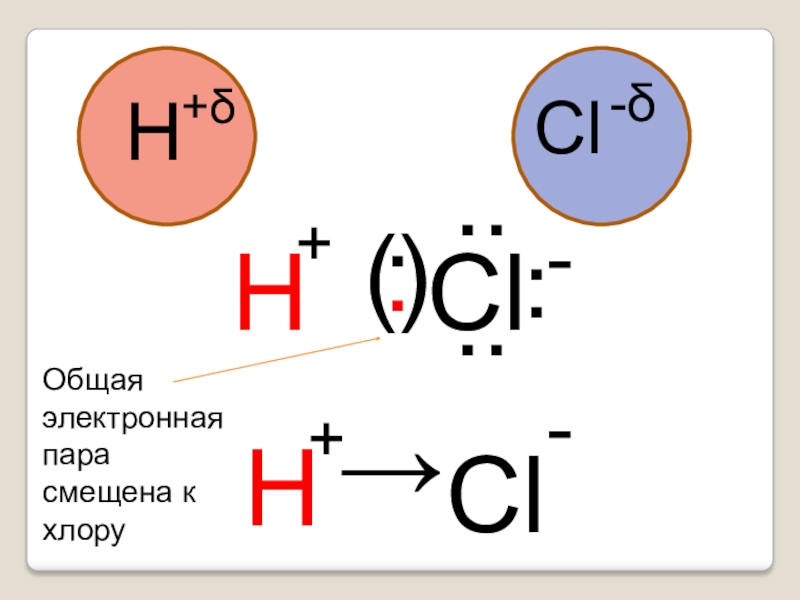
- 21. .(.)..ClH+δCl-δH....H→Cl+-+-Общая электронная парасмещена к хлору
- 22. Образование ковалентной неполярной связиЭО(Н)=ЭО(Н)Н0Н0
- 23. Образование металлической связи++++Атом-ионэлектроны
- 24. Запись образования металлической связиК0 – 1е =
- 25. Слайд 25
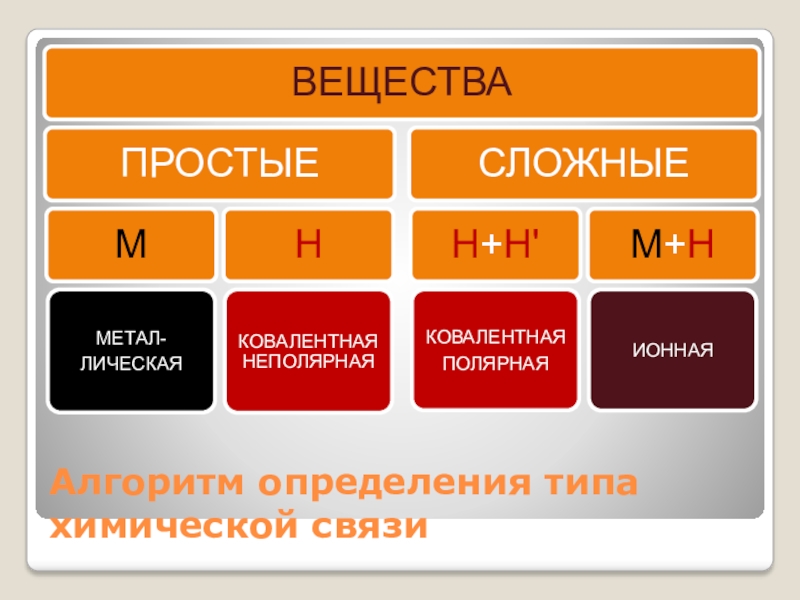
- 26. Алгоритм определения типа химической связи
- 27. Домашнее задание:§ 12 , упражнения 1- 4 стр. 51.
Тема урока: Химическая связьОт берега до берегаМожно сделать мост. Соединить два атома В молекулу – вопрос…
Слайд 2Тема урока: Химическая связь
От берега до берега
Можно сделать мост.
Соединить два
атома
В молекулу – вопрос…
В молекулу – вопрос…
Слайд 3Цели урока:
Развивающие:
развивать учебно-информационные навыки:
умение извлекать информацию из устного
сообщения, справочных таблиц, наблюдаемых процессов;
совершенствовать учебно-логические умения:
умение анализировать данные эксперимента, обобщать и делать выводы;
развивать учебно-организационные умения:
организовывать самостоятельную деятельность, совершенствовать навыки самооценки знаний и умений,
развивать познавательный интерес.
совершенствовать учебно-логические умения:
умение анализировать данные эксперимента, обобщать и делать выводы;
развивать учебно-организационные умения:
организовывать самостоятельную деятельность, совершенствовать навыки самооценки знаний и умений,
развивать познавательный интерес.
Слайд 4Цели урока:
Образовательные
Познакомить обучающихся с типами химической связи.
Изучить механизмы образования ковалентной полярной
и неполярной связи, ионной и металлической.
Дать представление о понятии ионов.
Дать представление о понятии ионов.
Слайд 5Цели урока:
Воспитательные
Совершенствовать коммуникативные умения в ходе коллективного обсуждения.
Развивать умение формулировать и
аргументировать собственное мнение.
Развивать самостоятельность.
Развивать самостоятельность.
Слайд 6Содержание урока:
Механизм образования ионной связи. Понятие катионов и анионов.
Механизмы образования ковалентной
полярной и неполярной связи.
Механизм образования металлической связи.
Алгоритм определения типа химической связи
Механизм образования металлической связи.
Алгоритм определения типа химической связи
Слайд 7Средства обучения:
Компьютер, мультимедийное сопровождение.
Таблица «Периодическая система химических элементов Д.И. Менделеева»
Алгоритм определения
типов химических связей.
Слайд 8Содержание деятельности
преподавателя
1. Наглядно-иллюстративное обучение, при котором сообщаются готовые знания, приводятся
готовые примеры.
2. Развитие исследовательской деятельности обучающихся
на основе самостоятельной работы.
3. Управление учебными действиями учеников.
2. Развитие исследовательской деятельности обучающихся
на основе самостоятельной работы.
3. Управление учебными действиями учеников.
Слайд 9Содержание деятельности
учеников:
Носит репродуктивный характер:
1. Заучивание готового учебного материала, выполнение упражнений
на закрепление знаний, воспроизведение готовых знаний.
2. Формулирование проблемы и поиск путей и решения проблемы.
3. Самоконтроль и самооценка деятельности.
2. Формулирование проблемы и поиск путей и решения проблемы.
3. Самоконтроль и самооценка деятельности.
Слайд 10Способы мотивации учащихся
Связь темы с повседневной жизнью.
Реализация межпредметных связей при объяснении
нового материала и через домашнее задание.
Постановка цели и задач урока.
Ознакомление с видами контроля знаний
Постановка цели и задач урока.
Ознакомление с видами контроля знаний
Слайд 15Электроотрицательность (ЭО)
Способность присоединять электроны
ЭО(ме)
убывает
-в периодах справа налево -убывает
-в периодах справа налево -убывает
Слайд 18
Алгоритм записи образования ионной связи
ЭО(Са) < ЭО(Сl)
Сa0
– 2е = Сa+2 Cl 0 + 1e = Cl –
Наименьшее общее кратное (нок) отданных и принятых электронов равно 2.
С одним катионом кальция (2:2=1) - Ca +2 соединяются 2 аниона хлора (2:1=2) - 2Сl –
Сa0 + Cl 0 = Сa2+ + 2Cl – = Сa2+Cl2– - формула
Наименьшее общее кратное (нок) отданных и принятых электронов равно 2.
С одним катионом кальция (2:2=1) - Ca +2 соединяются 2 аниона хлора (2:1=2) - 2Сl –
Сa0 + Cl 0 = Сa2+ + 2Cl – = Сa2+Cl2– - формула
Слайд 24Запись образования металлической связи
К0 – 1е = К+
Мg0 – 2e =
Mg2+
Al0 – 3e = Al3+
Al0 – 3e = Al3+
Количество электронов на последнем уровне
(номер группы)