- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химический эксперимент в современной школе.
Содержание
- 1. Презентация по химии на тему Химический эксперимент в современной школе.
- 2. 1. Виды эксперимента и методика
- 3. Роджер Бэкон Есть три источника знания: авторитет, разум,
- 4. Химический эксперимент - важнейший метод и средство обучения химии.
- 5. 1. Виды эксперимента и методика его использования.
- 6. Демонстрационный химический эксперимент — главное средство наглядности на уроке.
- 7. Когда применяется демонстрационный эксперимент на уроке?В начале
- 8. ТРЕБОВАНИЯ К ДЕМОНСТРАЦИОННОМУ ЭКСПЕРИМЕНТУ1. Наглядность — большой
- 9. МЕТОДИКА ПРОВЕДЕНИЯ ДЕМОНСТРАЦИОННЫХ ОПЫТОВПостановка цели опыта: для
- 10. последовательность демонстраций: • горение угля •
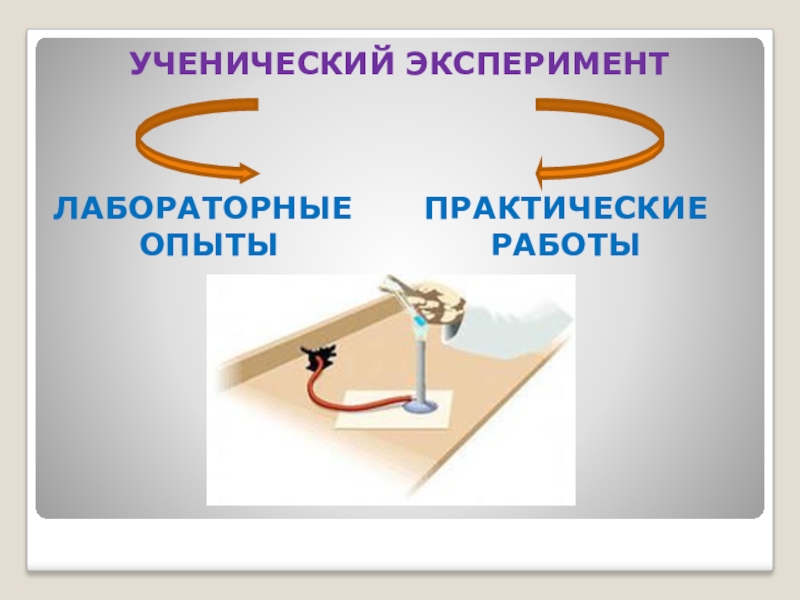
- 11. ЛАБОРАТОРНЫЕ ОПЫТЫУЧЕНИЧЕСКИЙ ЭКСПЕРИМЕНТПРАКТИЧЕСКИЕ РАБОТЫ
- 12. ЭТАПЫ ВЫПОЛНЕНИЯ- осознание цели опыта- изучение веществ-
- 13. ПО ФОРМЕ ОРГАНИЗАЦИИ ЛАБОРАТОРНЫЕ ОПЫТЫ- Индивидуальными- Групповыми- Коллективными
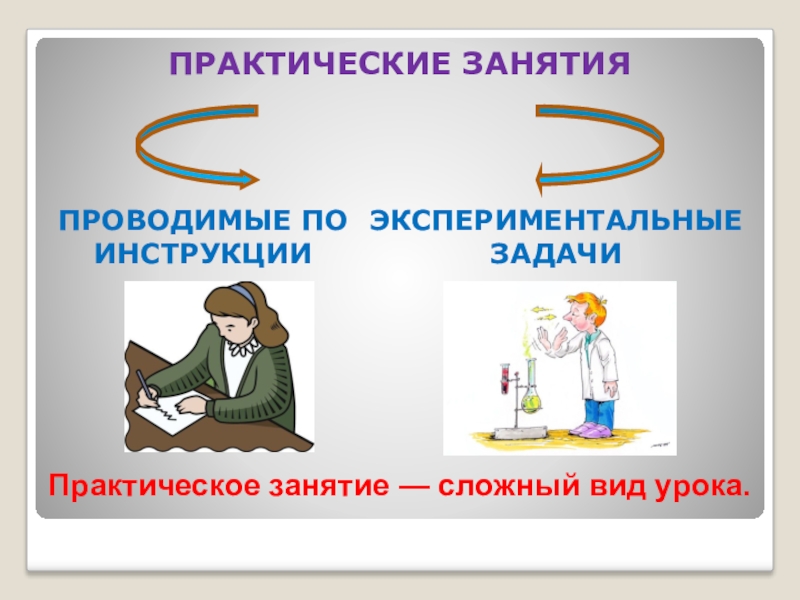
- 14. ПРОВОДИМЫЕ ПО ИНСТРУКЦИИПРАКТИЧЕСКИЕ ЗАНЯТИЯЭКСПЕРИМЕНТАЛЬНЫЕ ЗАДАЧИПрактическое занятие — сложный вид урока.
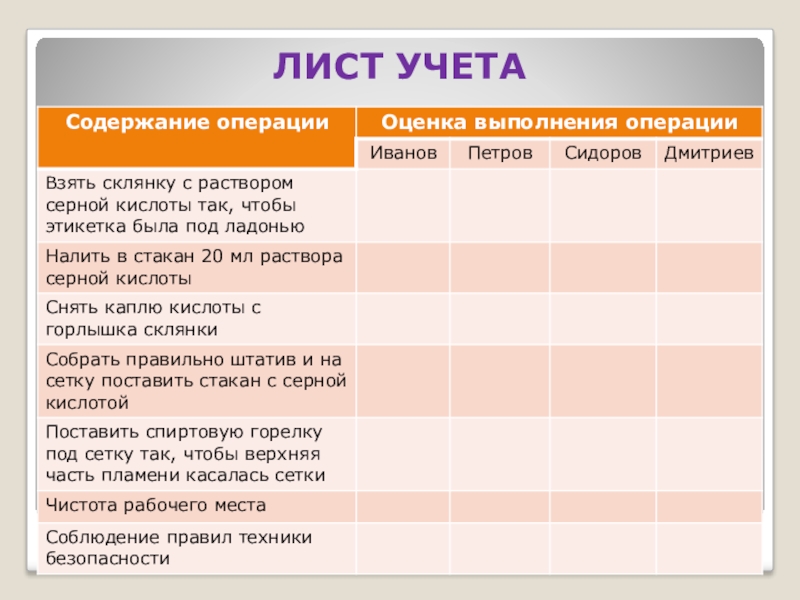
- 15. ЛИСТ УЧЕТА
- 16. ДОМАШНИЙ ХИМИЧЕСКИЙ ЭКСПЕРИМЕНТ – один из видов
- 17. ОПЫТЫ С НАБЛЮДЕНИЕМ ЯВЛЕНИЙ
- 18. ОПЫТЫ С РАЗДЕЛЕНИЕМ СМЕСИ ВЕЩЕСТВ
- 19. 2. Функции химического эксперимента. - Эвристическая- Корректирующая - Обобщающая - Исследовательская
- 20. РЕАКЦИЯ ВЗАИМОДЕЙСТВИЯ ГАЗООБРАЗНОГО ВОДОРОДА С ОКСИДОМ МЕДИ (II)ЭВРИСТИЧЕСКАЯ ФУНКЦИЯ
- 21. CПОСОБ ПОЛУЧЕНИЯ КИСЛОРОДА ИЗ ПЕРОКСИДА ВОДОРОДА
- 22. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
- 23. КОРРЕКТИРУЮЩАЯ ФУНКЦИЯ
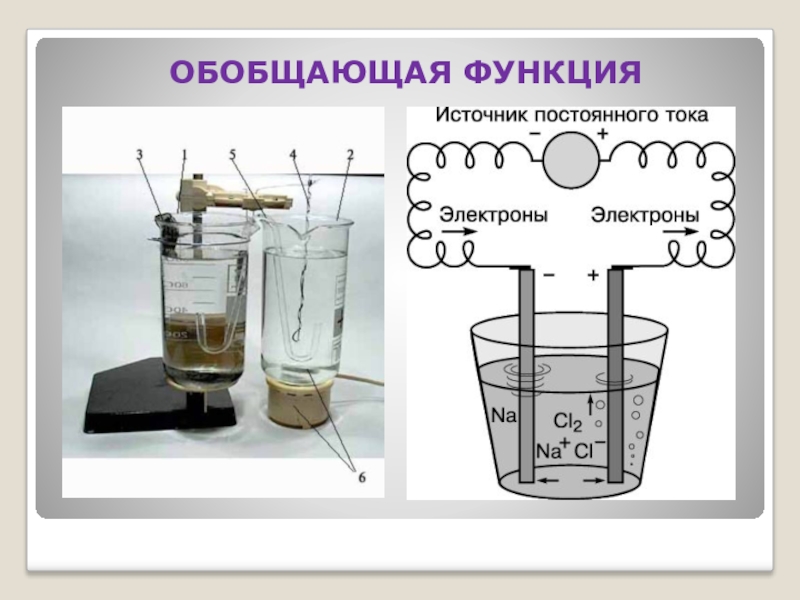
- 24. ОБОБЩАЮЩАЯ ФУНКЦИЯ
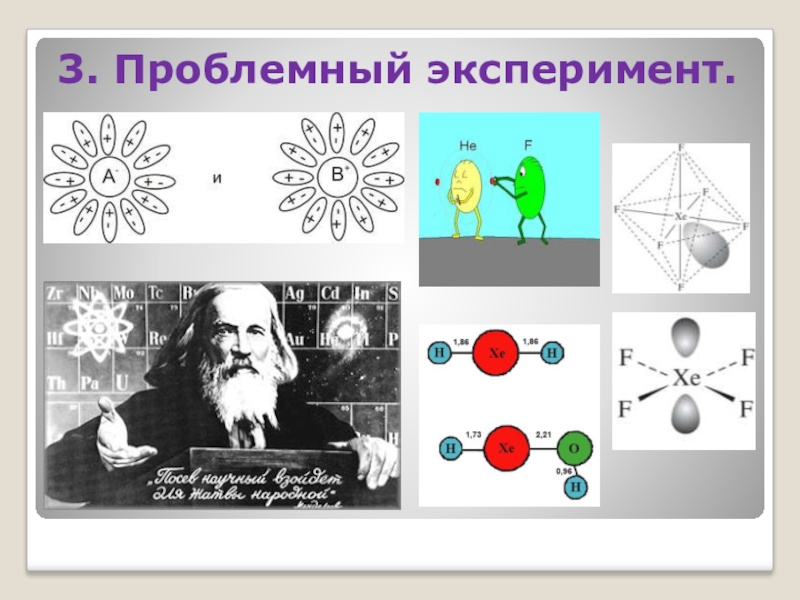
- 25. 3. Проблемный эксперимент.
- 26. САМ УЧЕНИК МОЖЕТ БЫТЬ ПОСТАВЛЕН В РОЛЬ ИССЛЕДОВАТЕЛЯ, ГЕНЕРАТОРА ИДЕЙ
- 27. ДЛЯ ХИМИИ ХАРАКТЕРЕН ЭКСПЕРИМЕНТ, КОТОРЫЙ НОСИТ ИССЛЕДОВАТЕЛЬСКИЙИ ПРОБЛЕМНЫЙ ХАРАКТЕР
- 28. 1) В чем причина наблюдаемого
- 29. водород, выделяющийся из соляной кислоты, затрачивается на
- 30. - актуализация знаний; - постановка целей исследования;
- 31. ЭКСПЕРИМЕНТ- ПУТЬ ПРЕВРАЩЕНИЯ ЗНАНИЙ В УБЕЖДЕНИЯ
- 32. Слабая кислота вытесняет сильную из ее солиПРИМЕРЫ
- 33. ИЗМЕНЕНИЕ ЭНТАЛЬПИИ ХИМИЧЕСКОЙ РЕАКЦИИ ∆Н°(р-ции)ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ 2NaCl +
- 34. 2NaCl + 4Н3ВО3 = Na2B4О7 + 5Н2O+
- 35. Т= ∆Н/∆S ТЕМПЕРАТУРА, ПРИ КОТОРОЙ ВОЗМОЖНО ПРОТЕКАНИЕ
- 36. Реактивы. Свежеосажденная медь, 10%-й раствор хлорида железа
- 37. Е = E(ок-ля ) — E(в-ля)ЭДС (Е)
- 38. Реактивы. 15-25 %-й раствор аммиака, свежеосажденная медь.Растворение
- 39. РАСЧЕТ ЭДС:Cu + 4NH3 - 2ē =
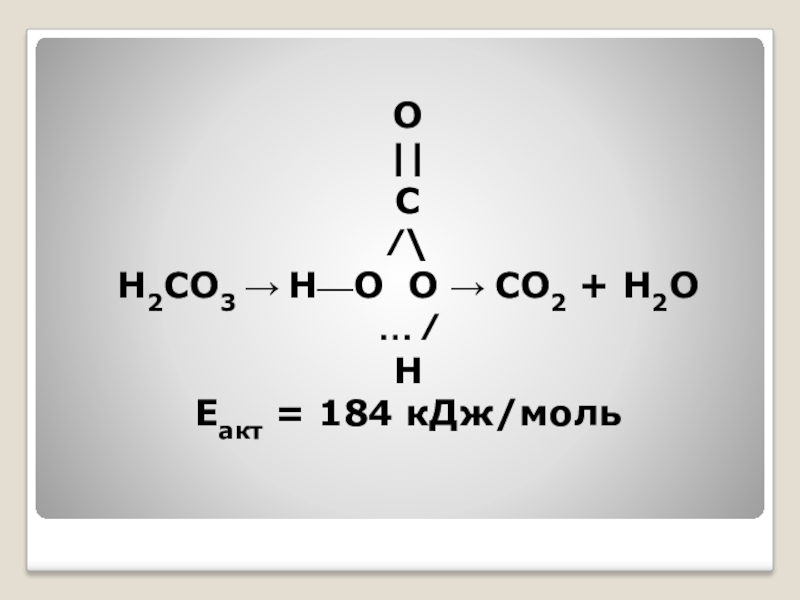
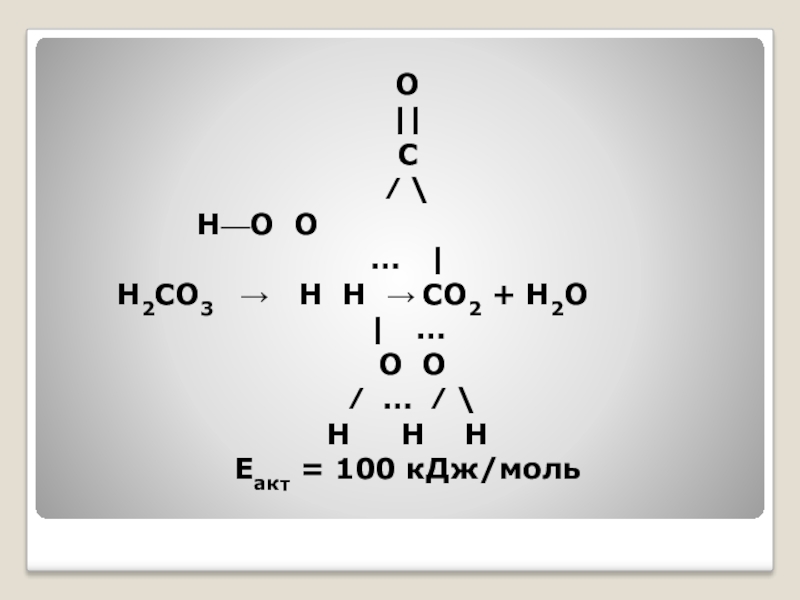
- 40. ...В свободном виде угольная кислота неизвестна, так
- 41. O||С⁄\H2CO3 → Н—О О → СО2 + Н2О… ⁄ Н Еакт = 184 кДж/моль
- 42. O||С⁄ \ Н—О О…
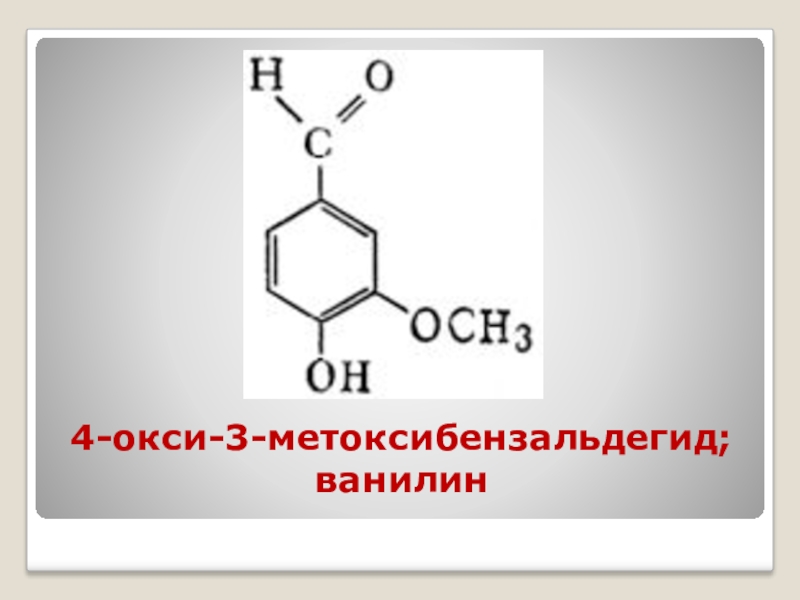
- 43. Ваниль, - душистая добавка к кондитерским изделиям.Ванилью
- 44. 4-окси-3-метоксибензальдегид; ванилин
- 45. Слайд 45
- 46. 1. Приготовьте 3%-ый водный раствор ванилина (при
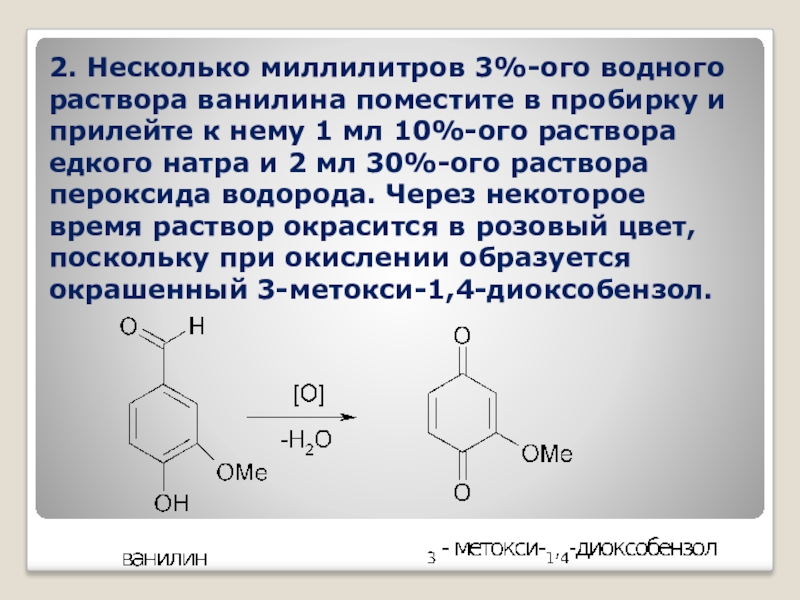
- 47. 2. Несколько миллилитров 3%-ого водного раствора ванилина
- 48. 3. Поскольку ванилин содержит альдегидную группу, то
Слайд 21. Виды эксперимента и методика его использования. 2. Функции химического
ПЛАН ЛЕКЦИИ
Слайд 3Роджер Бэкон
Есть три источника знания: авторитет, разум, опыт. Однако авторитет недостаточен,
Слайд 7Когда применяется демонстрационный эксперимент на уроке?
В начале школьного курса — для
Когда он сложен для самостоятельного выполнения учащимися.
Когда он опасен для учащихся.
Нет соответствующего оборудования и реактивов.
Слайд 8ТРЕБОВАНИЯ К ДЕМОНСТРАЦИОННОМУ ЭКСПЕРИМЕНТУ
1. Наглядность — большой объем реактивов и посуды,
2. Простота — в приборах не должно быть нагромождения лишних деталей.
3. Безопасность — учитель химии несет ответственность за жизнь учащихся.
4. Надежность - неудавшийся опыт вызывает разочарование у учащихся.
5. Техника выполнения опыта должна быть безукоризненная.
6. Необходимость объяснения демонстрационного эксперимента.
Слайд 9МЕТОДИКА ПРОВЕДЕНИЯ ДЕМОНСТРАЦИОННЫХ ОПЫТОВ
Постановка цели опыта: для чего проводится данный опыт,
2. Описание прибора, где проводится опыт,
и условий его проведения.
3. Организация наблюдений учащихся:
учитель должен сориентировать учеников, за
какой частью прибора должны вестись
наблюдения.
4. Выводы.
Слайд 10последовательность демонстраций:
• горение угля
• горение серы
• горение фосфора
• горение железа
ТЕМА «КИСЛОРОД»
При
и гармонично включать их в канву урока.
Слайд 12ЭТАПЫ ВЫПОЛНЕНИЯ
- осознание цели опыта
- изучение веществ
- монтаж прибора
- выполнение опыта
-
- объяснение полученных результатов
- написание химических уравнений
- формулировка выводов
- составление отчета
Слайд 14ПРОВОДИМЫЕ ПО ИНСТРУКЦИИ
ПРАКТИЧЕСКИЕ ЗАНЯТИЯ
ЭКСПЕРИМЕНТАЛЬНЫЕ ЗАДАЧИ
Практическое занятие — сложный вид урока.
Слайд 16ДОМАШНИЙ ХИМИЧЕСКИЙ ЭКСПЕРИМЕНТ –
один из видов самостоятельной работы учащихся
Используемые реактивы
в хозяйственных магазинах или аптеках.
Слайд 192. Функции химического эксперимента.
- Эвристическая
- Корректирующая
- Обобщающая
- Исследовательская
Слайд 281) В чем причина наблюдаемого явления? 2) Почему добавление азотной
ЭКСПЕРИМЕНТ ЗАСТАВЛЯЕТ ЗАДУМАТЬСЯ НАД РЯДОМ ВОПРОСОВ:
Слайд 29водород, выделяющийся из соляной кислоты, затрачивается на восстановление азотной кислоты.
РАБОЧАЯ
HNО3 + 8Н = NH3 + ЗН2О
NH3 + НСl = NH4Cl
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Вывод:
водород расходуется на восстановление азотной кислоты.
Слайд 30- актуализация знаний; - постановка целей исследования; - проведение теоретического анализа; - построение гипотезы; -
СХЕМА ИССЛЕДОВАНИЯ СВОЙСТВ ВЕЩЕСТВ
Слайд 31ЭКСПЕРИМЕНТ-
ПУТЬ ПРЕВРАЩЕНИЯ ЗНАНИЙ В УБЕЖДЕНИЯ
ЭКСПЕРИМЕНТ-
ВАЖНЕЙШИЙ ПУТЬ ОСУЩЕСТВЛЕНИЯ СВЯЗИ
ПРИ ОБУЧЕНИИ ХИМИИ
Слайд 32Слабая кислота вытесняет сильную из ее соли
ПРИМЕРЫ ПАРАДОКСАЛЬНЫХ ОПЫТОВ
Реактивы. Борная кислота,
универсальная индикаторная или синяя
лакмусовая бумага.
Объяснение опыта.
2NaCl + 4Н3ВО3 = Na2B4О7 + 5Н2O+ 2HCl↑
Слайд 33ИЗМЕНЕНИЕ ЭНТАЛЬПИИ ХИМИЧЕСКОЙ РЕАКЦИИ ∆Н°(р-ции)
ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ
2NaCl + 4Н3ВО3 = Na2B4О7
∆Н °298-410 -1087,6 -3290 -241,84 -92,3
кДж/моль
СОГЛАСНО СЛЕДСТВИЮ ИЗ ЗАКОНА ГЕССА:
∆Н (р-ции) = ∑∆Н(прод. р-ции) — ∑ ∆Н (исх. в-в)
∆Н °(р-ции) = [(-3290) + (-241,84 • 5) + (-92,3 • 2)] -
- [(-1087,6 • 4) + (-410 • 2)] = =486,6 кДж.
Слайд 34 2NaCl + 4Н3ВО3 = Na2B4О7 + 5Н2O+ 2HCl↑ ∆S°298
ИЗМЕНЕНИЕ ЭНТРОПИИ ХИМИЧЕСКОЙ РЕАКЦИИ ∆S°(р-ции)
∆S° (р-ции) = ∑∆S(прод. р-ции) — ∑∆S(исх. в-в)
ИЗМЕНЕНИЕ ЭНЕРГИИ ГИББСА
∆G = ∆Н - T∆S
∆G° = 486,6 - 298 • 1= 188,6 кДж.
∆S°(р-ции) = (189,5 + 188,74-5 + 186,7-2) –
- (72,36 • 2 + 89,49 • 4) = 1003,9 Дж/К = =1кДж/К.
Слайд 35Т= ∆Н/∆S
ТЕМПЕРАТУРА, ПРИ КОТОРОЙ ВОЗМОЖНО ПРОТЕКАНИЕ РЕАКЦИИ
Т= ∆Н/∆S = 486,6/1
ВЫВОД:
Данная химическая реакция протекает при сравнительно небольшом нагревании.
Слайд 36Реактивы. Свежеосажденная медь, 10%-й раствор хлорида железа (III).
Растворение меди в растворе
Объяснение опыта.
Сu + FeCl3 = СuС12 + FeCl2
Ион железа Fe3+ — окислитель,
атом меди — восстановитель.
Слайд 37Е = E(ок-ля ) — E(в-ля)
ЭДС (Е) окислительно-восстановительного элемента равна:
Если Е>0,
Окислительно-восстановительные потенциалы пар равны:
E°(Fe3+/Fe2+) = 0,771 В E°(Cu2+/Cu°) = 0,338 В
ЭДС = 0,771 - 0,338 = 0,433 В
ВЫВОД: Положительное значение ЭДС
подтверждает возможность протекания
данной реакции в стандартных условиях.
Слайд 38Реактивы. 15-25 %-й раствор аммиака, свежеосажденная медь.
Растворение меди
в растворе аммиака
Объяснение
2Cu + 8NH3 + O2 + 2H2O =
= 2[Cu(NH3)4]2+ + 4OH-
Слайд 39РАСЧЕТ ЭДС:
Cu + 4NH3 - 2ē = 2[Cu(NH3)4]2+ Е°
O2 + 2H2O + 4ē = 4OH- Е° = 0,401 В
ЭДС = 0,401 – (-0,07) = 0,408 В
ВЫВОД: Положительное значение ЭДС
подтверждает возможность протекания
данной реакции в стандартных условиях.
Слайд 40...В свободном виде угольная кислота неизвестна, так как она неустойчива и
Угольная кислота
NH4HCO3 → NH3 + H2CO3
Слайд 43Ваниль, - душистая добавка к кондитерским изделиям.
Ванилью называют высушенные плоды, стручки
Слайд 461. Приготовьте 3%-ый водный раствор ванилина (при 14˚С в 100 г
Слайд 472. Несколько миллилитров 3%-ого водного раствора ванилина поместите в пробирку и
Слайд 483. Поскольку ванилин содержит альдегидную группу, то он может давать реакцию

































![Презентация по химии на тему Химический эксперимент в современной школе. РАСЧЕТ ЭДС:Cu + 4NH3 - 2ē = 2[Cu(NH3)4]2+ Е° = РАСЧЕТ ЭДС:Cu + 4NH3 - 2ē = 2[Cu(NH3)4]2+ Е° = - 0,07 В O2 +](/img/thumbs/3d3518ab0596e6bcd627ee2d5ab89a84-800x.jpg)