- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Гидролиз солей
Содержание
- 1. Презентация по химии на тему: Гидролиз солей
- 2. План урока:Сущность процесса гидролиза.Алгоритм составления уравнений гидролиза.Поведение солей различных типов в растворе
- 3. ОпросЧто такое раствор?Какие растворы Вы знаете?Что такое соль?
- 4. Ответы Раствор - это гомогенная система состоящая
- 5. 1. Сущность процесса гидролиза солейПросмотр учебного фильма:
- 6. Слайд 6
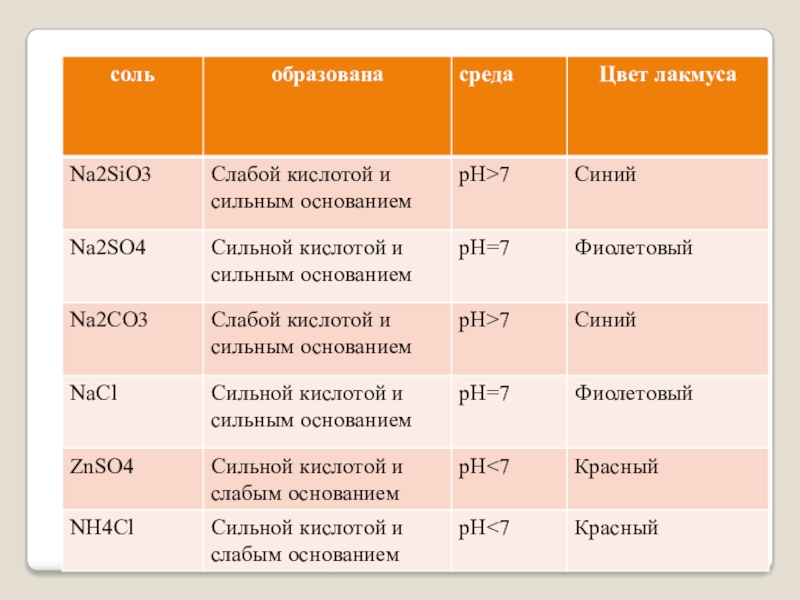
- 7. Вывод:Реакцию среды определяет наличие избытка катионов водорода и гидроксид аниона.Среда по сильному, гидролиз по слабому
- 8. 2. Алгоритм составления уравнений гидролиза2.1. определить состав
- 9. 3.НапримерNaCH3COO (ацетат натрия), смотр видео фильма3.1 Состав
- 10. Закрепление напишите гидролиз следующих солейКарбонат калияХлорид аммонияСульфат цинкаАцетат аммония
- 11. Гидролиз в нашей жизниГидролиз сахарозы (смотр видео фильма)
План урока:Сущность процесса гидролиза.Алгоритм составления уравнений гидролиза.Поведение солей различных типов в растворе
Слайд 2План урока:
Сущность процесса гидролиза.
Алгоритм составления уравнений гидролиза.
Поведение солей различных типов в
растворе
Слайд 4Ответы
Раствор - это гомогенная система состоящая из двух и более
компонентов.
Виды растворов: насыщенные, ненасыщенные, пересыщенные. Если растворитель вода, тогда растворы будут в названии иметь слово «водный».
Соль - это электролиты, которые при диссоциации в водных растворах образуют катионы металлов и анионы кислотных остатков.
Виды растворов: насыщенные, ненасыщенные, пересыщенные. Если растворитель вода, тогда растворы будут в названии иметь слово «водный».
Соль - это электролиты, которые при диссоциации в водных растворах образуют катионы металлов и анионы кислотных остатков.
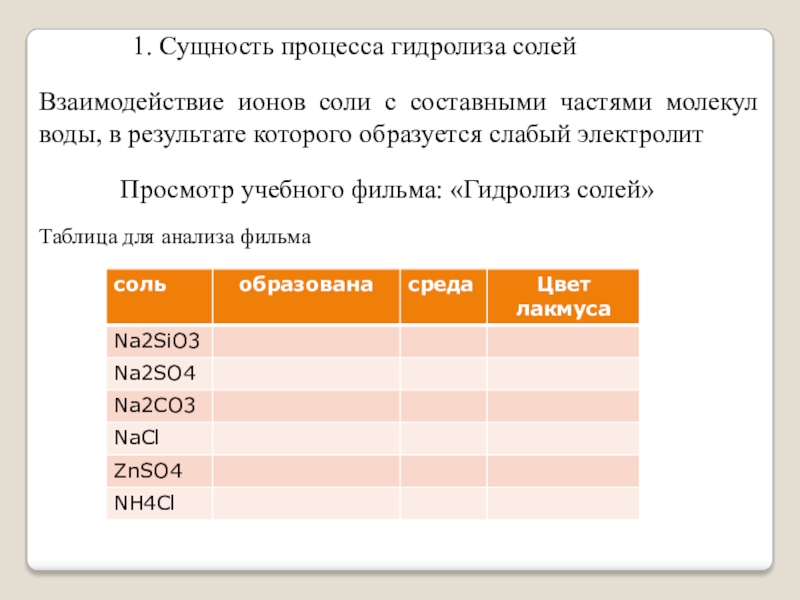
Слайд 51. Сущность процесса гидролиза солей
Просмотр учебного фильма: «Гидролиз солей»
Таблица для анализа
фильма
Взаимодействие ионов соли с составными частями молекул воды, в результате которого образуется слабый электролит
Слайд 7Вывод:
Реакцию среды определяет наличие избытка катионов водорода и гидроксид аниона.
Среда по
сильному, гидролиз по слабому
Слайд 82. Алгоритм составления уравнений гидролиза
2.1. определить состав соли, т.е. указать, каким
по силе основанием и какой по силе кислотой образована данная соль.
2.2. выписать ион слабого электролита и написать уравнение взаимодействия его с одной молекулой воды; в результате получится краткое ионно-молекулярное уравнение гидролиза (уравнение гидролиза лучше писать в краткой ионно-молекулярной форме).
2.3. на основании краткого ионно-молекулярного уравнения написать молекулярное уравнение: исходные вещества известны (соль, вода); продукты гидролиза будут состоять из образовавшихся ионов и тех ионов соли, которые не участвуют в процессе гидролиза.
2.2. выписать ион слабого электролита и написать уравнение взаимодействия его с одной молекулой воды; в результате получится краткое ионно-молекулярное уравнение гидролиза (уравнение гидролиза лучше писать в краткой ионно-молекулярной форме).
2.3. на основании краткого ионно-молекулярного уравнения написать молекулярное уравнение: исходные вещества известны (соль, вода); продукты гидролиза будут состоять из образовавшихся ионов и тех ионов соли, которые не участвуют в процессе гидролиза.
Слайд 93.Например
NaCH3COO (ацетат натрия), смотр видео фильма
3.1 Состав соли
Катион сильного основания NaOH
и анион слабой кислоты CH3COOH
3.2 Краткое уравнение
CH3COO- + HOH ↔ CH3COOH + OH-
3.3 Пишем молекулярное уравнение
NaCH3COO + H2O ↔ CH3COOH + NaOH
3.2 Краткое уравнение
CH3COO- + HOH ↔ CH3COOH + OH-
3.3 Пишем молекулярное уравнение
NaCH3COO + H2O ↔ CH3COOH + NaOH