- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Галогены (9 класс)
Содержание
- 1. Презентация по химии на тему Галогены (9 класс)
- 2. Галогены как химические элементыVII группа, главная подгруппаОбщее__
- 3. Слайд 3
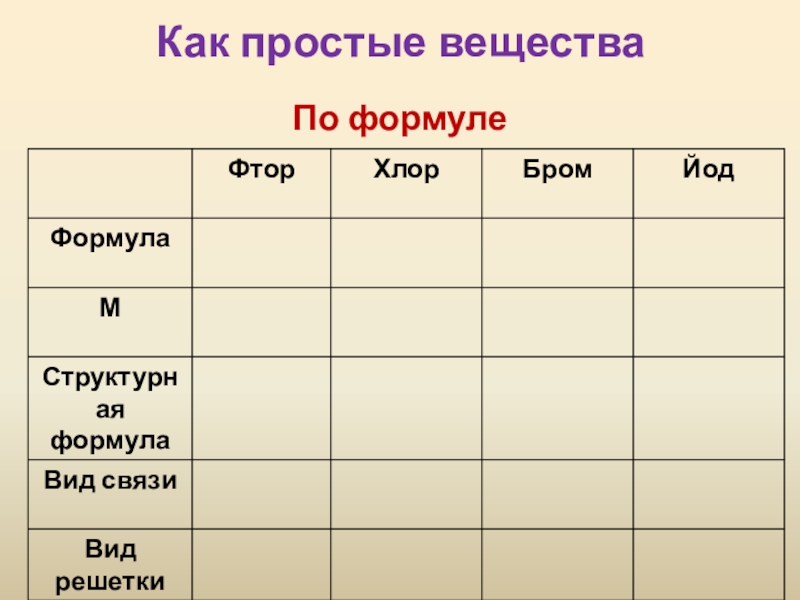
- 4. Как простые веществаПо формуле
- 5. Слайд 5
- 6. Возгонка (Сублимация) – переход вещества из твердого
- 7. Химические свойстваH2 + Hal2→ HHal
- 8. Получение 1.Промышленный методЭлектролиз MeHalx NaCl ток→
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Природные соединенияFПлавиковый шпат – CaF2 ClNaCl – сольKCl – сильвинKCl∙MgCl2∙6H2O – карналлитBr, IМорская вода (водоросли)
- 13. Водородные соединения галогеновHF – фтороводород (раствор в
- 14. Водородные соединения галогеновHCl – хлороводород (раствор в
- 15. Кислородсодержащие кислоты хлора HClO — хлорноватистая кислота.Cоли —
- 16. Водородные соединения галогеновHBr– бромоводород (раствор в воде
Галогены как химические элементыVII группа, главная подгруппаОбщее__ е на внешнем уровнеВалентность _____, степени окисления ____Различие от F до At_______ радиус атомов_______металличность_______ неметалличность ________ электроотрицательность
Слайд 2Галогены как химические элементы
VII группа, главная подгруппа
Общее
__ е на внешнем уровне
Валентность
_____, степени окисления ____
Различие от F до At
_______ радиус атомов
_______металличность
_______ неметалличность
________ электроотрицательность
Различие от F до At
_______ радиус атомов
_______металличность
_______ неметалличность
________ электроотрицательность
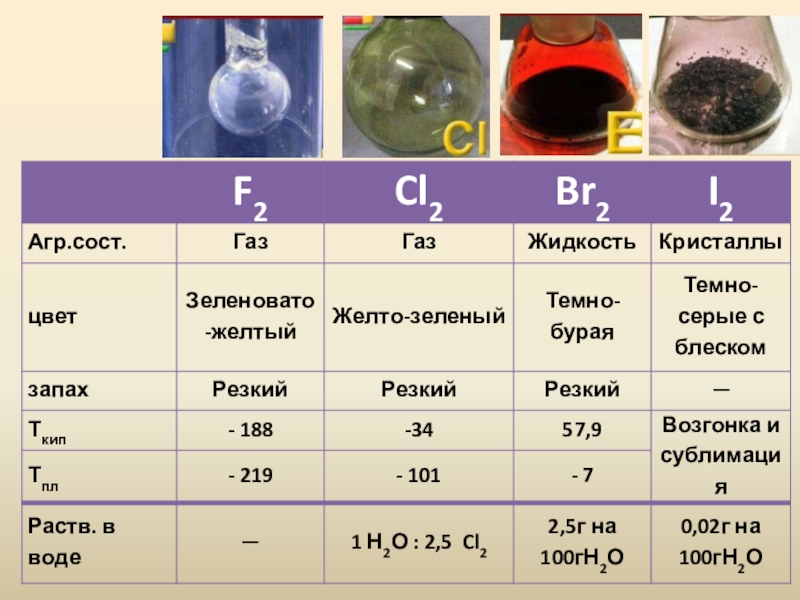
Слайд 6Возгонка (Сублимация) – переход вещества из твердого агрегатного состояния в газообразное,
минуя жидкое
Десублимация– переход вещества из газообразного агрегатного состояния в твердое, минуя жидкое
Десублимация– переход вещества из газообразного агрегатного состояния в твердое, минуя жидкое
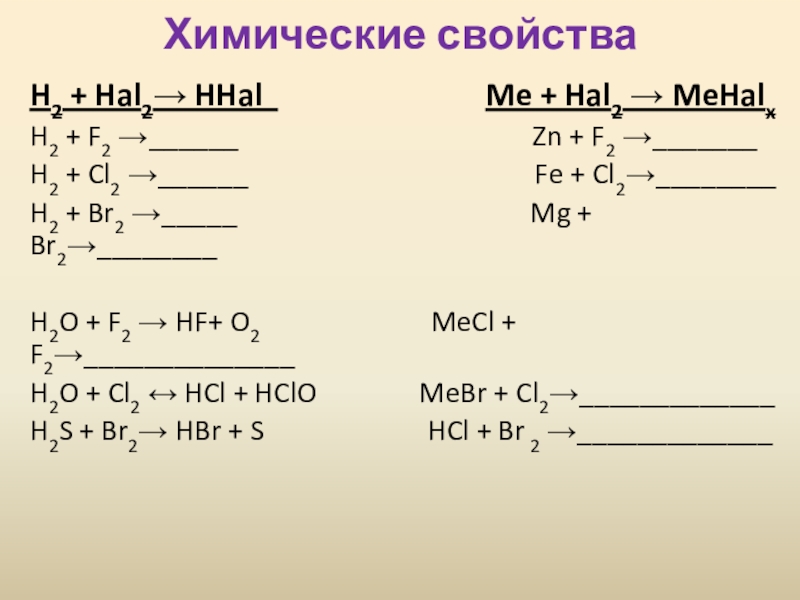
Слайд 7Химические свойства
H2 + Hal2→ HHal
Me + Hal2 → MeHalx
H2 + F2 →______ Zn + F2 →_______
H2 + Cl2 →______ Fe + Cl2→________
H2 + Br2 →_____ Mg + Br2→________
H2O + F2 → HF+ O2 MeCl + F2→______________
H2O + Cl2 ↔ HCl + HClO MeBr + Cl2→_____________
H2S + Br2→ HBr + S HCl + Br 2 →_____________
H2 + F2 →______ Zn + F2 →_______
H2 + Cl2 →______ Fe + Cl2→________
H2 + Br2 →_____ Mg + Br2→________
H2O + F2 → HF+ O2 MeCl + F2→______________
H2O + Cl2 ↔ HCl + HClO MeBr + Cl2→_____________
H2S + Br2→ HBr + S HCl + Br 2 →_____________
Слайд 8
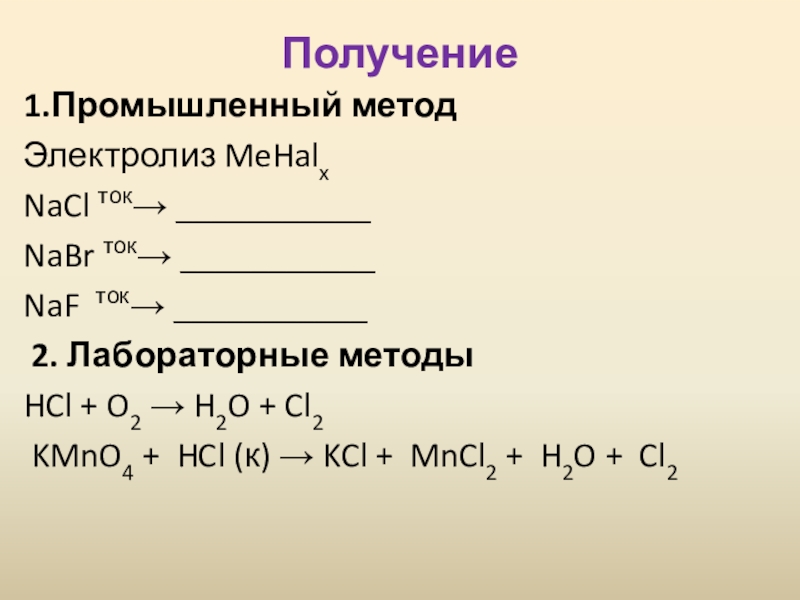
Получение
1.Промышленный метод
Электролиз MeHalx
NaCl ток→ ___________
NaBr ток→ ___________
NaF ток→ ___________
2. Лабораторные
методы
HCl + O2 → H2O + Cl2
KMnO4 + HCl (к) → KCl + MnCl2 + H2O + Cl2
HCl + O2 → H2O + Cl2
KMnO4 + HCl (к) → KCl + MnCl2 + H2O + Cl2
Слайд 12Природные соединения
F
Плавиковый шпат – CaF2
Cl
NaCl – соль
KCl – сильвин
KCl∙MgCl2∙6H2O –
карналлит
Br, I
Морская вода (водоросли)
Br, I
Морская вода (водоросли)
Слайд 13Водородные соединения галогенов
HF – фтороводород
(раствор в воде – плавиковая кислота)
Кислота
средней силы, ядовита, вызывает ожоги.
HF + SiO2→ SiF4 + H2O
HF + SiO2→ SiF4 + H2O
Слайд 14Водородные соединения галогенов
HCl – хлороводород (раствор в воде – соляная кислота)
Сильная
кислота, вызывает ожоги, «дымит»
HCl + Me (доН)→____________________
HCl + MeO →____________________
HCl + MeOH →____________________
Качественная реакция на Cl─
Cl─ + Ag+ →AgCl (белый осадок)
HCl + Me (доН)→____________________
HCl + MeO →____________________
HCl + MeOH →____________________
Качественная реакция на Cl─
Cl─ + Ag+ →AgCl (белый осадок)
Слайд 15Кислородсодержащие кислоты хлора
HClO — хлорноватистая кислота.
Cоли — гипохлориты.
HClO2 — хлористая кислота.
Соли
— хлориты.
HClO3 — хлорноватая кислота.
Соли — хлораты.
HClO4 — хлорная кислота.
Соли — перхлораты.
с увеличением степени окисления хлора увеличивается сила кислот и окислительные свойства
HClO3 — хлорноватая кислота.
Соли — хлораты.
HClO4 — хлорная кислота.
Соли — перхлораты.
с увеличением степени окисления хлора увеличивается сила кислот и окислительные свойства
Слайд 16Водородные соединения галогенов
HBr– бромоводород
(раствор в воде – бромная кислота)
HBr +
Me (доН)→____________________
HBr + MeO →____________________
HBr + MeOH →____________________
Качественная реакция на Br─
Br─ + Ag+ →AgBr (желтый осадок)
HBr + MeO →____________________
HBr + MeOH →____________________
Качественная реакция на Br─
Br─ + Ag+ →AgBr (желтый осадок)