- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Галогены (8 класс)
Содержание
- 1. Презентация по химии на тему Галогены (8 класс)
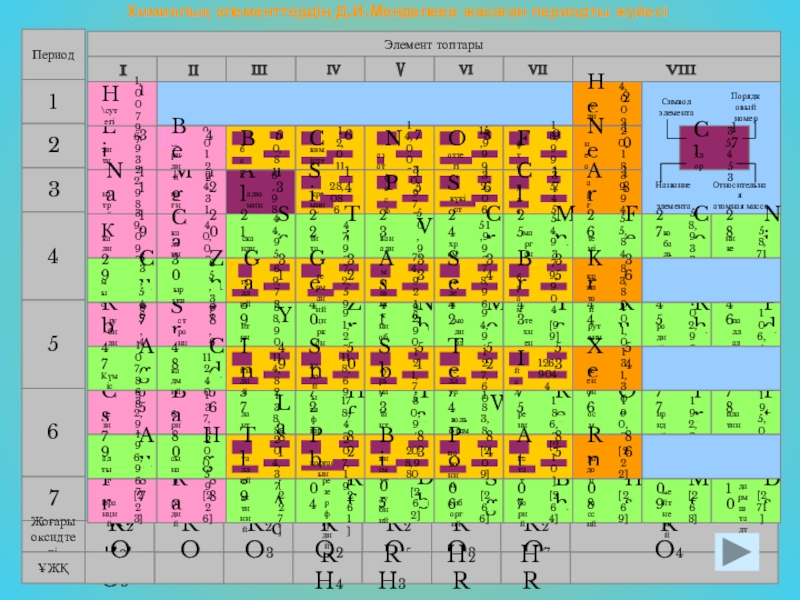
- 2. Химиялық элементтердің Д.И.Менделеев жасаған периодты жүйесі
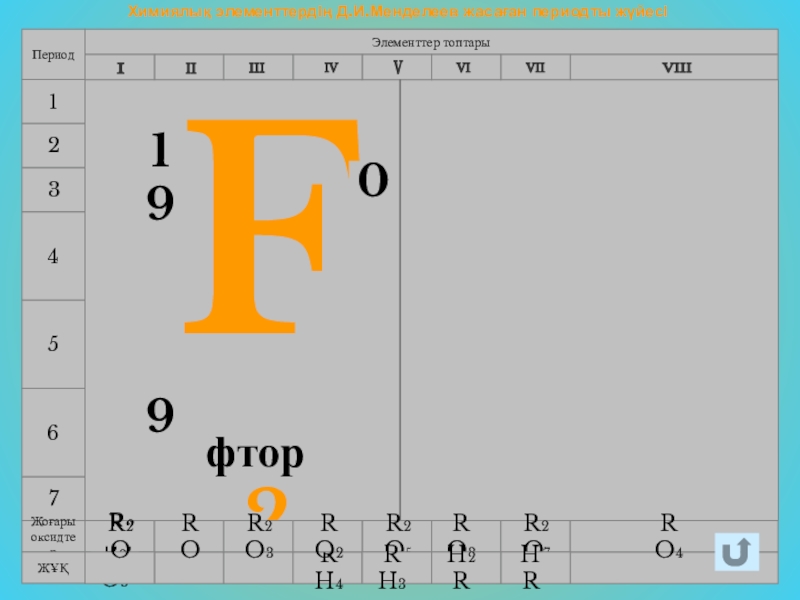
- 3. Химиялық элементтердің Д.И.Менделеев жасаған периодты жүйесі7456Элементтер топтарыПериод123F29190фтор
- 4. Химиялық элементтердің Д.И.Менделеев жасаған периодты жүйесіwww.testent.ru7456Элемент топтарыПериод123Cl+1735,50К.ШеелеГ.Деви
- 5. Химиялық элементтердің Д.И.Менделеев жасаған периодты жүйесіwww.testent.ru7456Элемент топтарыПериод123Br235800бром
- 6. Периодическая система химических элементов Д.И.Менделееваwww.testent.ru7456Элемент топтарыПериод123I2531270йод
- 7. Хлор.www.testent.ru1. Электронды құрылысы2. Физикалық қасиеттері3 Химиялық қасиеттері4. Қосылыстары 5. Қолданылуы6. Білім тексеру
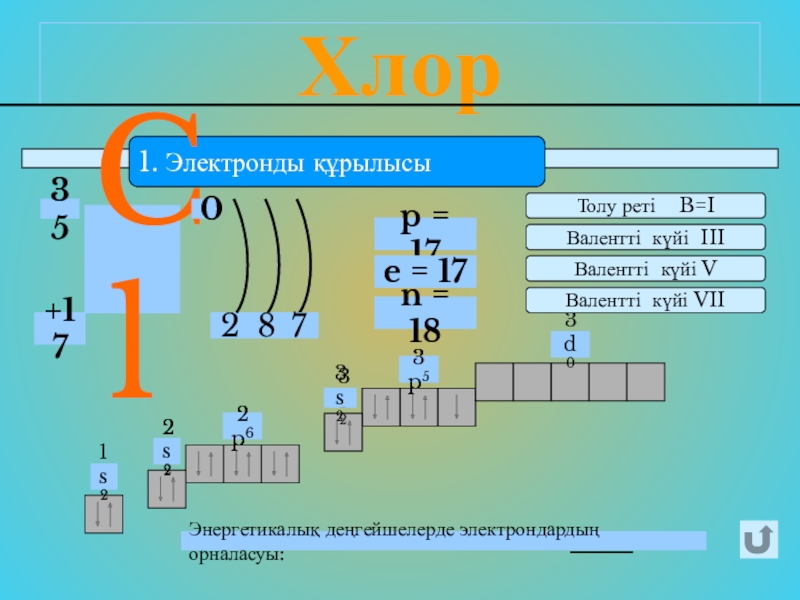
- 8. Хлор1. Электронды құрылысы2Cl0+173587p = 17e = 17n
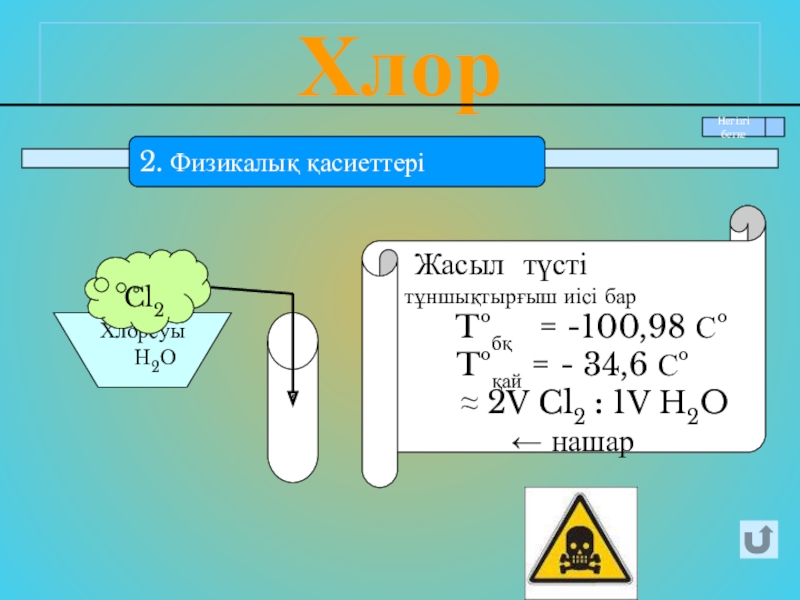
- 9. Хлор2. Физикалық қасиеттері Жасыл түсті
- 10. ХлорТотықтырғыш (C, O2, N2 және тағы кейбіреулерінен
- 11. Хлор Изотоптары: 35Cl – 75,77% ,
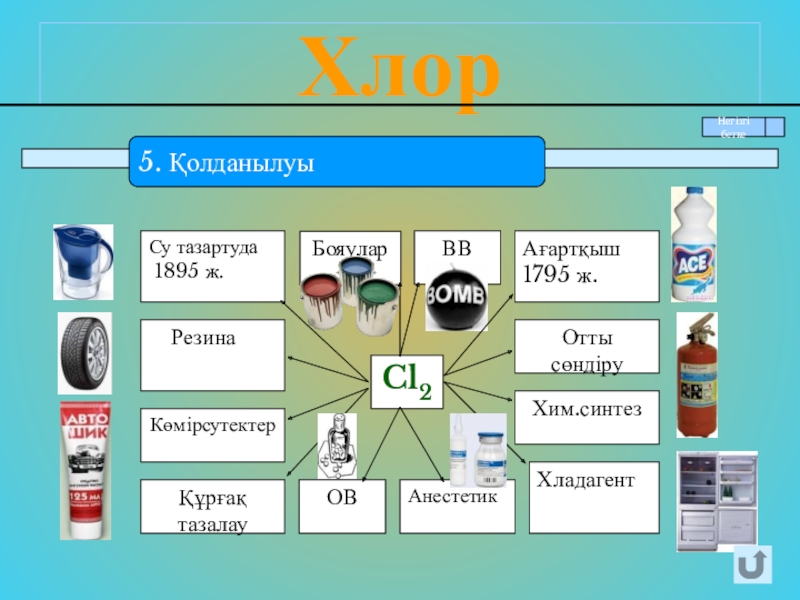
- 12. Хлор5. Қолданылуы
- 13. Хлор6. Білім тексеру БГВопрос 1 БГХлор атомындағы
Слайд 3Химиялық элементтердің Д.И.Менделеев жасаған периодты жүйесі
7
4
5
6
Элементтер топтары
Период
1
2
3
F2
9
19
0
фтор
Слайд 4Химиялық элементтердің Д.И.Менделеев жасаған периодты жүйесі
www.testent.ru
7
4
5
6
Элемент топтары
Период
1
2
3
Cl
+17
35,5
0
К.Шееле
Г.Деви
Слайд 5Химиялық элементтердің Д.И.Менделеев жасаған периодты жүйесі
www.testent.ru
7
4
5
6
Элемент топтары
Период
1
2
3
Br2
35
80
0
бром
Слайд 6Периодическая система химических элементов Д.И.Менделеева
www.testent.ru
7
4
5
6
Элемент топтары
Период
1
2
3
I2
53
127
0
йод
Слайд 7Хлор.
www.testent.ru
1. Электронды құрылысы
2. Физикалық қасиеттері
3 Химиялық қасиеттері
4. Қосылыстары
5. Қолданылуы
6. Білім
Слайд 8Хлор
1. Электронды құрылысы
2
Cl
0
+17
35
8
7
p = 17
e = 17
n = 18
1s2
2s2
2p6
3s2
3p5
1s2
2s2
2p6
3s2
3p5
Энергетикалық деңгейшелерде электрондардың
3d0
Толу реті B=I
Валентті күйі III
Валентті күйі V
Валентті күйі VII
Слайд 9Хлор
2. Физикалық қасиеттері
Жасыл түсті тұншықтырғыш иісі бар
Tºбқ = -100,98 Сº
Tºқай = - 34,6 Сº
≈ 2V Cl2 : 1V H2O ← нашар
Хлорсуы
Н2О
Cl2
Слайд 10Хлор
Тотықтырғыш (C, O2, N2 және тағы кейбіреулерінен өзге.)
1. Жай
5 Cl2 + 2Р = 2РCl5 ( tº, артық Сl2 )
Cl2 + 2Na = 2NaCl (tºбөлме.)
2. Күрделі заттармен: Cl2 + 2HBr = Br2 + 2HCl
(газ күйінде және сұйық)
Cl2 + С2Н4 = C2Н4 Cl2
Cl2 + 2NaOH = NaOCl + NaCl + H2O
Жавель суы
3. Химиялық қасиеттері
Слайд 11Хлор
Изотоптары: 35Cl – 75,77% , 37Cl – 24,23%
Жер қыртысында– 0,017% (массасы бойынша)
Адам денесінде– 0,25%
Минералдар: тұз NaCl, бишофит MgCl2 ∙6H2O
сильвит KCl
карналлит KCl∙ MgCl2 ∙6H2O сильвинит NaCl∙KCl
4. Табиғаттағы қосылыстары
Слайд 13Хлор
6. Білім тексеру
Б
Г
Вопрос 1
Б
Г
Хлор атомындағы
энергетикалық деңгей саны
екі
Төрт
Б
Г
Сұрақ 1
Б
Г
Хлор
электрондардың саны
3
7
Б
Г
Б
Г
Сұрақ 2
Хлор атомындағы нейтрондар
мен электрондардың саны
Сұрақ 3
Хлор атомының химиялық қасиеттері
Сұрақ 4
Хлор атомының Cl2O7
қосылысындағы тотығу дәрежесі
Сұрақ 5