- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электронная природа химических связей в органических соединениях (10 класс)
Содержание
- 1. Презентация по химии на тему Электронная природа химических связей в органических соединениях (10 класс)
- 2. ВведениеВиды химической связиОсновные положения строения атомаВиды орбиталейСигма-связь, пи-связьМетод валентных связейОсновные положение ВС
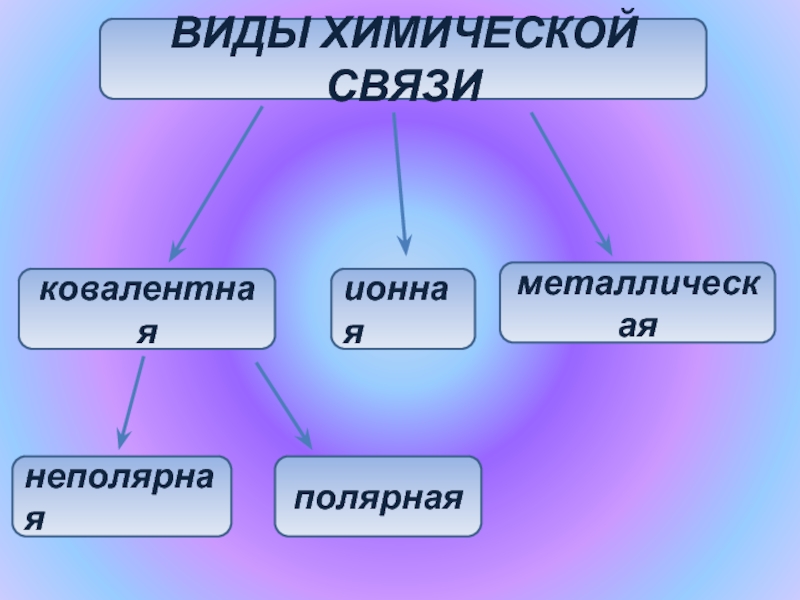
- 3. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИковалентнаяионнаяметаллическаянеполярнаяполярная
- 4. AlNaBaFeMgМеталлическая – в простых веществах-металлах
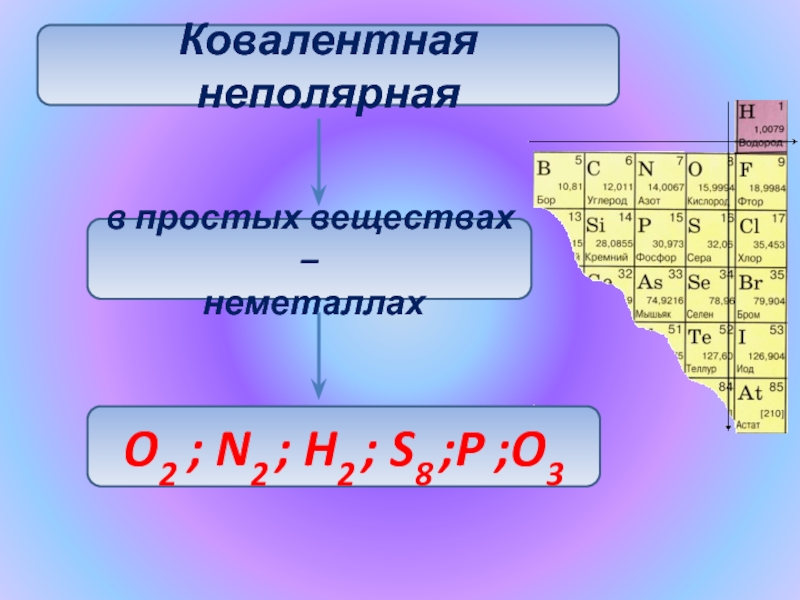
- 5. Ковалентная неполярнаяв простых веществах – неметаллах O2 ; N2 ; H2 ; S8 ;P ;O3
- 6. Ковалентная полярнаяв сложных веществах, состоящих из атомов
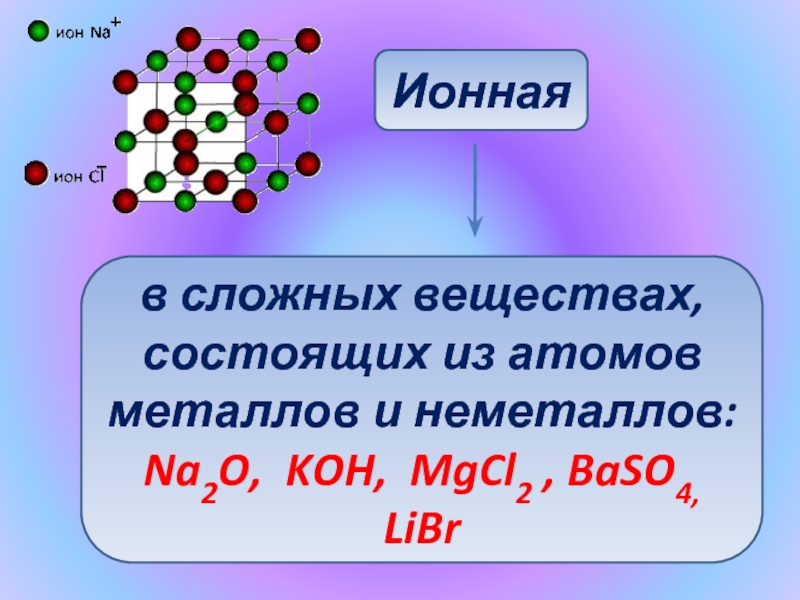
- 7. Ионнаяв сложных веществах, состоящих из атомовметаллов и неметаллов:Na2O, KOH, MgCl2 , BaSO4, LiBr
- 8. Основные положения теории строения атома:Атом состоит из
- 9. Нельзя проследить траекторию движения электрона. Область, в
- 10. Виды орбиталей (по форме):s-орбитальр-орбитальd-орбитальf-орбиталь
- 11. Сначала заполняются орбитали с самой низкой энергией
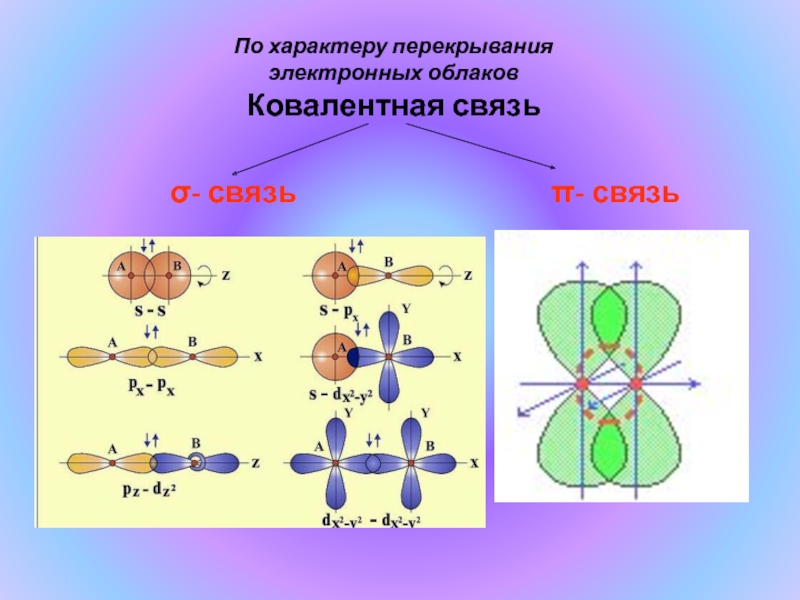
- 12. По характеру перекрыванияэлектронных облаковКовалентная связьσ- связьπ- связь
- 13. Химические связи, образующиеся в результате перекрывания орбиталей
- 14. Метод валентных связей (ВС)Связанные между собой атомы
- 15. Основные положения метода ВСКов. связь образуют два
- 16. Спасибо завнимание
ВведениеВиды химической связиОсновные положения строения атомаВиды орбиталейСигма-связь, пи-связьМетод валентных связейОсновные положение ВС
Слайд 1Электронная природа химических связей в органических соединениях.
МБОУ ”Чулпанская СОШ”
Выполнил:
Тимофеев С.М-ученик
10 класса
Чулпан,2018
Слайд 2Введение
Виды химической связи
Основные положения строения атома
Виды орбиталей
Сигма-связь, пи-связь
Метод валентных связей
Основные положение
ВС
Слайд 6Ковалентная полярная
в сложных веществах, состоящих из атомов разных неметаллов:
НСl , N2O5,
SF6 , H3BO3 , Р2О5
Слайд 7Ионная
в сложных веществах,
состоящих из атомов
металлов и неметаллов:
Na2O, KOH, MgCl2 ,
BaSO4, LiBr
Слайд 8Основные положения теории строения атома:
Атом состоит из положительно заряженного ядра и
отрицательно заряженных электронов.
число электронов = число протонов = =порядковый номер
Электроны находятся на разных энергетических уровнях (ЭУ).
число ЭУ= номер периода
число электронов = число протонов = =порядковый номер
Электроны находятся на разных энергетических уровнях (ЭУ).
число ЭУ= номер периода
Слайд 9Нельзя проследить траекторию движения электрона. Область, в которой нахождение электрона наиболее
вероятно, называют орбиталью.
Орбитали различаются по форме, размерам и энергии.
На одной орбитали – не более 2-х электронов!
Орбитали различаются по форме, размерам и энергии.
На одной орбитали – не более 2-х электронов!
Основные положения теории строения атома:
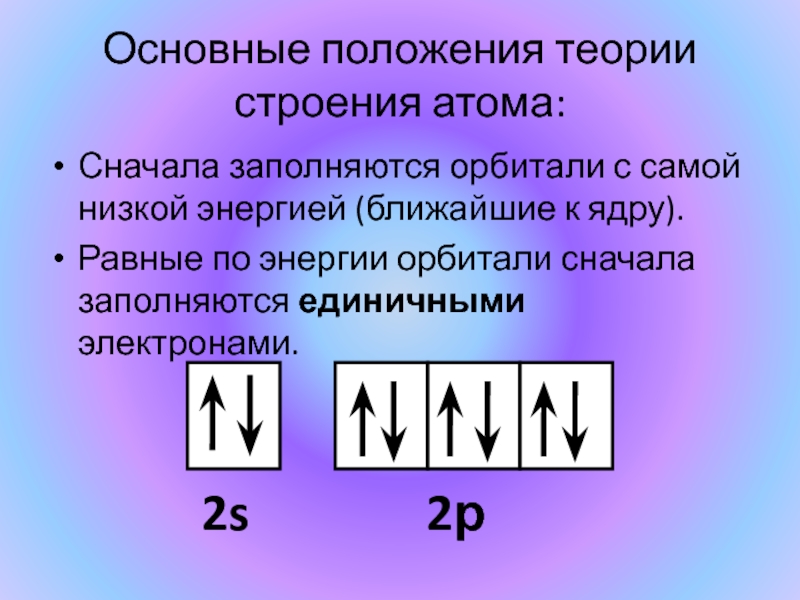
Слайд 11Сначала заполняются орбитали с самой низкой энергией (ближайшие к ядру).
Равные по
энергии орбитали сначала заполняются единичными электронами.
Основные положения теории строения атома:
2s
2р
Слайд 13Химические связи, образующиеся в результате перекрывания орбиталей вдоль линии, соединяющей центры
ядер двух атомов, называют σ-связями.
Химические связи, образующиеся в результате перекрывания орбиталей в двух областях, называют π-связями.
Слайд 14Метод валентных связей (ВС)
Связанные между собой атомы в молекуле удерживаются вместе
при помощи одной или нескольких общих эл-ных пар
Химическая связь между двумя атомами локализована в месте перекрывания атомных орбиталей (локализованная двухцентровая связь)
Научное объяснение гипотезы дано В. Гейтлером и Ф. Лондоном (1927) путем приближенного решения уравнения Шредингера для молекулы водорода
Гипотеза образования ков. связи за счет обобществления эл-нов дана Льюисом
Химическая связь между двумя атомами локализована в месте перекрывания атомных орбиталей (локализованная двухцентровая связь)
Научное объяснение гипотезы дано В. Гейтлером и Ф. Лондоном (1927) путем приближенного решения уравнения Шредингера для молекулы водорода
Гипотеза образования ков. связи за счет обобществления эл-нов дана Льюисом
Слайд 15Основные положения метода ВС
Ков. связь образуют два электрона с противоположными спинами,
принадлежащие двум атомам
При образовании связи происходит перекрывание АО и увеличение электронной плотности между ними, что приводит к уменьшению энергии
Связь реализуется в направлении наибольшего перекрывания АО
При образовании связи происходит перекрывание АО и увеличение электронной плотности между ними, что приводит к уменьшению энергии
Связь реализуется в направлении наибольшего перекрывания АО