- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электролиз (11класс)
Содержание
- 1. Презентация по химии на тему Электролиз (11класс)
- 2. кроссвордЭЛЕКТРОНВЕЛАНТНОСТЬМЕТАЛЛЫКАТИОНЫКАТОДРАСПЛАВТОКЭЛЕКТРОЛИТИОНЗАРЯД
- 3. Электролиз – ОВР, протекающие на электродах при
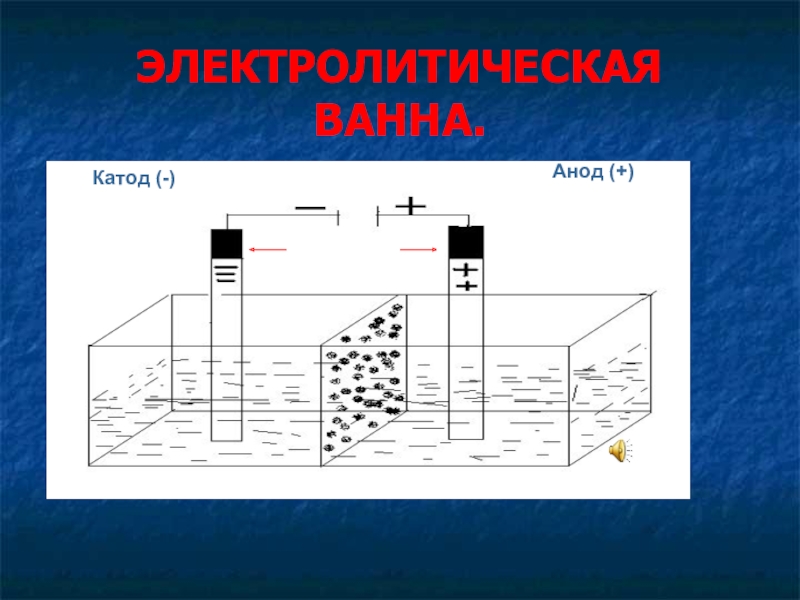
- 4. ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА. Катод (-)Анод (+)ВосстановлениеОкислениеЭлектроды
- 5. АНОДКАТОД
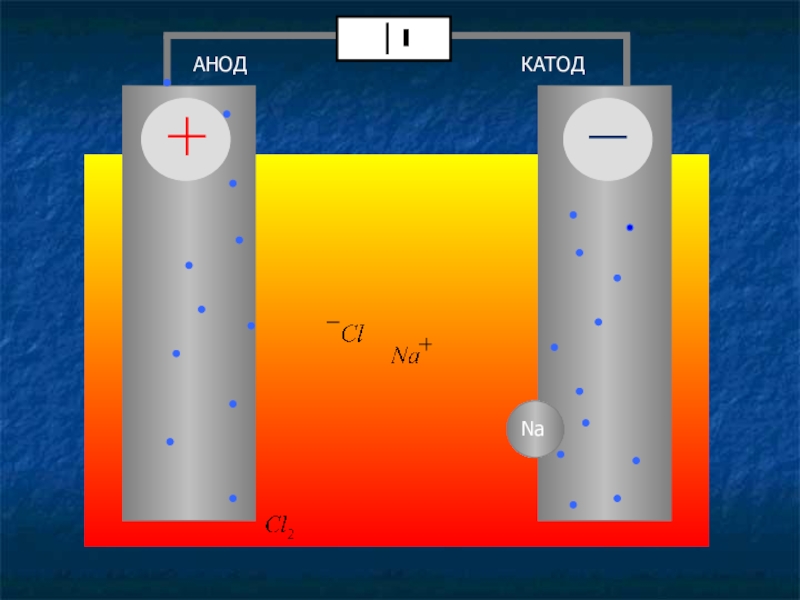
- 6. Электролиз расплава хлорида натрия NaCL
- 7. АНОДКАТОД
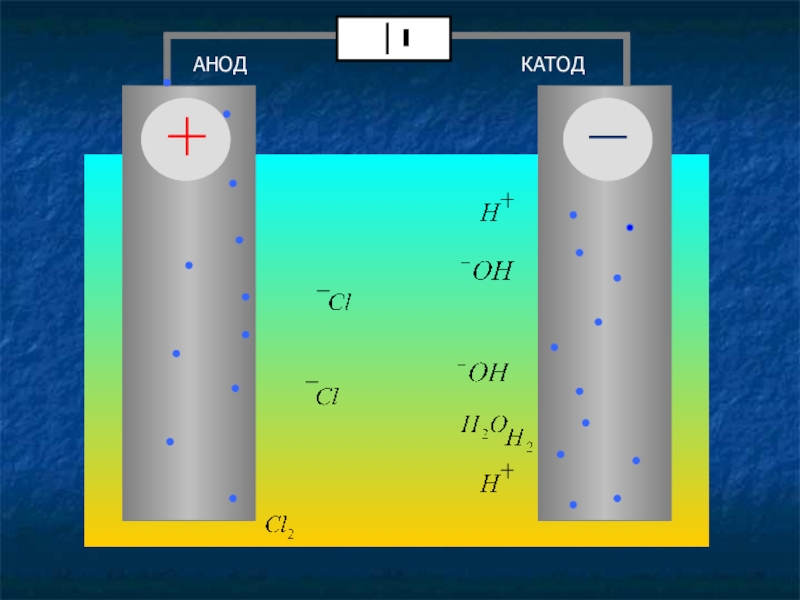
- 8. Электролиз раствора хлорида натрияН2О; Na+ ,
- 9. Процессы на катоде 1.Катионы металлов, стоящих в
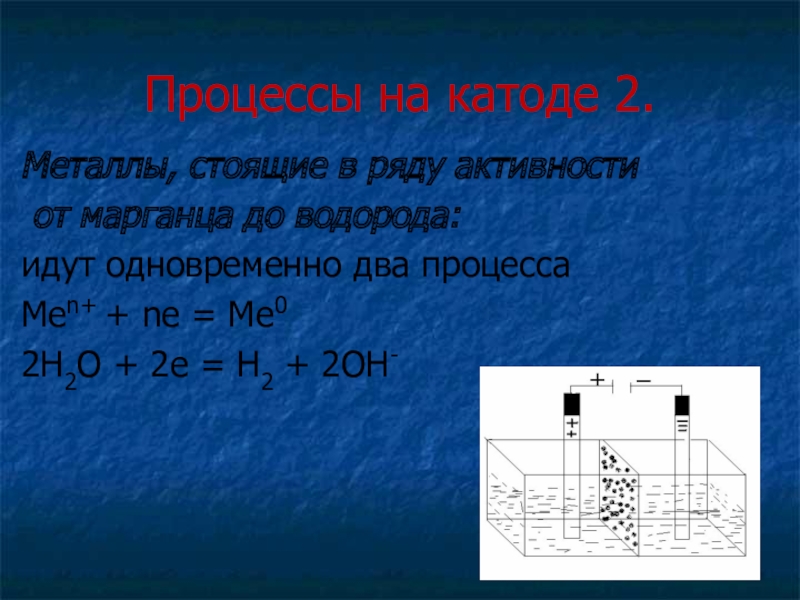
- 10. Процессы на катоде 2.Металлы, стоящие в ряду
- 11. Процессы на катоде 3.Металлы, стоящие в ряду
- 12. Растворимый анодВсегда идет процесс окисления металла анода:Ме – nе = Меn+
- 13. Инертный анод 1. Если кислотный остаток
- 14. Инертный анод 2.Соли оксикислот и фториды:В зависимости
- 15. Применение электролизаПолучение металлов
- 16. Применение электролизаГальваностегия — электролитическоеГальваностегия — электролитическое осаждение
- 17. Применение электролизаГальванопластика — получение сравнительно толстого слоя
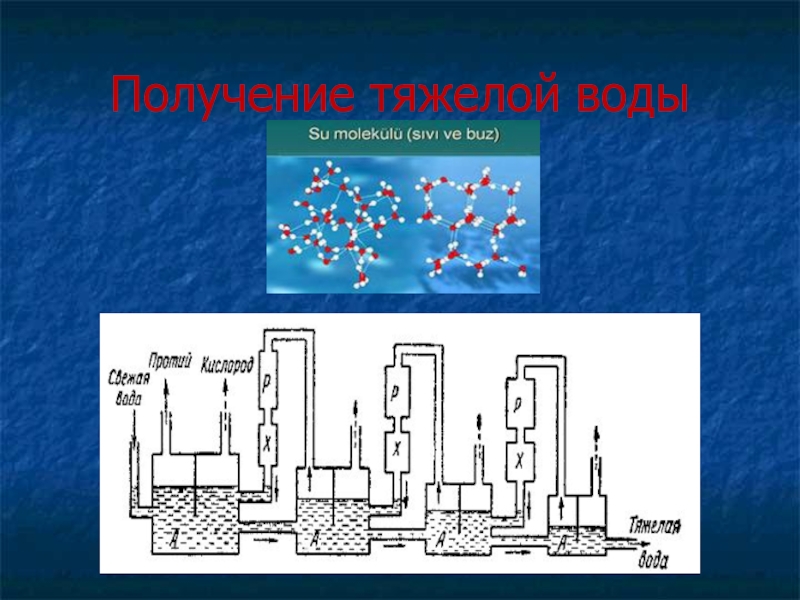
- 18. Получение тяжелой воды
- 19. Тестирование 1. При электролизе раствора гидроксида калия
- 20. Успехов!
кроссвордЭЛЕКТРОНВЕЛАНТНОСТЬМЕТАЛЛЫКАТИОНЫКАТОДРАСПЛАВТОКЭЛЕКТРОЛИТИОНЗАРЯД
Слайд 3Электролиз – ОВР, протекающие на электродах при пропускании через раствор или
расплав электролита постоянного электрического тока
Электрод – система, состоящая из проводника I рода и проводника II рода
Катод (-) - восстановление
Анод (+) - окисление
Электрод – система, состоящая из проводника I рода и проводника II рода
Катод (-) - восстановление
Анод (+) - окисление
Слайд 6Электролиз расплава
хлорида натрия
NaCL
Nа++ Cl-
К (-): Na++ 1e = Na0 - процесс восстановления
А(+): Cl- -1e = CL0
Cl0 + Cl0 = CL2 - процесс окисления
2 NaCL электролиз 2 Na + CL2
К (-): Na++ 1e = Na0 - процесс восстановления
А(+): Cl- -1e = CL0
Cl0 + Cl0 = CL2 - процесс окисления
2 NaCL электролиз 2 Na + CL2
Слайд 8Электролиз раствора
хлорида натрия
Н2О; Na+ , CL-
К (-) Na+; H2O 2H2O + 2е = Н2 + 2ОН-
процесс восстановления
А (+) CL- ; H2O 2CL- - 2е = CL02 - процесс окисления
2NaCL+2Н2О электролиз Н2+CL2+2NaOH
Слайд 9Процессы на катоде 1.
Катионы металлов, стоящих в ряду активности от лития
до алюминия (включительно):
Меn+ не восстанавливаются;
Идет процесс восстановления воды:
2Н2О + 2е = Н2 + 2ОН-
Меn+ не восстанавливаются;
Идет процесс восстановления воды:
2Н2О + 2е = Н2 + 2ОН-
Слайд 10Процессы на катоде 2.
Металлы, стоящие в ряду активности
от марганца до
водорода:
идут одновременно два процесса
Меn+ + ne = Me0
2Н2О + 2е = Н2 + 2ОН-
идут одновременно два процесса
Меn+ + ne = Me0
2Н2О + 2е = Н2 + 2ОН-
Слайд 11Процессы на катоде 3.
Металлы, стоящие в ряду активности после водорода:
идет процесс
восстановления металла
Меn+ + ne = Me0
Меn+ + ne = Me0
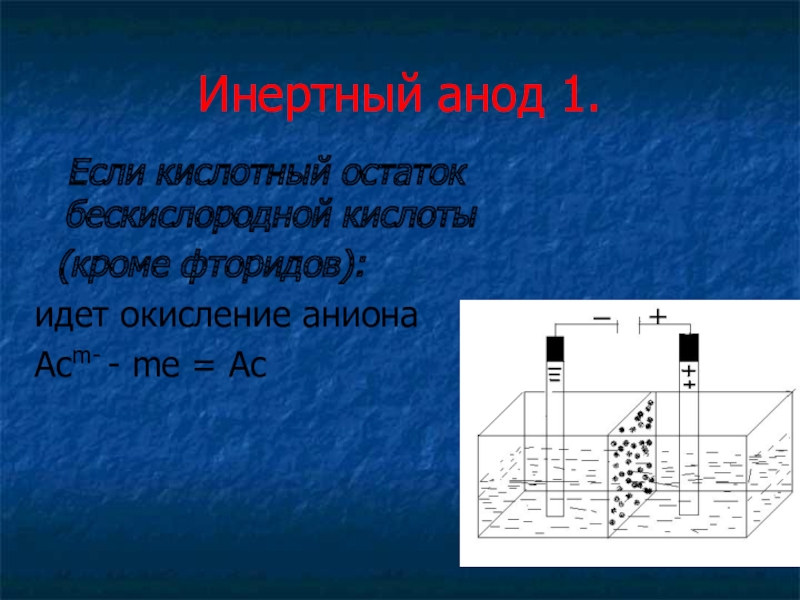
Слайд 13Инертный анод 1.
Если кислотный остаток бескислородной кислоты
(кроме фторидов):
идет
окисление аниона
Acm- - me = Ac
Acm- - me = Ac
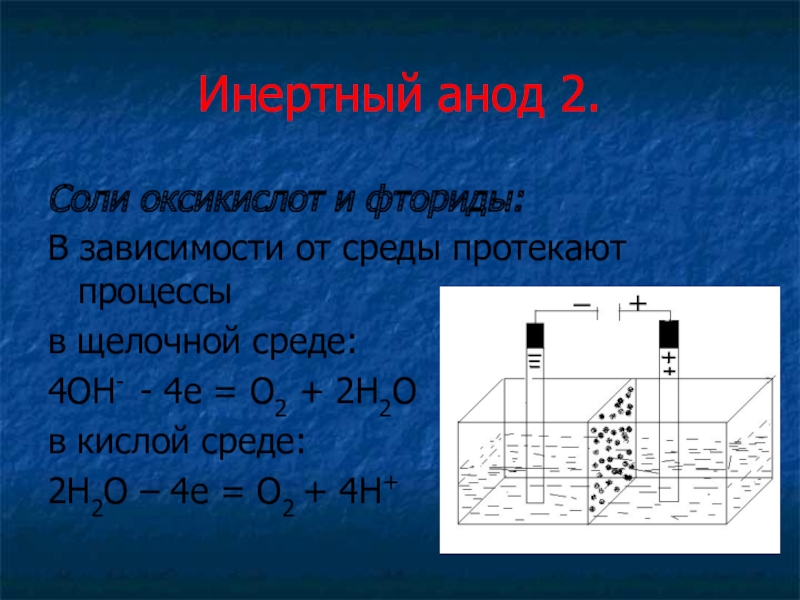
Слайд 14Инертный анод 2.
Соли оксикислот и фториды:
В зависимости от среды протекают процессы
в
щелочной среде:
4ОН- - 4е = О2 + 2Н2О
в кислой среде:
2Н2О – 4е = О2 + 4Н+
4ОН- - 4е = О2 + 2Н2О
в кислой среде:
2Н2О – 4е = О2 + 4Н+
Слайд 16Применение электролиза
Гальваностегия — электролитическоеГальваностегия — электролитическое осаждение тонкого слоя металлаГальваностегия —
электролитическое осаждение тонкого слоя металла на поверхности какого-либо металлического предмета для защиты его от коррозииГальваностегия — электролитическое осаждение тонкого слоя металла на поверхности какого-либо металлического предмета для защиты его от коррозии, повышения износоустойчивости, предохранения от цементации, в декоративных целях и т. д.
Слайд 17Применение электролиза
Гальванопластика — получение сравнительно толстого слоя металлических осадков на поверхности
какого-либо предмета. Целью гальванопластики является получение точной металлической копии предмета.
Слайд 19Тестирование
1. При электролизе раствора гидроксида калия на катоде выделяется:
а) водород;
б) кислород; в) калий.
2. При электролизе раствора сульфата меди(II) в растворе образуется:
а) гидроксид меди(II); б) серная кислота; в) вода.
3. При электролизе раствора хлорида бария на аноде выделяется:
а) водород; б) хлор; в) кислород.
4. При электролизе расплава хлорида алюминия на катоде выделяется:
а) алюминий; б) хлор; в) электролиз невозможен.
5. Электролиз раствора нитрата серебра протекает по следующей схеме:
а) AgNO3 + H2O = Ag + Н2 + HNO3;
б) AgNO3 + H2O = Ag + О2 + HNO3 ;
в) AgNO3 + H2O = AgNO3 + Н2 + О2.
2. При электролизе раствора сульфата меди(II) в растворе образуется:
а) гидроксид меди(II); б) серная кислота; в) вода.
3. При электролизе раствора хлорида бария на аноде выделяется:
а) водород; б) хлор; в) кислород.
4. При электролизе расплава хлорида алюминия на катоде выделяется:
а) алюминий; б) хлор; в) электролиз невозможен.
5. Электролиз раствора нитрата серебра протекает по следующей схеме:
а) AgNO3 + H2O = Ag + Н2 + HNO3;
б) AgNO3 + H2O = Ag + О2 + HNO3 ;
в) AgNO3 + H2O = AgNO3 + Н2 + О2.