Дъячук Л. В.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Атом - сложная частица
Содержание
- 1. Презентация по химии на тему Атом - сложная частица
- 2. Атом – это наименьшая частица вещества, сохраняющаяся
- 3. Совокупность атомов одного вида называют химическим
- 4. Понятие «атом» пришло из античной Греции (в
- 5. Наиболее важные результаты были получены Резерфордом, модель
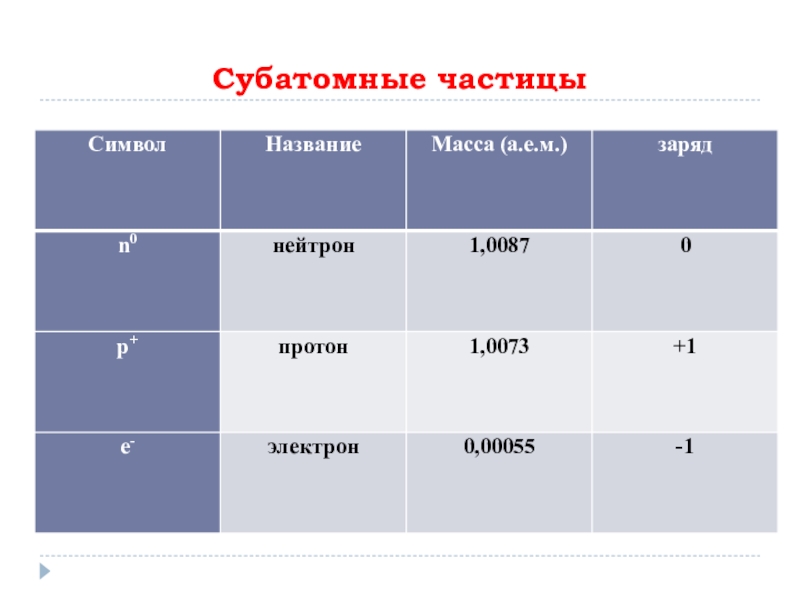
- 6. Субатомные частицы
- 7. Квантовые постулаты Бора 1 постулат:Электрон вращается вокруг
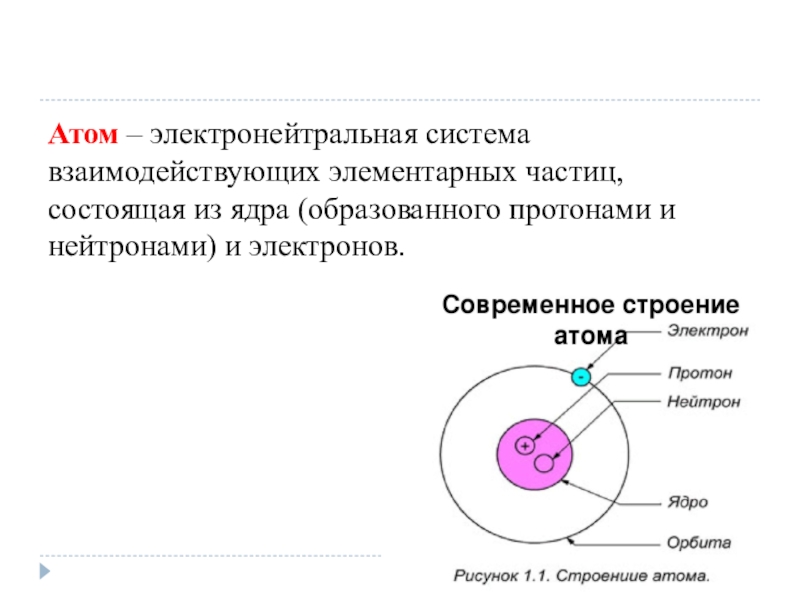
- 8. Атом – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов.
- 9. Химический элемент - это совокупность атомов с
- 10. Массовое число – сумма числа протонов и
- 11. Из-за ничтожно малых размеров электрона и из-за
- 12. Орбиталь- пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона.
- 13. Электроны, обладающие близкими значениями энергии, образуют единый
- 14. Целое число n, обозначающее номер энергетического уровня,
- 15. Главное квантовое число характеризует общий запас энергии
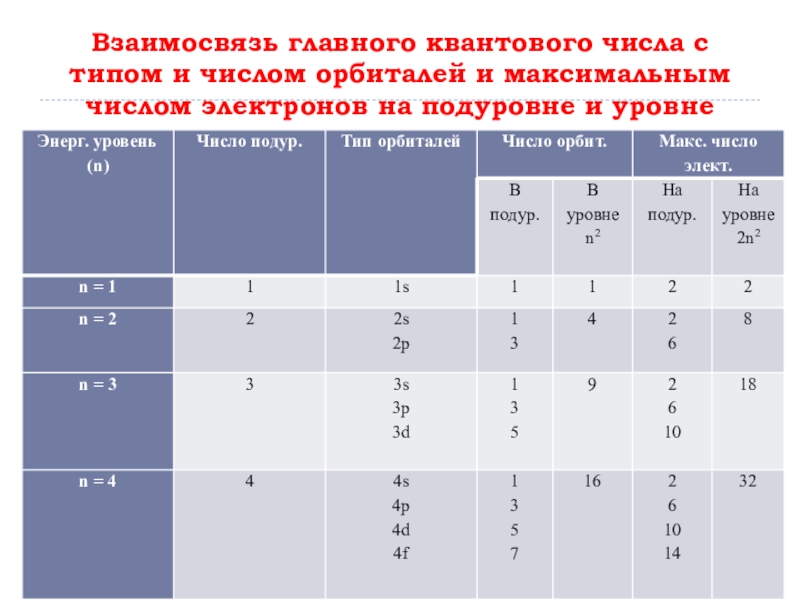
- 16. Взаимосвязь главного квантового числа с типом и
- 17. S – подуровень состоит из одной s
- 18. Ответьте на вопросы!1) Что называют атомом?2) Что
- 19. Выполните задание:Определите число электронов, протонов, нейтронов в атомах следующих химических элементов:алюминия,молибдена, свинца, кислорода.
- 20. Список использованных источников1. Ерохин, Ю.М. Химия [Текст]:
Атом – это наименьшая частица вещества, сохраняющаяся при химических превращениях.Атом чрезвычайно мал (масса от 1,7• 10-24г), но он имеет сложную структуру, состоит из более мелких частиц (субъединиц).
Слайд 1ГАПОУ НСО «Барабинский медицинский колледж»
Атом – сложная частица. Электронные оболочки атомов
Автор:
Слайд 2Атом – это наименьшая частица вещества, сохраняющаяся при химических превращениях.
Атом чрезвычайно
мал (масса от 1,7• 10-24г), но он имеет сложную структуру, состоит из более мелких частиц (субъединиц).
Слайд 3 Совокупность атомов одного вида называют химическим элементом.
Каждый химический элемент имеет
сокращённое обозначение – символ. Символы химических элементов объединены в таблице Менделеева.
Слайд 4Понятие «атом» пришло из античной Греции (в переводе с греческого «атом»
- химически неделимый).
Сложность строения атома доказана фундаментальными открытиями, сделанными в конце 19 века и начале 20 века.
В результате изучения природы катодных лучей (Дж. Томпсон 1897 г.),
открытия радиоактивности химических элементов (А. Беккерель, М. Складовская – Кюри, 1896-1899 гг.),
определение природы альфа-частиц (Резерфорд, 1889-1900гг.),
квантовые постулаты Н. Бора – 1913 г.
Сложность строения атома доказана фундаментальными открытиями, сделанными в конце 19 века и начале 20 века.
В результате изучения природы катодных лучей (Дж. Томпсон 1897 г.),
открытия радиоактивности химических элементов (А. Беккерель, М. Складовская – Кюри, 1896-1899 гг.),
определение природы альфа-частиц (Резерфорд, 1889-1900гг.),
квантовые постулаты Н. Бора – 1913 г.
Слайд 5Наиболее важные результаты были получены Резерфордом, модель атома, предложенная Резерфордом, была
названа планетарной.
Согласно этой теории, атом состоит из положительно заряженного ядра и электронов, вращающегося вокруг ядра по замкнутым орбитам подобно движению планет вокруг Солнца. Ядро, в свою очередь, состоит из субатомных частиц – протонов и нейтронов.
Согласно этой теории, атом состоит из положительно заряженного ядра и электронов, вращающегося вокруг ядра по замкнутым орбитам подобно движению планет вокруг Солнца. Ядро, в свою очередь, состоит из субатомных частиц – протонов и нейтронов.
Слайд 7Квантовые постулаты Бора
1 постулат:
Электрон вращается вокруг ядра по строго определённым,
замкнутым стационарным орбитам в соответствии с «разрешёнными» значениями энергии, при этом энергия не выделяется и не поглощается.
2 постулат:
Электрон переходит их одного «разрешённого» энергетического состояния в другое, что сопровождается излучением или поглощением кванта энергии.
2 постулат:
Электрон переходит их одного «разрешённого» энергетического состояния в другое, что сопровождается излучением или поглощением кванта энергии.
Слайд 8
Атом – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного
протонами и нейтронами) и электронов.
Слайд 9Химический элемент - это совокупность атомов с одинаковым зарядом ядра. В
ПС порядковый номер элемента равен заряду ядра его атома. Атомы, имеющие одинаковое число протонов, но разное число нейтронов, относят к одному и тому же химическому элементу.
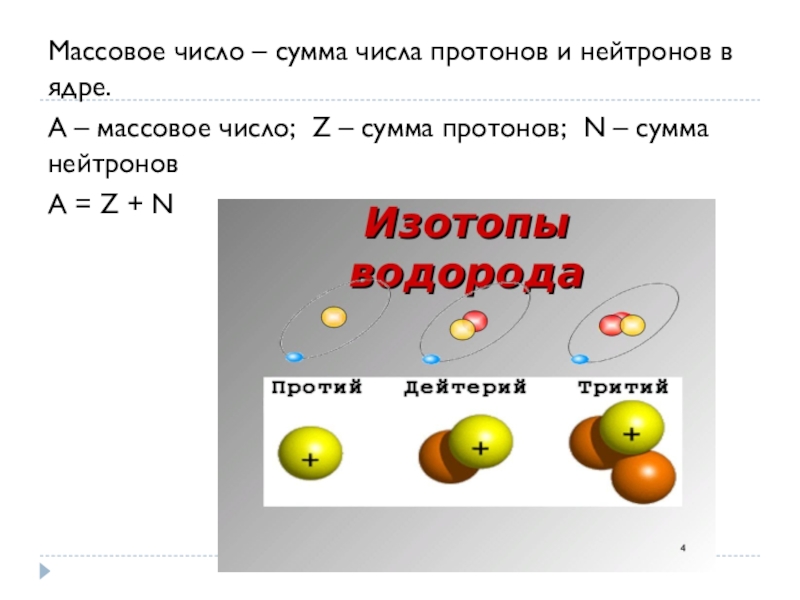
Разновидности одного и того же химического элемента, имеющие одинаковый заряд ядра, но разную атомную массу, называются изотопами.
Разновидности одного и того же химического элемента, имеющие одинаковый заряд ядра, но разную атомную массу, называются изотопами.
Слайд 10Массовое число – сумма числа протонов и нейтронов в ядре.
А –
массовое число; Z – сумма протонов; N – сумма нейтронов
А = Z + N
А = Z + N
Слайд 11Из-за ничтожно малых размеров электрона и из-за того, что он движется
в атоме с громадной скоростью, в каждый отдельный момент времени невозможно точно указать, где и в какой точке пространства около ядра находится эта частица. Однако, при помощи математических методов можно рассчитать, в какой области пространства около ядра наиболее вероятно местонахождение электрона, то есть можно рассчитать его орбиталь.
Слайд 12Орбиталь- пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона.
Слайд 13Электроны, обладающие близкими значениями энергии, образуют единый электронный слой или энергетический
уровень.
Число энергетических уровней в атоме равно номеру периода в ПС, к которому принадлежит химический элемент, у атомов первого периода – один энергетический уровень, второго периода – 2, седьмого – 7.
Число энергетических уровней в атоме равно номеру периода в ПС, к которому принадлежит химический элемент, у атомов первого периода – один энергетический уровень, второго периода – 2, седьмого – 7.
Слайд 14Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом.
Наибольшее
число электронов на энергетическом уровне определяется по формуле:
N = 2n²
N – максимальное число электронов
n – номер уровня или главное квантовое число
На первом уровне может находиться не более 2 электронов, на втором -8, на третьем – 18, на четвёртом – 32.
N = 2n²
N – максимальное число электронов
n – номер уровня или главное квантовое число
На первом уровне может находиться не более 2 электронов, на втором -8, на третьем – 18, на четвёртом – 32.
Слайд 15Главное квантовое число характеризует общий запас энергии электрона, начиная со второго
энергетического уровня, каждый из уровней подразделяется на подуровни.
Первый энергетический уровень имеет один s- подуровень, второй – 2, третий – 3, четвёртый – 4 подуровня, подуровни образованы орбиталями.
Первый энергетический уровень имеет один s- подуровень, второй – 2, третий – 3, четвёртый – 4 подуровня, подуровни образованы орбиталями.
Слайд 16Взаимосвязь главного квантового числа с типом и числом орбиталей и максимальным
числом электронов на подуровне и уровне
Слайд 17S – подуровень состоит из одной s – орбитали; p –
подуровень состоит из трёх p – орбиталей; d – подуровень состоит из 5 d – орбиталей; f – подуровень состоит из 7 f – орбиталей.
Слайд 18Ответьте на вопросы!
1) Что называют атомом?
2) Что называют химическим элементом?
3) Что
такое орбиталь?
4) Что называют главным квантовым числом?
5) По какой формуле рассчитывают максимальное число электронов на данном энергетическом уровне?
4) Что называют главным квантовым числом?
5) По какой формуле рассчитывают максимальное число электронов на данном энергетическом уровне?
Слайд 19Выполните задание:
Определите число электронов, протонов, нейтронов в атомах следующих химических элементов:
алюминия,
молибдена,
свинца,
кислорода.
Слайд 20Список использованных источников
1. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф.
учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с.
2. Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с.
3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с.
4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz
2. Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с.
3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с.
4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz















![Презентация по химии на тему Атом - сложная частица Список использованных источников1. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. Список использованных источников1. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под](/img/thumbs/83ad52c32198ae9a8e66f751048b67aa-800x.jpg)





