- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Алюминий
Содержание
- 1. Презентация по химии на тему Алюминий
- 2. Алюминий ( от лат. Aluminium )- химический периодической системы Д. И. Менделеева
- 3. Алюминий (строение атома)Элемент алюминий расположен в III группе,
- 4. Интересный факт 8,80% массы земной коры составлены
- 5. Интересный факт В 1860-е годы каждая парижская
- 6. История открытия алюминияХ.К.ЭрстедДэвиЧ.М. ХоллДокументально зафиксированное открытие
- 7. Физические свойстваАлюминий – это серебристо-белый металл, Легкий,
- 8. Химические свойстваПри нормальных условиях алюминий покрыт тонкой
- 9. Химические свойствауглеродом (2000 °С)
- 10. Взаимодействие алюминия со сложными веществами Взаимодействие с
- 11. Получение алюминияВпервые получен восстановлением хлорида алюминия металлическим
- 12. Нахождение в природеПо распространенности в земной коре
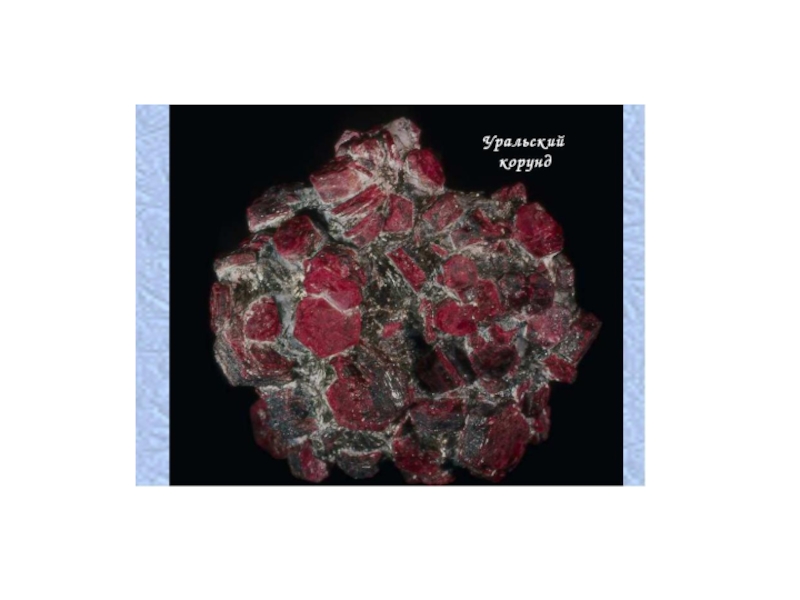
- 13. Корунд
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Прозрачные кристаллы корунда, окрашенные примесями в красный
- 18. Применение алюминияБольшая часть производимого алюминия идет для
- 19. Сплавы алюминия используют в строительстве, т. к.
- 20. Из алюминия делают также:Пено-алюминийПористый алюминийФольгаПудра из алюминия для спекания и получения спеченного алюминиевого порошка (САП)
- 21. Это важно и интересно!!!Гель из гидроксида алюминия
- 22. Домашнее задание п. 16 упр. 4-7
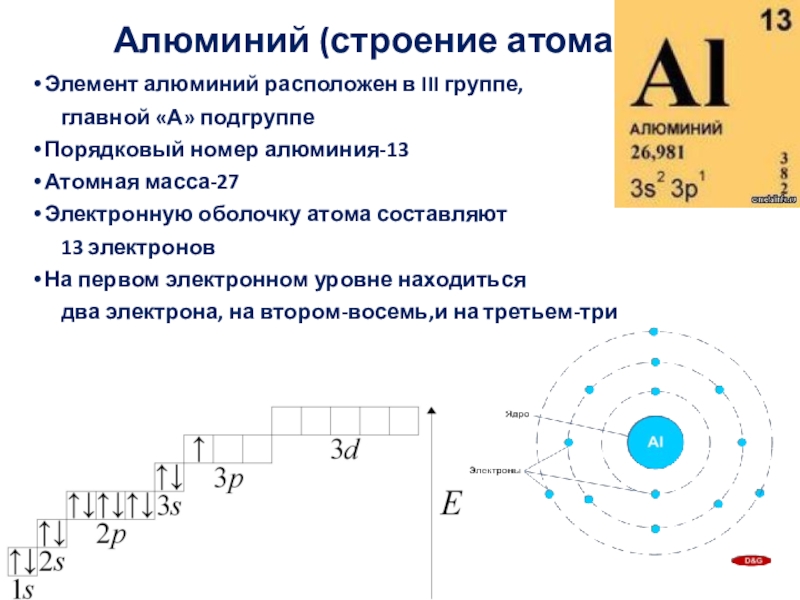
Слайд 3Алюминий (строение атома)
Элемент алюминий расположен в III группе,
главной «А»
Порядковый номер алюминия-13
Атомная масса-27
Электронную оболочку атома составляют
13 электронов
На первом электронном уровне находиться
два электрона, на втором-восемь,и на третьем-три
Слайд 4Интересный факт
8,80% массы земной коры составлены алюминием – третьим по
Каждый 20-й из атомов, слагающих верхнюю оболочку нашей планеты - это атом алюминия.
В теле взрослого человека присутствует до 140 мг алюминия. Суточная потребность взрослого человека в алюминии оценивается в 2,45 мг.
Соединения алюминия встречаются не только на Земле, но и на Луне и Марсе. Алюминий содержится даже в яблоках - до 150 мг/кг.
Самое древнее изделие, содержащее 85% алюминия, датируется III-м веком н.э. По приказу Наполеона III были изготовлены алюминиевые столовые приборы, которые подавались на торжественных обедах императору и самым почётным гостям. Другие гости при этом пользовались приборами из традиционных драгоценных металлов — золота и серебра.
Слайд 5Интересный факт
В 1860-е годы каждая парижская модница непременно должна была
Постепенно из редкой диковинки, некогда ценившейся наравне с драгоценными металлами, алюминий превратился в незаменимый материал строителей, архитекторов, конструкторов, дизайнеров, позволив осуществить многие мечты и замыслы.
При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу.
Мировое производство алюминия постоянно растет. Сейчас оно составляет около 2% от производства стали, если считать по массе. А если по объему, то 5 - 6%, поскольку алюминий почти втрое легче стали. Алюминий уверенно оттеснил на третье и последующие места медь и все другие цветные металлы, стал вторым по важности металлом продолжающегося железного века. По прогнозам, к концу нынешнего столетия доля алюминия в общем выпуске металлов должна достигнуть 4 - 5% по массе.
Слайд 6История открытия
алюминия
Х.К.Эрстед
Дэви
Ч.М. Холл
Документально зафиксированное открытие алюминия произошло в 1825. Впервые
В 1807 году английский химик Хэмфри Дэйви открыл вещество под названием « квасцы », которое представляло собой соль неизвестного металла, этот металл был назван « алюмиум » . Позднее, это название было преобразовано в « алюминий ». Дэйви безуспешно пытался выделить этот металл с помощью электролиза.
Алюминий очень тяжело было отделить от других веществ, это способствовало тому, что он был дороже золота. В 1886 году химиком Ч.М. Холлом был предложен способ, который позволил получать металл в больших количествах. Проводя исследования, он в расплаве криолита AlF3•nNaF растворил оксид алюминия. Полученную смесь поместил в гранитный сосуд и пропустил через расплав постоянный электрический ток. Через некоторое время на дне сосуда он обнаружил бляшки чистого алюминия. Этот способ и в настоящее время является основным для производства алюминия в промышленных масштабах.
Слайд 7Физические свойства
Алюминий – это серебристо-белый металл,
Легкий, плотность – 2,7 г/
tпл = 660 °C,
tкип = 2350 °C
Алюминий обладает высокой электропроводностью, теплопроводностью,
высокой отражающей способностью
мягкий, пластичный
Слайд 8Химические свойства
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому
Взаимодействие с простыми веществами – неметаллами
Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды.
при нагревании он взаимодействует с серой (200 °С)
2Аl + 3S = Аl2S3 (сульфид алюминия)
азотом (800 °С)
2Аl + N2 = 2АlN (нитрид алюминия)
фосфором (500 °С)
Аl + Р = АlР (фосфид алюминия)
Слайд 9Химические свойства
углеродом (2000 °С)
4Аl +
с йодом в присутствии катализатора – воды
2Аl + 3I2 = 2 AlI3 (йодид алюминия)
С бромом
2 Al + 3 Br2 = AlBr3 3 + Q (бромид алюминия)
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4Аl + 3O2 = 2Аl2О3 + 1676 кДж
Слайд 10Взаимодействие алюминия со сложными веществами
Взаимодействие с водой:
Взаимодействие с оксидами металлов:
3 Fe3O4 + 8Al = 4Al2O3 + 9Fe +Q
Взаимодействие с кислотами
2 Al + 3 H2SO4 = Al2(SO4)3 + 3 H2
Взаимодействие алюминия с щелочами
2Al + 2NaOH + 6H2O = 2 Na[Al(OH)4] + 3H2
Взаимодействие алюминия с растворами солей:
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
2Al + 3HgCl2 = 2AlCl3 + 3Hg
Алюминий является сильным восстановителем других металлов из их оксидов (алюминотермия)
2AI + 3Cu2O = AI2O3 + 6Cu
2AI + Fe2O3 = AI2O3 + 2Fe
Слайд 11Получение алюминия
Впервые получен восстановлением хлорида алюминия металлическим калием или натрием без
AlCl3 + 3Na = Al + 3NaCl.
В промышленности – электролиз раствора глинозема Al2O3 в расплаве криолита Na3AlF6 с добавкой CaF2. Криолит используется как растворитель оксида алюминия, а добавка фторида кальция позволяет поддерживать температуру плавления в электролитической ванне не выше 1000 °C.
Слайд 12Нахождение в природе
По распространенности в земной коре алюминий занимает первое место
Соединения алюминия содержат граниты, базальты, глины, полевые шпаты и др. Изредка встречается исключительно твердый (уступает лишь алмазу) минерал корунд – кристаллический оксид Al2O3, часто окрашенный примесями в разные цвета.
В качестве микроэлемента алюминий присутствует в тканях растений и животных. В природе алюминий существует в виде бокситов Al2O3*n ,H2O (с примесями SiO2, Fe2O3, CaCO3), нефелина (Na, K)2O* Al2O3*2 SiO2, криолит Na3(AlF6) .Обладает высокой поляризующей способностью.
Исходя из положения алюминия в электроном ряду напряжений металлов можно сказать, что он обладает химической активностью и поэтому не встречается в природе в свободном состоянии. Алюминий р-элемент, он занимает промежуточное положение между металлами и не металлами. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3.Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
Слайд 17Прозрачные кристаллы корунда, окрашенные примесями в красный цвет называют рубином, а
Рубины и сапфиры в наше время получают искусственным путем в промышленных масштабах
Рубины и сапфиры
Слайд 18Применение алюминия
Большая часть производимого алюминия идет для получения легких сплавов. Дюраль
Слайд 19Сплавы алюминия используют в строительстве, т. к. из них легко изготовить
Слайд 20Из алюминия делают также:
Пено-алюминий
Пористый алюминий
Фольга
Пудра из алюминия для спекания и получения
Слайд 21Это важно и интересно!!!
Гель из гидроксида алюминия входит в состав лекарств
Гидроксид алюминия используется для очистки воды, т. к. обладает способностью поглощать различные вещества.
Оксид алюминия в виде корунда используется как абразивный материал для обработки металлических изделий.
Оксид алюминия в виде рубина широко используется в лазерной технике.
Оксид алюминия применяется в качестве катализатора, для разделения веществ в хроматографии.