- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Алюминий, его свойства и применение
Содержание
- 1. Презентация по химии на тему Алюминий, его свойства и применение
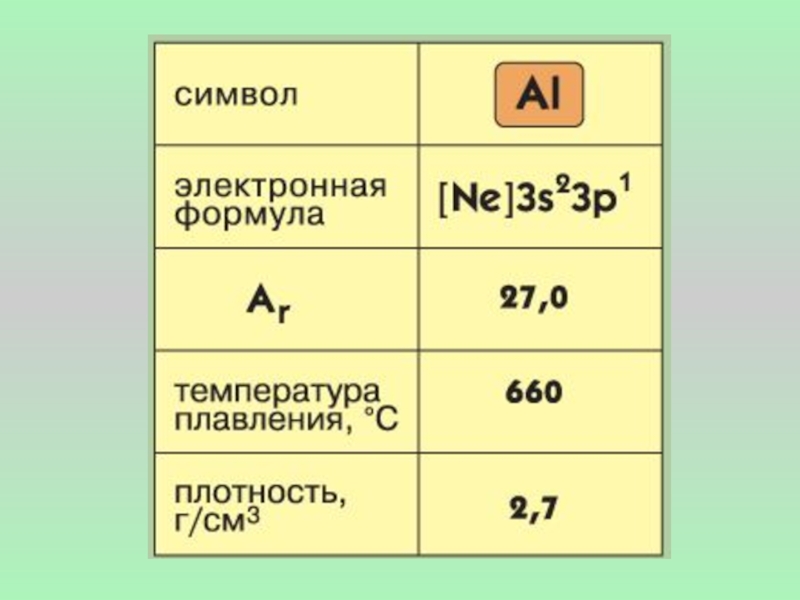
- 2. Алюминий входит в главную подгруппу III
- 3. Слайд 3
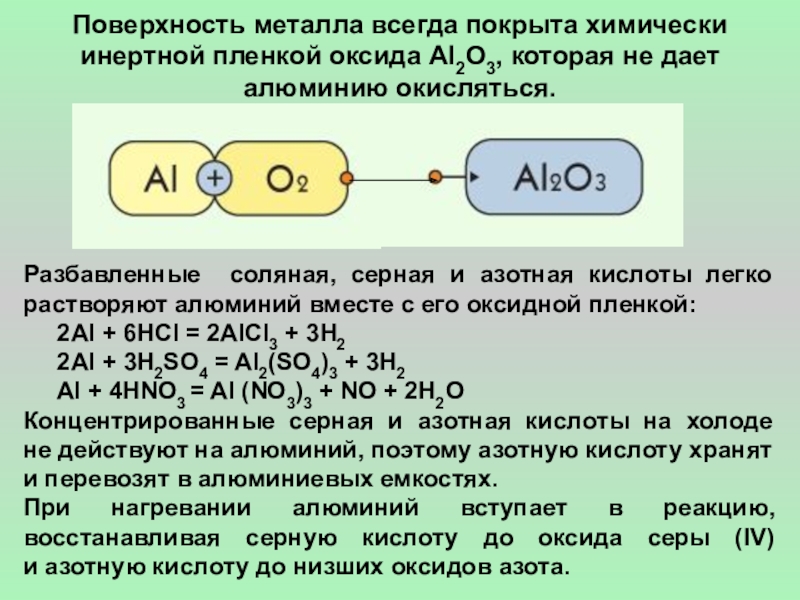
- 4. Поверхность металла всегда покрыта химически инертной пленкой
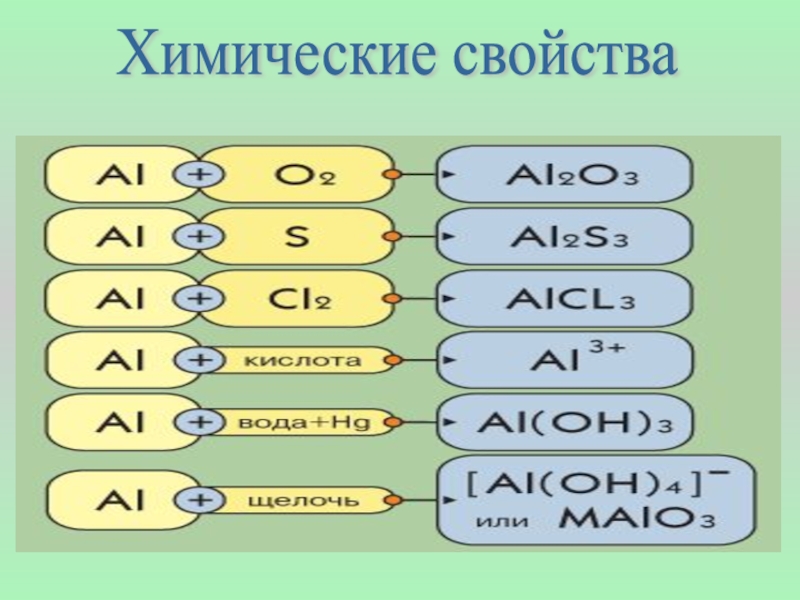
- 5. Химические свойства
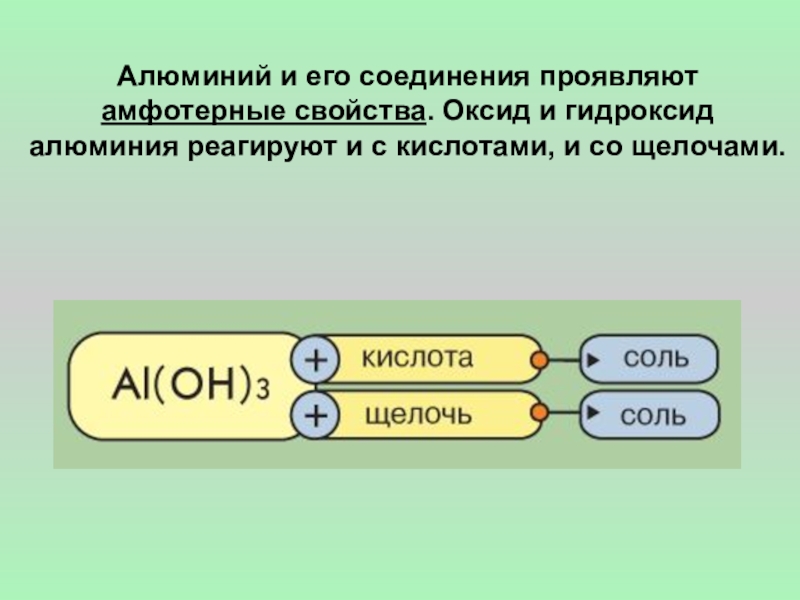
- 6. Алюминий и его соединения проявляют амфотерные свойства.
- 7. При нагревании порошкообразный алюминий сгорает с ослепительной
- 8. При сильном нагревании алюминий реагирует с
- 9. Получают алюминий прокаливанием бокситов Al2O3⋅nН2О, далее расплав
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Соединения алюминияОксид алюминия Al2O3 – это белое,
- 14. Соединения алюминияГидроксид алюминия Al(OH)3 также амфотерен. Его
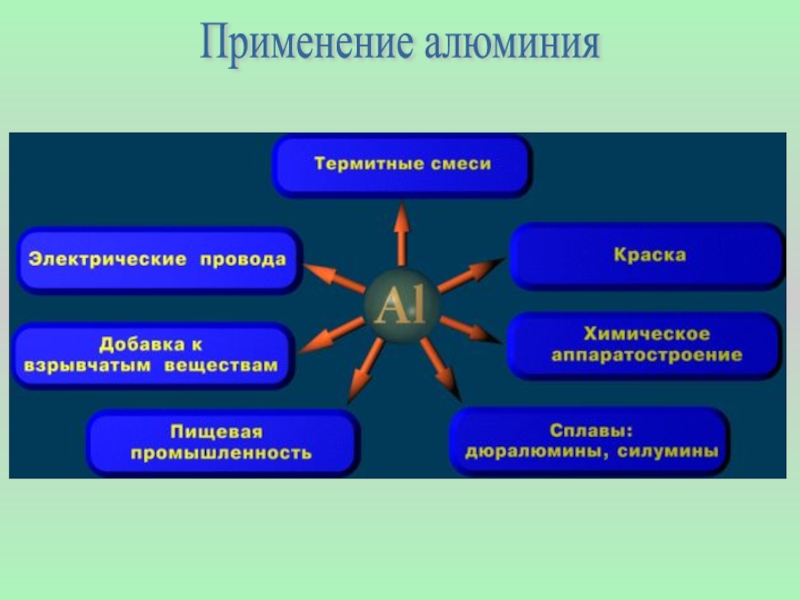
- 15. Применение алюминия
- 16. Алюминий и его сплавы широко применяют как конструкционный материал,
- 17. в том числе при изготовлении транспортных средств
- 18. Алюминий - крылатый металл
- 19. Из алюминия делают линии электропередач, ёмкости, цистерны, «серебряную» краску.
- 20. Конструкционные сплавы в архитектуре городов
Слайд 2 Алюминий входит в главную подгруппу III группы. Встречается только в
Алюминий – очень пластичный металл серебристо-белого цвета. Прекрасно проводит электрический ток и тепло. Алюминий является активным металлом. На внешнем электронном слое у атома алюминия три электрона, отдавая которые, он проявляет восстановительные свойства.
В электрохимическом ряду напряжений алюминий стоит перед железом.
Слайд 4Поверхность металла всегда покрыта химически инертной пленкой оксида Al2O3, которая не
Разбавленные соляная, серная и азотная кислоты легко растворяют алюминий вместе с его оксидной пленкой:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
Al + 4HNO3 = Al (NO3)3 + NO + 2H2O
Концентрированные серная и азотная кислоты на холоде
не действуют на алюминий, поэтому азотную кислоту хранят и перевозят в алюминиевых емкостях.
При нагревании алюминий вступает в реакцию, восстанавливая серную кислоту до оксида серы (IV)
и азотную кислоту до низших оксидов азота.
Слайд 6Алюминий и его соединения проявляют амфотерные свойства. Оксид и гидроксид алюминия
Слайд 7При нагревании порошкообразный алюминий сгорает с ослепительной вспышкой, образуя оксид Al2O3:
В отсутствие оксидной пленки алюминий бурно взаимодействует с водой:
2Al + 6H2O = 2 Al(OH)3 + 3H2
Алюминий соединяется с галогенами – хлором, бромом, йодом, образуя галогениды:
2Al + 3Cl2 = 2AlCl3
Слайд 8 При сильном нагревании алюминий реагирует с серой, углеродом и азотом,
2NaOH + 2Al + 6H2O = 2Na [Al (OH)4] + 3Н2
Алюминий способен отнимать кислород у оксидов многих металлов. Способность алюминия восстанавливать металлы из оксидов при высоких температурах называется алюмотермией и используется в промышленности:
Cr2O3 + 2Al = Al2O3 + 2Cr
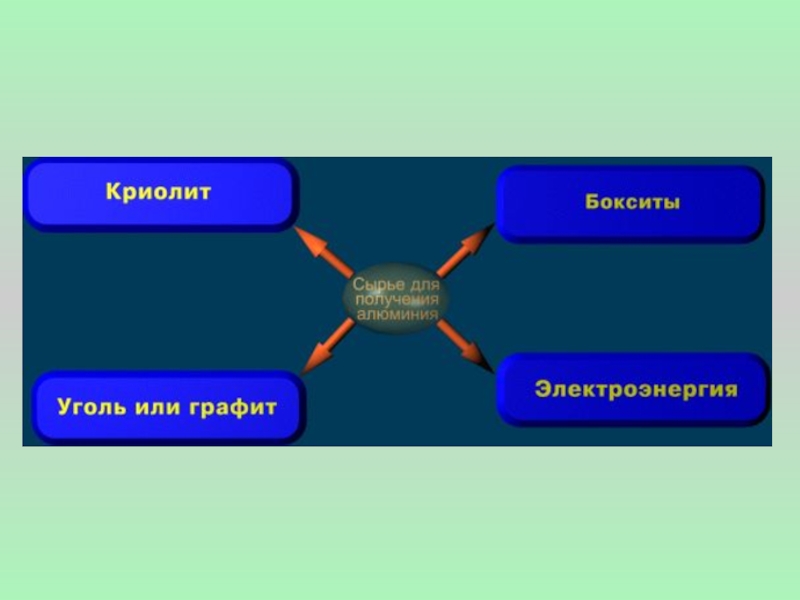
Слайд 9Получают алюминий прокаливанием бокситов Al2O3⋅nН2О, далее расплав Al2O3 подвергают электролизу, добавляя
2Аl2О3 = 4Аl + 3О2
Получение
Слайд 13Соединения алюминия
Оксид алюминия Al2O3 – это белое, очень твердое и тугоплавкое
Al2O3 + 2NaOH + 3H2O = 2Na [Al (OH)4]
Слайд 14Соединения алюминия
Гидроксид алюминия Al(OH)3 также амфотерен. Его получают действием щелочей на
Аl3+ + 3ОН- = Аl(ОН)3
Гидроксид алюминия реагирует с кислотами и со щелочами (кроме раствора гидроксида аммония), хотя и кислотные, и основные свойства выражены у него слабо:
Al(ОН)3 + 3НСl = AlCl3 + 3H2O
Al(OH)3 + NaOH = Na[Al (OH)4]
Водные растворы солей алюминия в сильной степени подвержены гидролизу.