- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Алкены
Содержание
- 1. Презентация по химии на тему: Алкены
- 2. 15.10.14 Строение молекулыCnH2nХимическиесвойстваИзомерияФизическиесвойстваПроверка знанийПолучениеНоменклатураПрименениеАлкены
- 3. Алкены – ациклические углеводороды, в молекуле которых
- 4. 15.10.14δ Строение молекулыsp2-гибридизацияУгол связи – 1200Форма молекулы – плоский треугольникC πC
- 5. 15.10.14НСНоменклатура1. Выбор главной цепи.НН3ССССССН3ННН32. Нумерация атомов главной цепи.НН3ССССССН3ННН3123453. Формирование названия.НН3СССССН3НН34 - метилпентен- 2
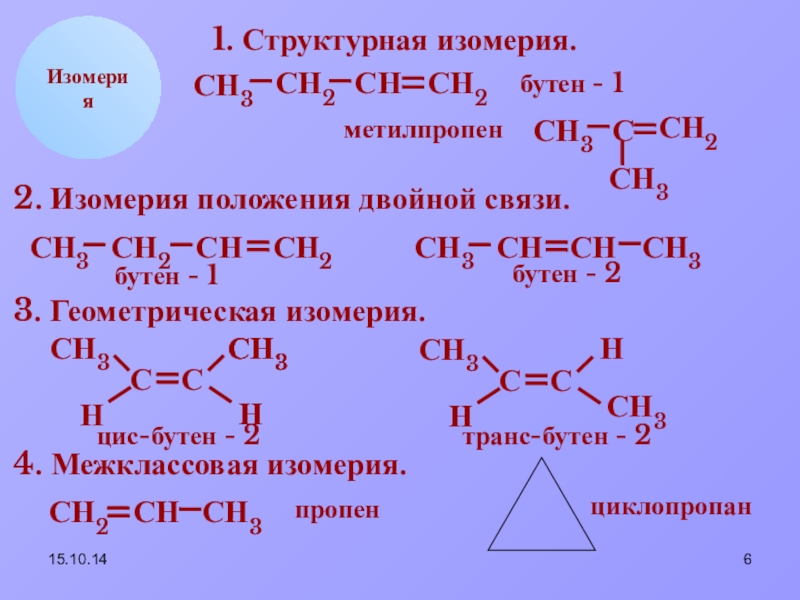
- 6. 15.10.14СН2СНСН3НИзомерия1. Структурная изомерия.СН2СН3ССН2СН3ССН2бутен - 1метилпропен2. Изомерия положения
- 7. 15.10.14ФизическиесвойстваАгрегатное состояние:С2Н4 – С4Н8газообразные вещества;С5Н10 – С18Н36жидкости;с
- 8. 15.10.14Химическиесвойства+ Н2, t0, Ni+ Hal2+ HHal+ H2O,
- 9. 15.10.14СНОН4. Гидратация:Pt, tХимические свойства этилена 1. Гидрирование:
- 10. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИЭто процесс соединения одинаковых молекул в
- 11. 15.10.14BrСН2Получение1. Крекинг нефтепродуктов:С16Н34С8Н18+ С8Н162. Дегидрирование предельных углеводородов:СН3СН2СН2СН3СН2СНСН2СН3+
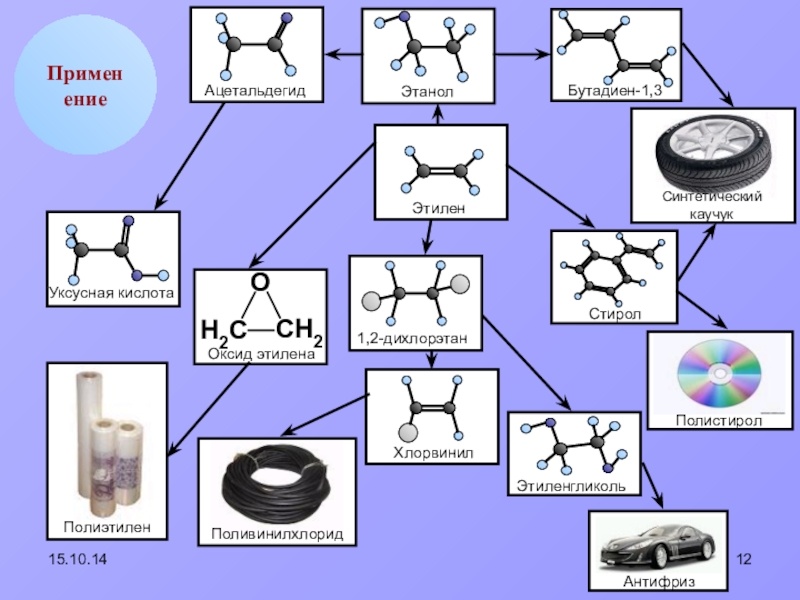
- 12. 15.10.14Применение
- 13. Спасибо за работу на уроке!
Слайд 215.10.14
Строение
молекулы
CnH2n
Химические
свойства
Изомерия
Физические
свойства
Проверка
знаний
Получение
Номенклатура
Применение
Алкены
Слайд 3Алкены – ациклические углеводороды, в молекуле которых кроме одинарных связей содержится
Общая формула: СnH2n
CnH2n
Составить гомологический ряд алкенов
Слайд 415.10.14
δ
Строение
молекулы
sp2-гибридизация
Угол связи – 1200
Форма молекулы – плоский треугольник
C
π
C
Слайд 515.10.14
Н
С
Номенклатура
1. Выбор главной цепи.
Н
Н3
С
С
С
С
С
СН3
Н
Н
Н3
2. Нумерация атомов главной цепи.
Н
Н3
С
С
С
С
С
СН3
Н
Н
Н3
1
2
3
4
5
3. Формирование названия.
Н
Н3
С
С
С
С
СН3
Н
Н3
4 -
пентен
- 2
Слайд 615.10.14
СН2
СН
СН3
Н
Изомерия
1. Структурная изомерия.
СН2
СН3
С
СН2
СН3
С
СН2
бутен - 1
метилпропен
2. Изомерия положения двойной связи.
СН3
СН2
СН
СН3
СН
СН3
бутен - 1
бутен
3. Геометрическая изомерия.
СН3
Н
СН3
Н
С
С
СН3
Н
С
С
цис-бутен - 2
транс-бутен - 2
СН3
Н
4. Межклассовая изомерия.
СН2
СН
СН3
пропен
циклопропан
СН3
Н
Н
Слайд 715.10.14
Физические
свойства
Агрегатное состояние:
С2Н4 – С4Н8
газообразные вещества;
С5Н10 – С18Н36
жидкости;
с С19Н38
твердые вещества
Этилен С2Н4
С увеличением
Tпл = - 169,20С
Tкип = - 103,70С
Плохо в
Н2О
Слайд 815.10.14
Химические
свойства
+ Н2, t0, Ni
+ Hal2
+ HHal
+ H2O, t0, H+
+ H2O +
+ O2, t0 (горение)
- H2, t0, Ni
+ nCnH2n
CnH2n+2
дигалогеналканы, СnH2nHal2
галогеналканы, СnH2n+1Hal
CnH2n+1OH
CnH2n(OH)2
CO2 + H2O
CnH2n-2
полимер
СnH2n
этилен
Слайд 915.10.14
СН
ОН
4. Гидратация:
Pt, t
Химические свойства этилена
1. Гидрирование:
СН2
СН2
+ Н2
СН3
СН3
2. Галогенирование:
СН2
СН2
+ Br2
СН2Вr
СН2Вr
3. Гидрогалогенирование:
СН2
СН2
+ НСl
CН3
СН2Сl
СН2
СН2
+ Н2О
t, Н3РО4
CН3
СН2ОН
5. Мягкое окисление:
СН2
СН2
+ [О] +Н2О
СН2
СН2
ОН
6. Горение:
СН2
СН2
+ 3О2
2СО2
2Н2О
7. Дегидрирование:
СН2
СН2
t, Ni
СН
+ Н2
8. Полимеризация:
nСН2
СН2
cat
( …
СН2
СН2
…)n
главная
Слайд 10РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
Это процесс соединения одинаковых молекул в более крупные.
ПРИМЕР: nCH2=CH2
этилен полиэтилен
(мономер) (полимер)
n – степень полимеризации, показывает число молекул, вступивших в реакцию
-CH2-CH2- структурное звено
Слайд 1115.10.14
Br
СН2
Получение
1. Крекинг нефтепродуктов:
С16Н34
С8Н18
+ С8Н16
2. Дегидрирование предельных углеводородов:
СН3
СН2
СН2
СН3
СН2
СН
СН2
СН3
+ Н2
СН3
СН
СН
СН3
+ Н2
3. Дегидратация спиртов
СН3
СН2
ОН
Н2SО4 , 140 – 1500С
СН2
+ Н2О
4. Дегидрогалогенирование (отщепление галогеноводорода):
СН3
СН2
СН3
+ NaОН
спирт, t
СН
СН3
СН
СН
СН3
+NaBr
+Н2О
5. Дегалогенирование:
СН3
СН
СН3
СН
+Zn
Br
Br
СН3
СН
СН
СН3
+ZnBr2





![Презентация по химии на тему: Алкены 15.10.14Химическиесвойства+ Н2, t0, Ni+ Hal2+ HHal+ H2O, t0, H++ H2O + 15.10.14Химическиесвойства+ Н2, t0, Ni+ Hal2+ HHal+ H2O, t0, H++ H2O + [O]+ O2, t0 (горение)- H2, t0,](/img/thumbs/38ec5e3f4f402907d33324919b30c91c-800x.jpg)