- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему
Содержание
- 1. Презентация по химии на тему
- 2. По мысли английского ученого Р. Бойля, мир
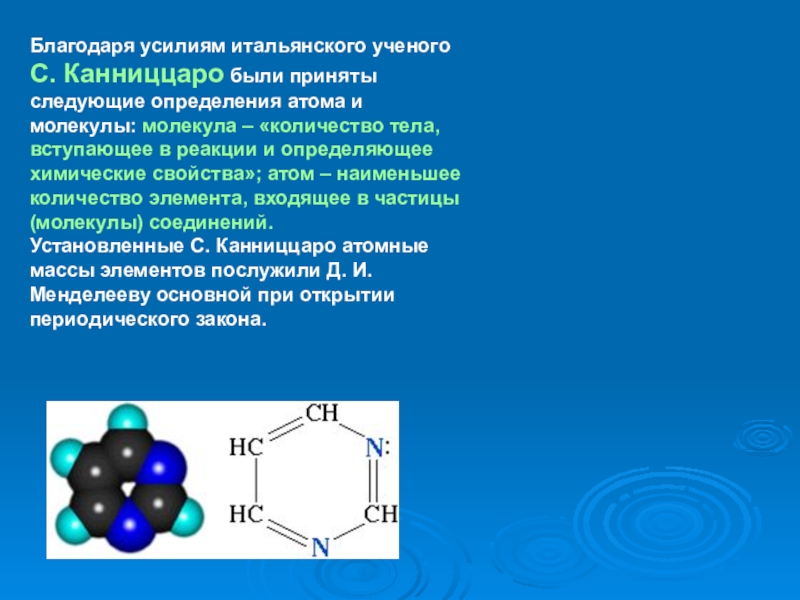
- 3. Благодаря усилиям итальянского ученого С. Канниццаро были
- 4. Ядерная модель строения атома.Положительная заряженная часть атома
- 5. Как было уже сказано раньше, число
- 6. Если различную электронную плотность в отдельных участках,
- 7. Квантовые числа Решение уравнения Шредингера для атома
- 8. Принципы заполнения атомных орбиталей Электроны заполняют орбитали в
- 9. Принцип Паули: сформулирован Вольфгангом Паули в 1924г.
- 10. 2) максимальное число электронов на всех орбиталях
- 11. Правило Клечковского По мере увеличения суммарного числа
- 12. Формулировка правило КлечковскогоЭта энергетическая последовательность легко может
- 13. Атомистическая теория Дальтона Основные постулаты теории Дальтона
- 14. ВыводУчение о строении атома привело к открытию
Слайд 1Строение атома
Первые представления о том, что вещество состоит из отдельных неделимых
Слайд 2По мысли английского ученого Р. Бойля, мир корпускул (молекул), их движение
Слайд 3Благодаря усилиям итальянского ученого С. Канниццаро были приняты следующие определения атома
Установленные С. Канниццаро атомные массы элементов послужили Д. И. Менделееву основной при открытии периодического закона.
Слайд 4Ядерная модель строения атома.
Положительная заряженная часть атома была открыта в 1911
В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Суммарный отрицательный заряд электронов численно равен положительному заряду ядра, так что атом в целом электронейтрален. Так как масса электронов ничтожно мала, то почти вся масса атома сосредоточена в его ядре. Наоборот, размер ядер чрезвычайно мал даже по сравнению с размером самих атомов: диаметр атома - величина порядка 10 см, а диаметр ядра - порядка 10 - 10 см. Отсюда ясно, что на долю ядра и электронов, число которых, как увидим дальше, сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой.
Слайд 5
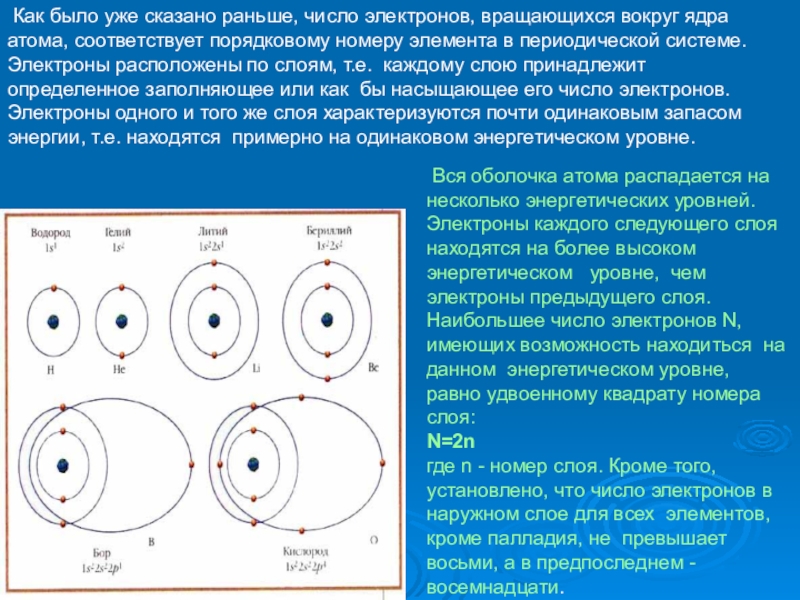
Как было уже сказано раньше, число электронов, вращающихся вокруг
Вся оболочка атома распадается на несколько энергетических уровней. Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, имеющих возможность находиться на данном энергетическом уровне, равно удвоенному квадрату номера слоя:
N=2n
где n - номер слоя. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем - восемнадцати.
Слайд 6Если различную электронную плотность в отдельных участках, например, невозбужденного атома водорода
Электронные орбитали.
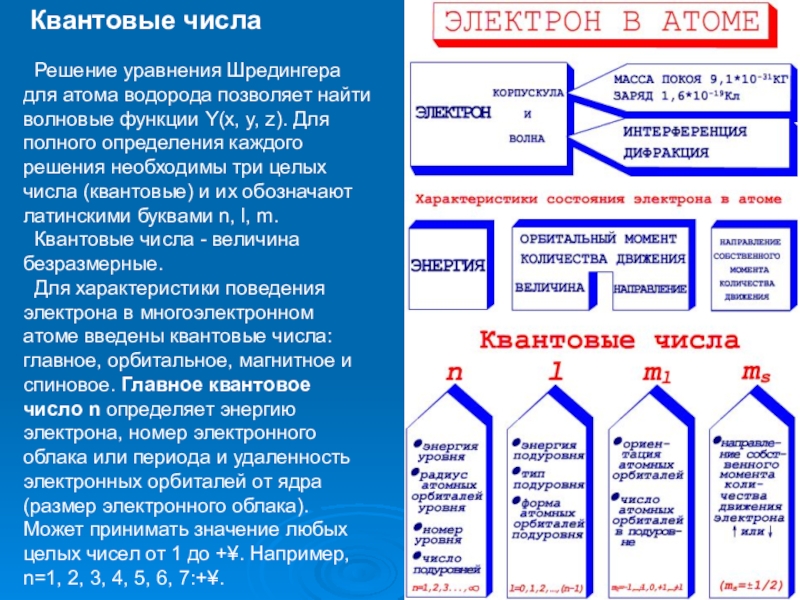
Слайд 7Квантовые числа
Решение уравнения Шредингера для атома водорода позволяет найти волновые
Квантовые числа - величина безразмерные.
Для характеристики поведения электрона в многоэлектронном атоме введены квантовые числа: главное, орбитальное, магнитное и спиновое. Главное квантовое число n определяет энергию электрона, номер электронного облака или периода и удаленность электронных орбиталей от ядра (размер электронного облака). Может принимать значение любых целых чисел от 1 до +¥. Например, n=1, 2, 3, 4, 5, 6, 7:+¥.
Слайд 8Принципы заполнения атомных орбиталей
Электроны заполняют орбитали в порядке увеличения энергии последних:
Энергия электрона в атоме в основном определяется главным n и орбитальным l квантовыми числами, поэтому сначала заполняются те подуровни, для которых сумма n+ l является наименьшей. В 1951 году советский ученый В.М. Клечковский сформулировал (n+l)-правила. Они детализируют принцип наименьшей энергии.
Заполнение подуровней происходит в последовательности увеличения суммы главного и побочного квантовых чисел (n+ l), причем при одинаковом значении суммы (n+ l) заполнение подуровней идет в направлении увеличения n (с меньшим значением n, но большим значением l).
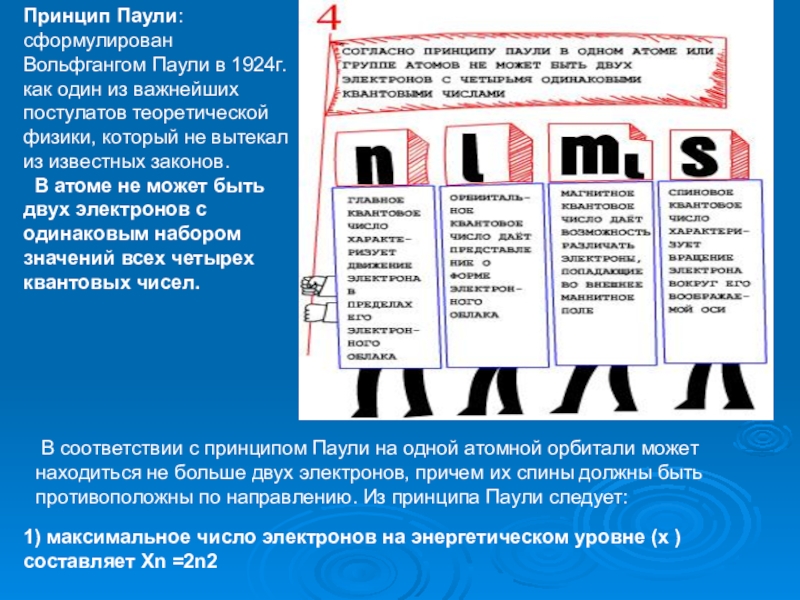
Слайд 9Принцип Паули: сформулирован Вольфгангом Паули в 1924г. как один из важнейших
В атоме не может быть двух электронов с одинаковым набором значений всех четырех квантовых чисел.
В соответствии с принципом Паули на одной атомной орбитали может находиться не больше двух электронов, причем их спины должны быть противоположны по направлению. Из принципа Паули следует:
1) максимальное число электронов на энергетическом уровне (х ) составляет Хn =2n2
Слайд 102) максимальное число электронов на всех орбиталях данного энергетического подуровня (Хl)
В 1927 году Фридрихом Гундом было сформулировано правило:
в невозбужденных атомах электроны в пределах данного подуровня занимают максимальное число свободных орбиталей, при этом суммарное спиновое число максимально.
В целом последовательность заполнения электронами атомных орбиталей подчиняется общему принципу: стремлению системы к минимальной энергии.
Слайд 11Правило Клечковского
По мере увеличения суммарного числа электроновПо мере увеличения суммарного
1s<2s=2p<3s=3p=3d<4s=4p=4d=4f<5s...
Слайд 12Формулировка правило Клечковского
Эта энергетическая последовательность легко может быть описана при помощи
орбитальная энергия последовательно повышается по мере увеличения суммы , причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа . Например, при орбитальные энергии подчиняются последовательности , так как здесь для -орбитали главное квантовое число наименьшее , для -орбитали ; наибольшее , -орбиталь занимает промежуточное положение .
Или же:
При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа и побочного (орбитального) квантового числа , т.е. , имеет меньшее значение.
Слайд 13Атомистическая теория Дальтона
Основные постулаты теории Дальтона заключались в следующем:
1. Каждый элемент
2. Все атомы одного элемента одинаковы.
3. Атомы различных элементов обладают разными свойствами, в том числе имеют разные массы.
4. Атомы одного элемента не превращаются в атомы других элементов в результате химических реакций; атомы не создаются и не разрушаются в химических реакциях.
5. Соединения образуются в результате комбинации атомов двух или нескольких элементов.
6. В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны