- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии к уроку Гидролиз (11класс)
Содержание
- 1. Презентация по химии к уроку Гидролиз (11класс)
- 2. ГИДРОЛИЗСОЛЕЙ
- 3. Классификация солей
- 4. Шпаргалка №11. Гидролиз – обменная реакция с
- 5. Типы гидролиза солей
- 6. ПРОБЛЕМА!Почему при сливании растворов FeCl 3
- 7. Проблема?2FeCl3 + 3Na2CO3=Fe2(CO3)3+6NaCl ???Fe2(CO3)3 + 3H2O= 2Fe(OH)3 +3CO22FeCl3 + 3Na2CO3+3H2O=2Fe(OH)3+3CO2+6NaCl
- 8. Типы гидролиза солей
- 9. Значение гидролизаС древности – зола – моющее
- 10. Справка:1. гидролиз - эндотермический процесс; 2. для смещения химического равновесия используют принцип Ле Шателье!
- 11. Верю-не верюВ чистой воде рН=7.Раствор соляной кислоты
- 12. Проверь себя1 да2.нет3.да4.да5.нет6.да7.да8.нет9.да10.нет
- 13. Объясните, если сможете…Разные почвы могут иметь рН
- 14. Домашнее задание§ 16Для тех, кто будет сдавать
- 15. Закончите предложение:Сегодня я узнал… Урок дал мне для
- 16. Вы можете использовать данное оформление для создания
ГИДРОЛИЗСОЛЕЙ
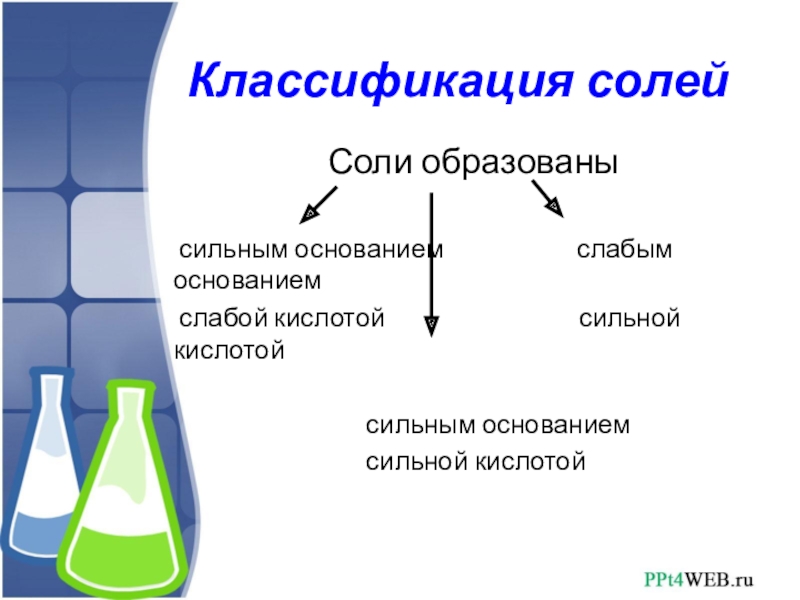
Слайд 3Классификация солей
Соли образованы
сильным основанием слабым основанием
слабой кислотой сильной кислотой
сильным основанием
сильной кислотой
сильным основанием слабым основанием
слабой кислотой сильной кислотой
сильным основанием
сильной кислотой
Слайд 4Шпаргалка №1
1. Гидролиз – обменная реакция с водой!
2. Вода- Н+
ОН- !
3. Кислая среда определяется ионами водорода, а щелочная-гидроксид- ионами!
4. Уравнения гидролиза записывают только для 1-ой ступени.
3. Кислая среда определяется ионами водорода, а щелочная-гидроксид- ионами!
4. Уравнения гидролиза записывают только для 1-ой ступени.
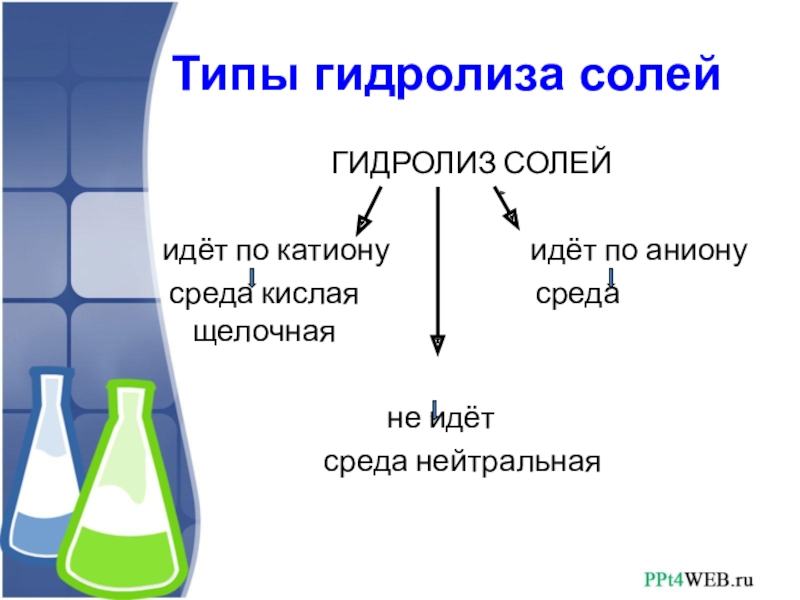
Слайд 5 Типы гидролиза солей
ГИДРОЛИЗ СОЛЕЙ
идёт по катиону идёт по аниону
среда кислая среда щелочная
не идёт
среда нейтральная
идёт по катиону идёт по аниону
среда кислая среда щелочная
не идёт
среда нейтральная
Слайд 7Проблема?
2FeCl3 + 3Na2CO3=Fe2(CO3)3+6NaCl ???
Fe2(CO3)3 + 3H2O= 2Fe(OH)3 +3CO2
2FeCl3 + 3Na2CO3+3H2O=2Fe(OH)3+3CO2+6NaCl
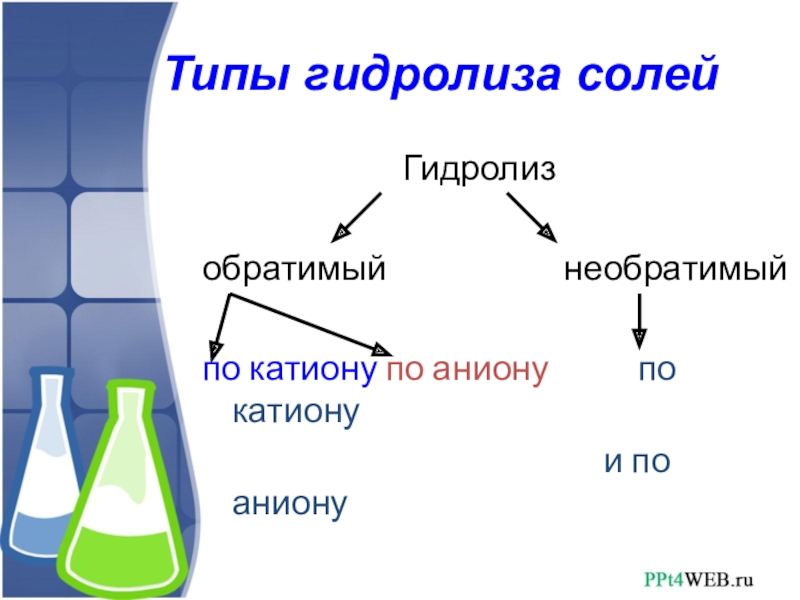
Слайд 8Типы гидролиза солей
Гидролиз
обратимый необратимый
по катиону по аниону по катиону
и по аниону
обратимый необратимый
по катиону по аниону по катиону
и по аниону
Слайд 9Значение гидролиза
С древности – зола – моющее средство (в состав входит
поташ – карбонат калия K2CO3, который гидролизуется по аниону и образует щелочную среду, что обусловливает его мылкость)
Мыло- натриевые и калиевые соли высших карбоновых кислот (стеарат натрия C17H35COONa, стеарат калия C17H35COOК), которые гидролизуются по аниону и образует щелочную среду, что обусловливает мылкость
В стиральные порошки добавляют фосфаты и карбонаты щелочных металлов для усиления щелочной среды
Кислотные почвы известкуют - добавляют Са(ОН)2 или СаСО3, а в щелочные почвы добавляют удобрение – сульфат аммония (NH4)2SO4, чтобы нейтрализовать почву.
В слюне содержатся гидрофосфат-ионы, поэтому в полости рта слабокислотная среда
В составе крови содержатся соли – гидрокарбонат и гидрофосфат натрия, которые поддерживают слабощелочную реакцию среды.
Гидрокарбонат натрия найдется на каждой кухне, это обычная пищевая сода. Ее часто используют для нейтрализации симптомов изжоги – чувства жжения, жара в груди после приема пищи.
Мыло- натриевые и калиевые соли высших карбоновых кислот (стеарат натрия C17H35COONa, стеарат калия C17H35COOК), которые гидролизуются по аниону и образует щелочную среду, что обусловливает мылкость
В стиральные порошки добавляют фосфаты и карбонаты щелочных металлов для усиления щелочной среды
Кислотные почвы известкуют - добавляют Са(ОН)2 или СаСО3, а в щелочные почвы добавляют удобрение – сульфат аммония (NH4)2SO4, чтобы нейтрализовать почву.
В слюне содержатся гидрофосфат-ионы, поэтому в полости рта слабокислотная среда
В составе крови содержатся соли – гидрокарбонат и гидрофосфат натрия, которые поддерживают слабощелочную реакцию среды.
Гидрокарбонат натрия найдется на каждой кухне, это обычная пищевая сода. Ее часто используют для нейтрализации симптомов изжоги – чувства жжения, жара в груди после приема пищи.
Слайд 10Справка:
1. гидролиз - эндотермический процесс;
2. для смещения химического равновесия используют
принцип
Ле Шателье!
Ле Шателье!
Слайд 11Верю-не верю
В чистой воде рН=7.
Раствор соляной кислоты – слабый электролит
Соль Na2CO3
образована сильным основанием и слабой кислотой.
Соль AlCl3 образована слабым основанием и сильной кислотой.
Водный раствор соли NaCl имеет рН<7.
Водный раствор соли K2SO4 имеет рН=7.
Водный раствор соли Al2(SO4)3 имеет рН<7.
Соль KNO3 подвергается необратимому гидролизу с выпадением осадка.
Раствор соли Na2SiO3 при действии фенолфталеина окрасится в малиновый цвет.
Раствор соли K2CO3 при действии фенолфталеина остается бесцветным.
Соль AlCl3 образована слабым основанием и сильной кислотой.
Водный раствор соли NaCl имеет рН<7.
Водный раствор соли K2SO4 имеет рН=7.
Водный раствор соли Al2(SO4)3 имеет рН<7.
Соль KNO3 подвергается необратимому гидролизу с выпадением осадка.
Раствор соли Na2SiO3 при действии фенолфталеина окрасится в малиновый цвет.
Раствор соли K2CO3 при действии фенолфталеина остается бесцветным.
Слайд 13Объясните, если сможете…
Разные почвы могут иметь рН от 4,5 до 10.
По значению рН, в частности, можно судить о содержании в почве питательных веществ, а также о том, какие растения могут успешно расти на данной почве. Например, рост фасоли, салата, черной смородины затрудняется при рН почвы ниже 6,0; капусты – ниже 5,4; яблони – ниже 5,0; картофеля – ниже 4,9.
Какие удобрения необходимо вносить в почву для успешного роста этих растений, если известно, что а)рН почвы 4,5;
б) рН= 8?
Справка! Часто используемые удобрения: NH4 NO3(аммиачная селитра) , Ca(H2PO4)2 (двойной суперфосфат), KNO3 ( калийная селитра) , K2CO3 (поташ, входящий в состав золы) , (NH4)2SO4 ( сульфат аммония)
2 Известно, что шерстяные изделия портятся, истончаются, если стирать их мылом. Почему?
Справка: Мыло- натриевые и калиевые соли высших карбоновых кислот (стеарат натрия C17H35COONa, стеарат калия C17H35COOК)
3. Почему народная медицина предлагает пить раствор питьевой соды ( гидрокарбоната натрия) при изжоге?
Какие удобрения необходимо вносить в почву для успешного роста этих растений, если известно, что а)рН почвы 4,5;
б) рН= 8?
Справка! Часто используемые удобрения: NH4 NO3(аммиачная селитра) , Ca(H2PO4)2 (двойной суперфосфат), KNO3 ( калийная селитра) , K2CO3 (поташ, входящий в состав золы) , (NH4)2SO4 ( сульфат аммония)
2 Известно, что шерстяные изделия портятся, истончаются, если стирать их мылом. Почему?
Справка: Мыло- натриевые и калиевые соли высших карбоновых кислот (стеарат натрия C17H35COONa, стеарат калия C17H35COOК)
3. Почему народная медицина предлагает пить раствор питьевой соды ( гидрокарбоната натрия) при изжоге?
Слайд 14Домашнее задание
§ 16
Для тех, кто будет сдавать ЕГЭ: упр. 3-12
Для физиков-математиков:
упр. 9,11
Для любопытствующих: упр.2,7
Для философов:
ответьте на вопрос:
«Какое значение гидролиз имеет для образования земной коры?»
Для любопытствующих: упр.2,7
Для философов:
ответьте на вопрос:
«Какое значение гидролиз имеет для образования земной коры?»
Слайд 15Закончите предложение:
Сегодня я узнал…
Урок дал мне для жизни…
Было интересно… Я научился…
Было трудно…
У меня получилось …
Я выполнял задания… Я смог…
Я понял, что… Я попробую…
Теперь я могу… Меня удивило…
Я почувствовал, что…
Мне захотелось….
Я выполнял задания… Я смог…
Я понял, что… Я попробую…
Теперь я могу… Меня удивило…
Я почувствовал, что…
Мне захотелось….
Слайд 16Вы можете использовать данное оформление для создания своих презентаций, но в
своей презентации вы должны указать источник шаблона: http://ppt4web.ru
При создание шаблона использованы Google картинки: https://www.google.ru/imghp?hl=ru&tab=wi
Шаблон нельзя использовать в коммерческих целях!
При использование шаблона на других сайтах, ссылка на сервис PPt4WEB.ru обязательна!
При создание шаблона использованы Google картинки: https://www.google.ru/imghp?hl=ru&tab=wi
Шаблон нельзя использовать в коммерческих целях!
При использование шаблона на других сайтах, ссылка на сервис PPt4WEB.ru обязательна!
Источники: