- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Химические свойства карбоновых кислот (10 класс)
Содержание
- 1. Презентация по химии Химические свойства карбоновых кислот (10 класс)
- 2. В ящике находится вещество, которое древними греками
- 3. Мини - разминкаК какому классу кислородосодержащих органических
- 4. ХИМИЧЕСКИЕ СВОЙСТВА И ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ
- 5. Работа в малых группах.Мини - проект«Свойства уксусной
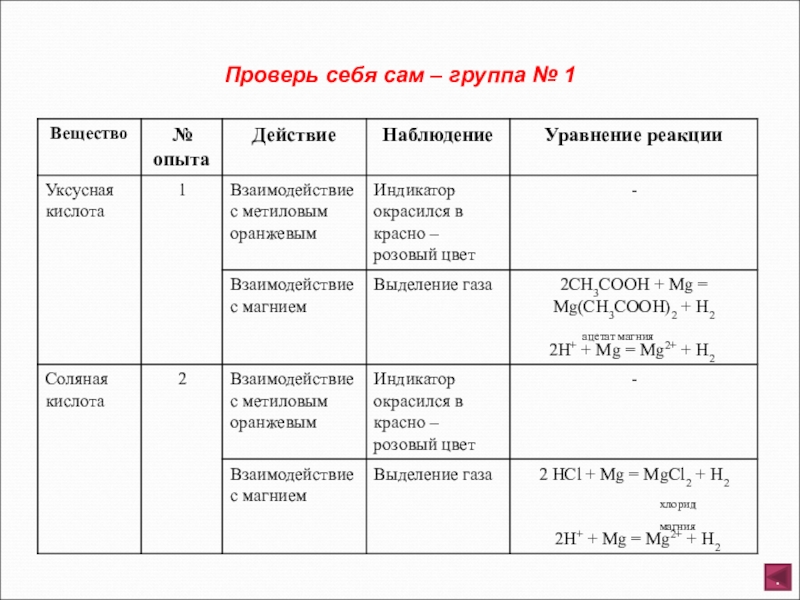
- 6. Группа № 1. Взаимодействие уксусной и соляной
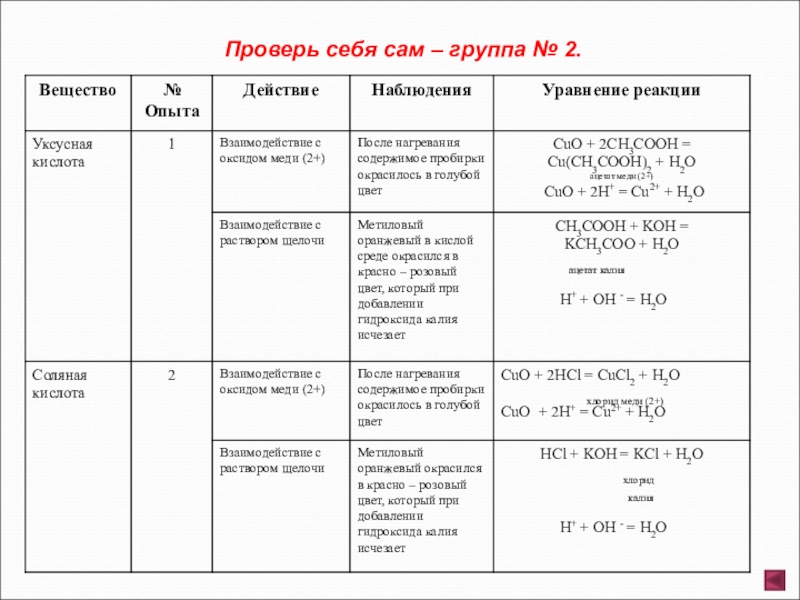
- 7. Группа № 2. Взаимодействие уксусной и соляной
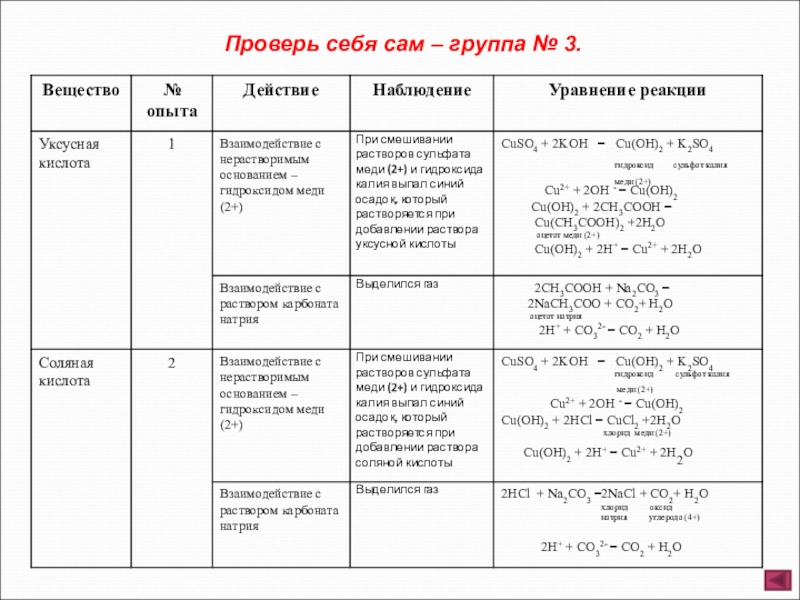
- 8. Группа № 3. Взаимодействие уксусной и соляной
- 9. Проверь себя сам – группа № 1.
- 10. Проверь себя сам – группа № 2.
- 11. Проверь себя сам – группа № 3.
- 12. Итоги лабораторной работыКарбоновые кислоты взаимодействуют с металлами,
- 13. Диссоциация уксусной кислоты с образованием катиона водорода
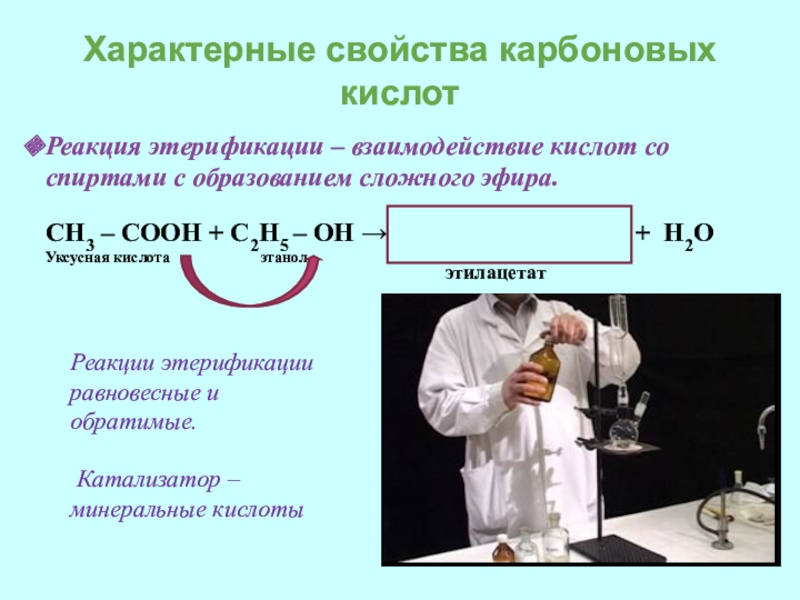
- 14. Характерные свойства карбоновых кислотРеакция этерификации – взаимодействие
- 15. Гидролиз сложного эфира (взаимодействие сложного эфира с
- 16. Реакция замещения – хлорирования.R – CH2 -
- 17. Реакция присоединения по кратной связиГидрирования – присоединение
- 18. Горение уксусной кислотыБезводная уксусная кислота – огнеопасное
- 19. Специфические свойства муравьиной кислоты.Строение муравьиной кислотыРеакция «серебряного зеркала»НСООН + Ag →H2O + CO2 + Ag↓
- 20. Муравьиная кислота легко окисляется перманганатом калия,
- 21. Способы получения карбоновых кислотВ лаборатории карбоновые кислоты
- 22. Тренировка1. Какая функциональная группа определяет принадлежность соединения
- 23. 2. При взаимодействии уксусной кислоты с бутиловым спиртом образуется:А. ЭтилацетатБ. ПропилформиатВ. МетилацетатГ. Бутилацетат
- 24. 3. Раствор уксусной кислоты реагирует с веществами:А. HClБ. COB. Na 2 CO 3Г. Ag
- 25. 4. Соли уксусной кислоты называются:А. ФормиатыБ. ЦитратыВ. ОксалатыГ. Ацетаты
- 26. 5. Определите формулу эфира, образовавшегося в результате
- 27. МОЛОДЦЫ!
- 28. Спасибо за урок !
Слайд 2
В ящике находится вещество, которое древними греками отождествлялось с самим представлением
Это вещество впервые было получено алхимиком Агриколой, который наблюдал при прокаливании янтаря похожий на соль белый налет этого вещества; используется в медицине.
В ящике находится вещество, которым богаты плоды цитрусовых. В мякоти апельсина его около 2 %, в лимоне – 6 %. Впервые было выделено в 1784 году К. Шееле.
Слайд 3Мини - разминка
К какому классу кислородосодержащих органических соединений относятся эти вещества?
Как
Как вы думаете, какие свойства продемонстрированных кислот мы еще не рассматривали?
Как вы думаете, сходны ли по химическим свойствам органические и минеральные кислоты? И почему?
Слайд 5Работа в малых группах.
Мини - проект
«Свойства уксусной кислоты в сравнении со
Работа № 1
Работа № 2
Работа № 3
? ПРИНАДЛЕЖАТ ЛИ КАРБОНОВЫЕ КИСЛОТЫ К КЛАССУ КИСЛОТ?
Слайд 6Группа № 1. Взаимодействие уксусной и соляной кислот с металлами, стоящими в
Опыт 1. В две пробирки налить 2 – 3 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами). В первую пробирку внесите полоску индикатора метилового оранжевого (отметьте цвет индикатора). Во вторую пробирку добавьте порошка магния.
Опыт 2. В две пробирки налейте 2 – 3 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с минеральными кислотами). В первую пробирку добавьте полоску метилового оранжевого (отметьте цвет индикатора). Во вторую пробирку добавьте немного порошка магния.
Отметьте, какие изменения произошли в опытах. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенных реакций. Результатом работы являются наблюдения, оформленные в виде таблицы.
Слайд 7Группа № 2. Взаимодействие уксусной и соляной кислот с оксидами металлов и
Опыт 1. В две пробирки налейте по 2 – 3 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами). В первую пробирку внести немного порошка оксида меди и подогреть. Отметить изменение цвета содержимого. Во вторую пробирку внести полоску метилового оранжевого (отметить изменение цвета индикатора), затем нейтрализуйте кислоту раствором щелочи гидроксида калия.
Опыт 2. В две пробирки налейте 2 – 3 мл раствора соляной кислоты (помните о правилах работы с минеральными кислотами). В первую пробирку добавьте немного порошка оксида меди и слегка подогрейте. Отметьте изменение цвета содержимого пробирки. Во вторую пробирку внесите полоску метилового оранжевого, отметьте изменение цвета индикатора, затем нейтрализуйте кислоту раствором щелочи гидроксида калия.
Отметьте, какие изменения произошли. Сделайте соответствующие выводы. Составьте полные и сокращенные ионные уравнения проведенных реакций. Наблюдения оформите в виде таблицы.
Слайд 8Группа № 3. Взаимодействие уксусной и соляной кислот с солями и нерастворимыми
Опыт 1. Налейте в одну пробирку 2 – 3 мл раствора сульфата меди (2+) и прибавьте 1 – 2 мл раствора гидроксида калия (отметьте, что наблюдаете), затем прилейте немного уксусной кислоты. Во вторую пробирку налейте 1 – 2 мл уксусной кислоты, затем добавьте раствор карбоната натрия.
Опыт 2. Налейте в одну пробирку 2 – 3 мл раствора сульфата меди (2+) и прибавьте 1 – 2 мл раствора гидроксида калия (отметьте, что наблюдаете), затем прилейте немного соляной кислоты. Во вторую пробирку налейте 1 – 2 мл соляной кислоты, затем добавьте раствор карбоната натрия.
Отметьте, какие изменения произошли в опытах. Сделайте соответствующие выводы. Составьте полные и сокращенные ионные уравнения проведенных реакций. Наблюдения оформите в виде таблицы.
Слайд 12Итоги лабораторной работы
Карбоновые кислоты взаимодействуют с металлами, стоящими в ряду активности
Карбоновые кислоты взаимодействуют с оксидами металлов и основаниями
Карбоновые кислоты взаимодействуют с солями и нерастворимыми основаниями
Карбоновые кислоты принадлежат классу кислот.
Слайд 13Диссоциация уксусной кислоты с образованием катиона водорода и аниона кислотного остатка
Н
Уксусная кислота – слабый электролит
Слайд 14Характерные свойства карбоновых кислот
Реакция этерификации – взаимодействие кислот со спиртами с
СН3 – СООН + С2H5 – ОН → CH3 – COO – C2H5 + H2O
Уксусная кислота этанол
Реакции этерификации равновесные и обратимые.
Катализатор – минеральные кислоты
этилацетат
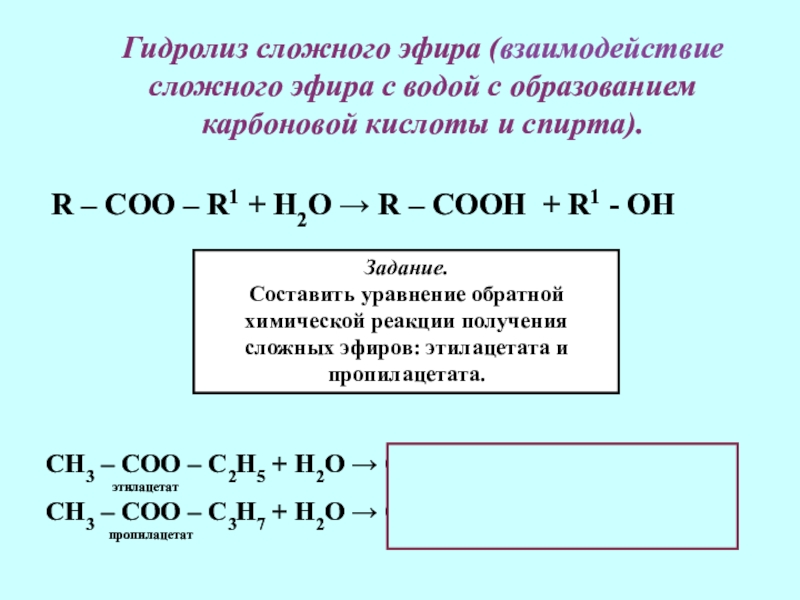
Слайд 15Гидролиз сложного эфира (взаимодействие сложного эфира с водой с образованием карбоновой
R – COO – R1 + H2O → R – COOH + R1 - OH
Задание.
Составить уравнение обратной химической реакции получения сложных эфиров: этилацетата и пропилацетата.
СН3 – СОО – С2Н5 + Н2О → СН3 – СООH + С2Н5 - OH
этилацетат уксусная кислота этанол
СН3 – СОО – С3Н7 + Н2О → СН3 – СООH + С3Н7 - OH
пропилацетат уксусная кислота пропанол
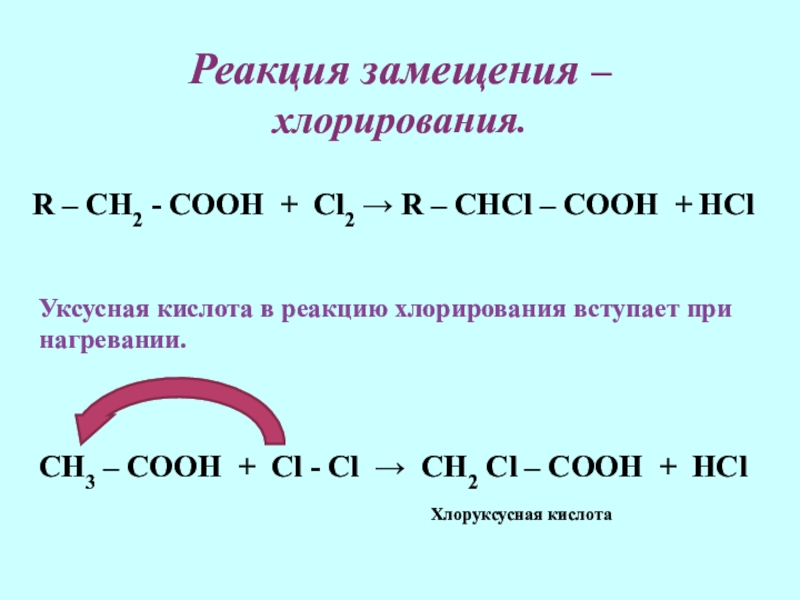
Слайд 16Реакция замещения – хлорирования.
R – CH2 - COOH + Cl2 →
Уксусная кислота в реакцию хлорирования вступает при нагревании.
СН3 – СООН + Cl - Cl → CH2 Cl – COOH + HCl
Хлоруксусная кислота
Слайд 17Реакция присоединения
по кратной связи
Гидрирования – присоединение водорода
С17Н33 – СООН +
олеиновая кислота стеариновая кислота
Галогенирования – присоединение брома
Задание.
Cоставить уравнение аналогичной химической реакции соединения акриловой кислоты с бромом.
СН2 = СН – СООН + Br2 →
акриловая кислота
CH2Br – CHBr – COOH
2,3 дибромпропановая кислота
Непредельные карбоновые кислоты вступают в реакции присоединения.
Слайд 18Горение уксусной кислоты
Безводная уксусная кислота – огнеопасное вещество. При поднесении горящей
СН3 – СООН + 2О2 → 2 Н2О + 2СО2
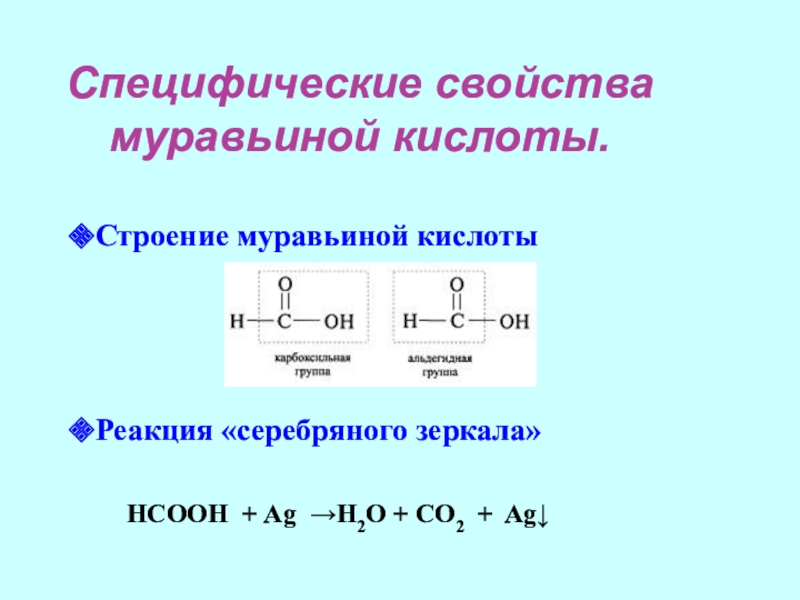
Слайд 19Специфические свойства муравьиной кислоты.
Строение муравьиной кислоты
Реакция «серебряного зеркала»
НСООН + Ag →H2O
Слайд 20Муравьиная кислота легко окисляется перманганатом
калия, а при нагревании разлагается
Н
Катализатор – серная кислота
Слайд 21Способы получения карбоновых кислот
В лаборатории карбоновые кислоты получают вытеснением кислот из
R – COO Na + H2SO4 → R – COOH + NaHSO4
В промышленности карбоновые кислоты получают окислением спиртов, альдегидов, углеводородов.
С2Н5 – ОН + О2 → СН3 – СООН + Н2О
Слайд 22Тренировка
1. Какая функциональная группа определяет принадлежность соединения к классу кислот?
А. -
Б. - СООН
В. - СОН
Г. - С = О
Слайд 232. При взаимодействии уксусной кислоты с бутиловым спиртом образуется:
А. Этилацетат
Б. Пропилформиат
В.
Г. Бутилацетат
Слайд 26
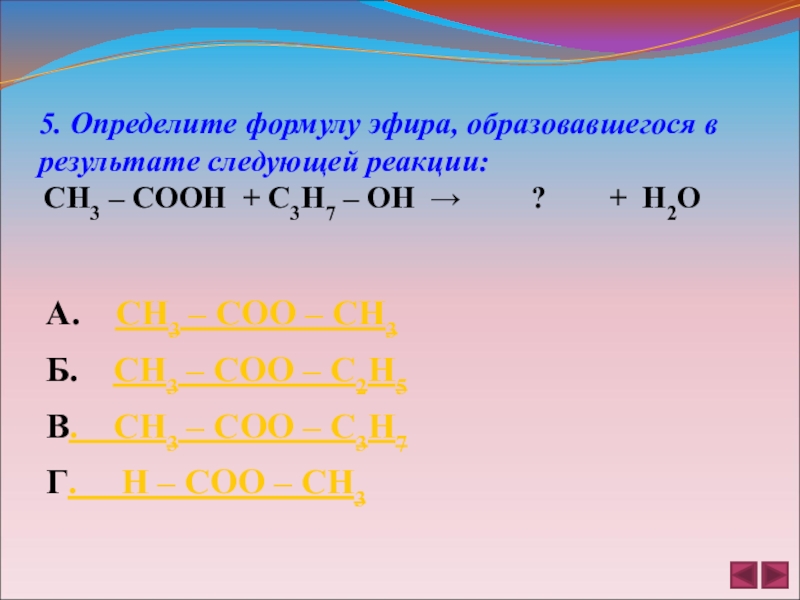
5. Определите формулу эфира, образовавшегося в результате следующей реакции:
СН3
А. СН3 – СОО – СН3
Б. СН3 – СОО – С2Н5
В. СН3 – СОО – С3Н7
Г. Н – СОО – СН3