- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Химическая связь. Ионная химическая связь (11 кл., профильный уровень)
Содержание
- 1. Презентация по химии Химическая связь. Ионная химическая связь (11 кл., профильный уровень)
- 2. Ионная химическая связь11 класс базовый уровень
- 3. Понятие химической связиЧто такое химическая связь?Каковы причины
- 4. Типы химической связихимическая связьионнаяковалентнаяметаллическаяводороднаяХимическими связями обусловлены: строение,
- 5. имеет электрический характер, т.к. образуется валентными ē;
- 6. Электроотрицательность– способность атомов одних химических элементов притягивать электроны в соединениях от атомов других химических элементов
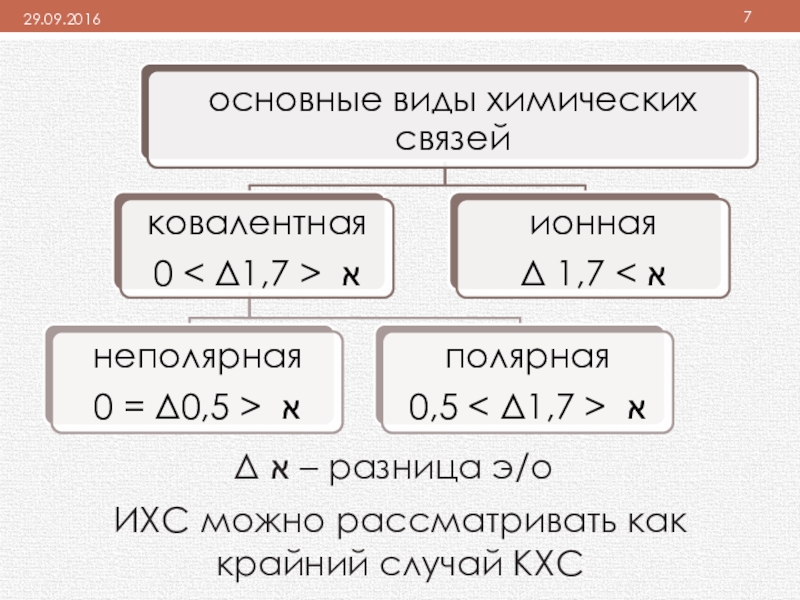
- 7. Δ א – разница э/оИХС можно рассматривать как крайний случай КХС
- 8. Механизм образования ИХСNa0 – 1ē → Na+1F0
- 9. Ионная химическая связь (ИХС)это связь между ионами;ионы-
- 10. только между некоторыми Ме и неМе; характерна
- 11. Свойства ионной связиненасыщаемостьненаправленностькаждый ион может притягивать любое
- 12. Для веществ с ИХСхарактерна ионная кристаллическая решетка;прочность
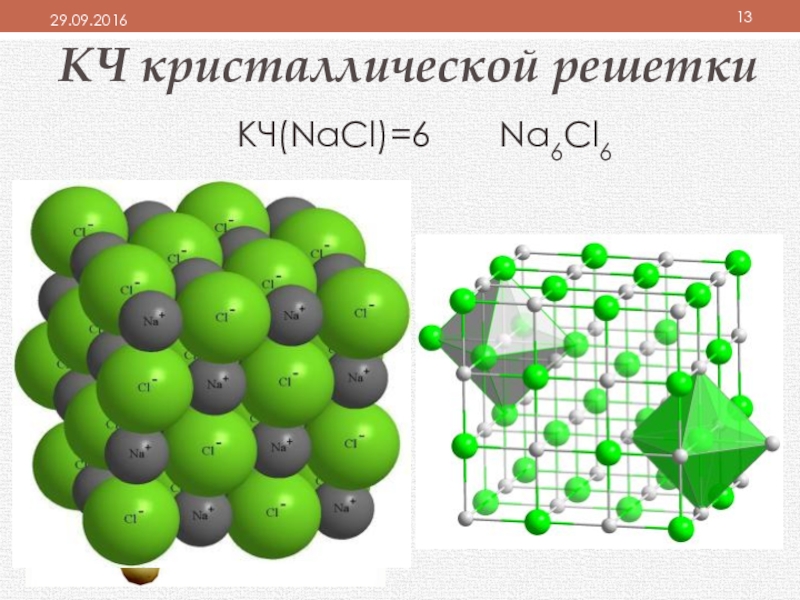
- 13. КЧ кристаллической решеткиКЧ(NaCl)=6 Na6Cl6
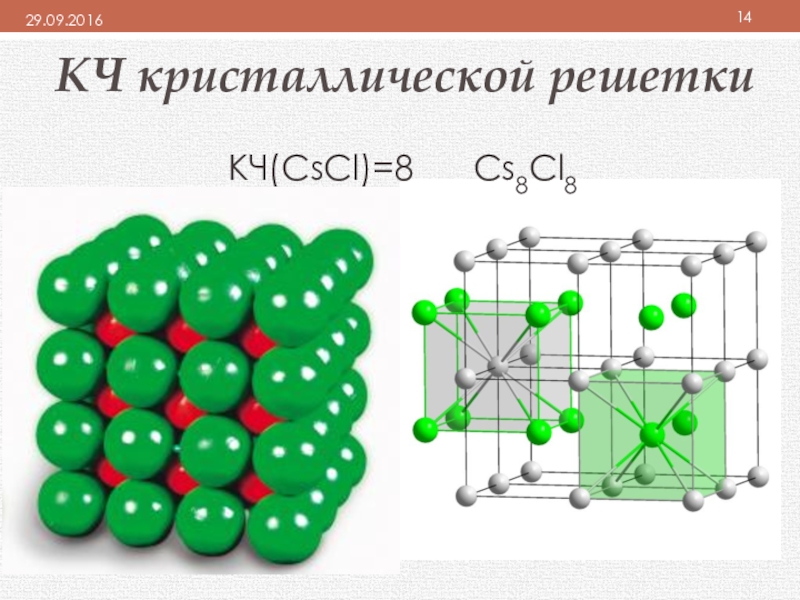
- 14. КЧ кристаллической решеткиКЧ(CsCl)=8 Cs8Cl8
- 15. Физические свойства веществ с ИХС твёрдые, кристаллические
- 16. в твердом состоянии ионы прочно связаны в
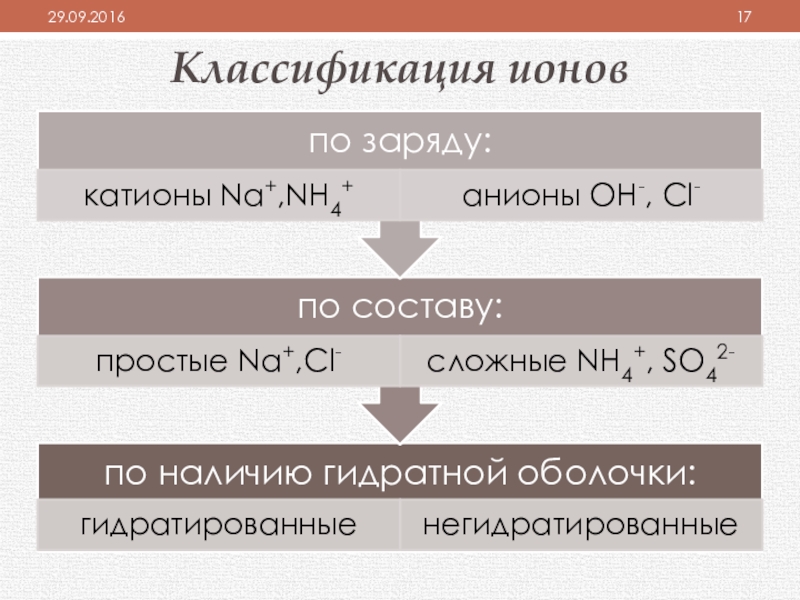
- 17. Классификация ионов
- 18. Относительность понятия“ИХС – это связь между Ме
- 19. Домашнее задание:§3; записи;распишите механизм образования ионной связи в молекулах:хлорида кальция;бромида калия;нитриде натрия.
Слайд 1Химическая связь.
Сравнение различных типов химической связи.
Ионная химическая связь.
11 класс
профильный уровень
Слайд 3Понятие химической связи
Что такое химическая связь?
Каковы причины образования химической связи?
— стремление
— стремление атомов к завершению внешнего энергетического уровня.
— взаимодействие между атомами, приводящее к образованию устойчивой многоатомной системы: молекулы, иона, кристалла.
наиболее устойчивой является такая электронная конфигурация, при которой внешний уровень завершен:
на 1 уровне – это 2ē, как у He 1S2
или как у других благородных газов 8ē (nS2np6)
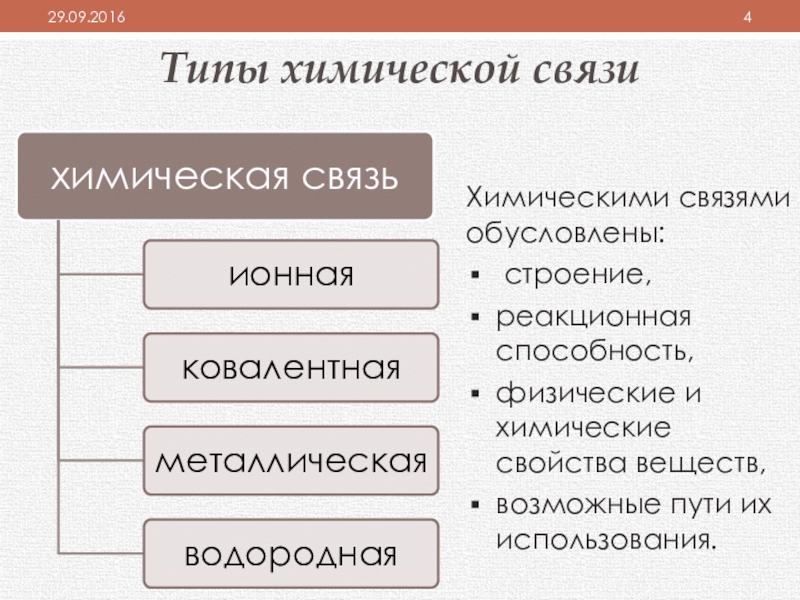
Слайд 4Типы химической связи
химическая связь
ионная
ковалентная
металлическая
водородная
Химическими связями обусловлены:
строение,
реакционная способность,
физические и
возможные пути их использования.
Слайд 5имеет электрический характер, т.к. образуется валентными ē;
при образовании ионной связи
в случае ковалентной связи – посредством образования общих электронных пар;
ковалентная полярная и ионная связь образуются в том случае, если атомы элементов, образующих соединения отличаются электроотрицательностью
Природа химической связи
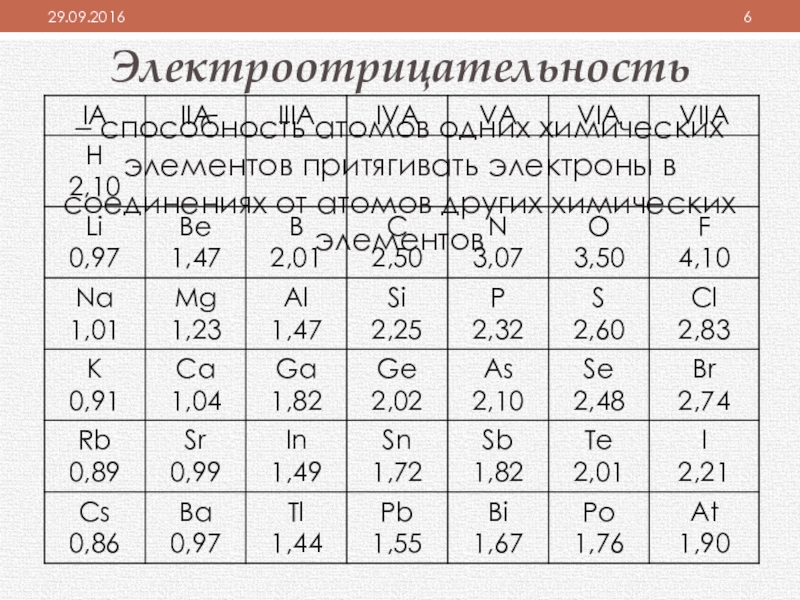
Слайд 6Электроотрицательность
– способность атомов одних химических элементов притягивать электроны в соединениях от
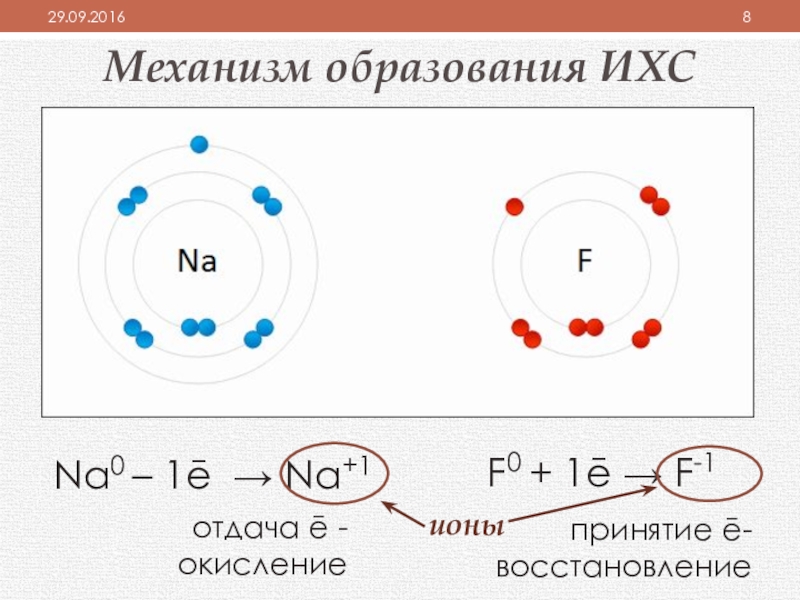
Слайд 8Механизм образования ИХС
Na0 – 1ē → Na+1
F0 + 1ē → F-1
принятие ē- восстановление
отдача ē - окисление
ионы
устойчивая конфигурация внешнего энергетического уровня
Слайд 9Ионная химическая связь (ИХС)
это связь между ионами;
ионы- заряженные частицы, имеющие устойчивую
Ме0 – nē→Меn+
неМе0 + nē→неМеn-
+
-
-
+
-
ион-катион
-
ион-анион
-
-
-
-
Слайд 10только между некоторыми Ме и неМе;
характерна для:
оксидов
гидроксидов
гидридов
солей
твердые, кристаллические вещества
Ионная связь возникает
щелочных и
щелочно-земельных Ме
Слайд 11Свойства ионной связи
ненасыщаемость
ненаправленность
каждый ион может притягивать любое число противоионов (очевидно, что
каждый ион может притягивать к себе ионы противоположного знака по любому направлению
Слайд 12Для веществ с ИХС
характерна ионная кристаллическая решетка;
прочность веществ с ИХС условно
н-р: Екрис.реш.(LiF) = 1004кДж/моль
Екрис.реш.(NaCl) = 755кДж/моль
r(Li+) < r(Na+); r(F–) < r(Cl–)
чем меньше размеры ионов и чем больше их заряд, тем сильнее у них электростатическое поле и прочнее химическая связь.
плотность определяется координационным числом (КЧ), которое показывает:
число ближайших равноудаленных одинаковых частиц (ионов или атомов) в кристаллической решётке.
отражает плотность упаковки вещества
Слайд 15Физические свойства веществ с ИХС
твёрдые, кристаллические в-ва, очень прочные [н-р:
хрупкие;
хорошо растворимые в воде
Слайд 16в твердом состоянии ионы прочно связаны в решетке и не могут
в расплаве или растворе диссоциируют на ионы и становятся на 100% ионными:
NaCl Na+ + Cl‾
проводники эл/тока 2 рода (электролиты)
Электропроводность веществ с ИХС
Слайд 18Относительность понятия
“ИХС – это связь между Ме и неМе”
соли аммония
NH4Cl, NH4NO3, (CH3NH3)2SO4
AlCl3 Δ א=1,36 ⟹ КПС
полного перехода электронов при образовании ИХС не происходит:
величины эффективных зарядов
Na+0,8 Cl-0,8 Cs+0,94 F-0,94
Li+0,87 F-0,87 Rb+0,82 I-0,82
ИХС – крайний случай КХС, и характеризуется степенью ионности.
Слайд 19Домашнее задание:
§3; записи;
распишите механизм образования ионной связи в молекулах:
хлорида кальция;
бромида
нитриде натрия.








![Презентация по химии Химическая связь. Ионная химическая связь (11 кл., профильный уровень) Физические свойства веществ с ИХС твёрдые, кристаллические в-ва, очень прочные [н-р: Физические свойства веществ с ИХС твёрдые, кристаллические в-ва, очень прочные [н-р: Тпл (NaCl)=801°С] хрупкие;хорошо растворимые в воде](/img/thumbs/02f9f7fdea04ac5500dd2097594e78fe-800x.jpg)