Ольга Сергеевна
учитель химии
МБОУ СШ №7 им. А.П. Гайдара
г. Арзамас
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Фосфор и его соединения
Содержание
- 1. Презентация по химии Фосфор и его соединения
- 2. Станция «Историческая»Гамбургский алхимикХеннинг Бранд1669 год «Фосфор» - от греческого «светоносный»
- 3. Порядковый номер – 15Период – 3Группа – VНизшая СО - 3Высшая СО + 5Станция «Анатомическая»
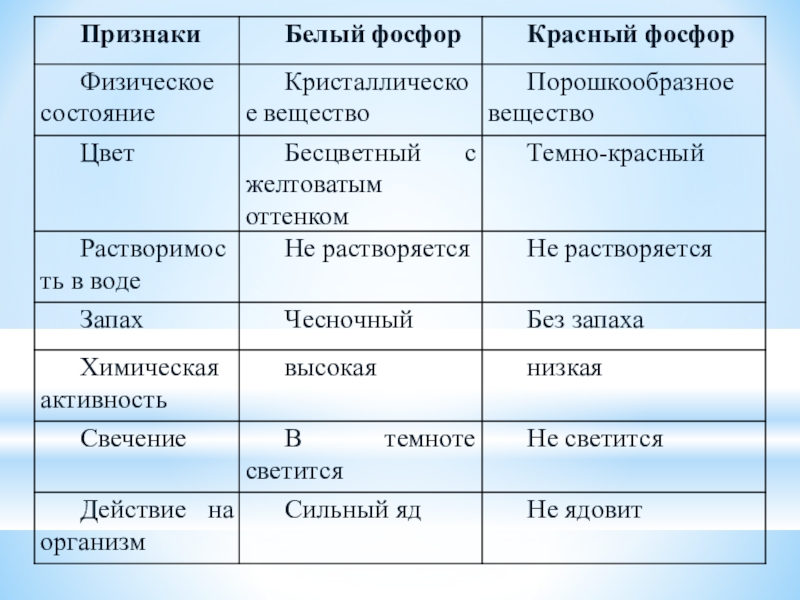
- 4. Станция «Физическая»
- 5. Слайд 5
- 6. Твердое вещество с металлическим блеском,жирное на ощупь, похожее на графит, полупроводник, малоактивен, практически негорюч
- 7. Взаимодействует с металлами
- 8. Горит в кислороде 4Р + 5О2 = 2 Р2О5 оксид фосфора (V)
- 9. Получение фосфоранагреванием смеси фосфорита, угля и песка
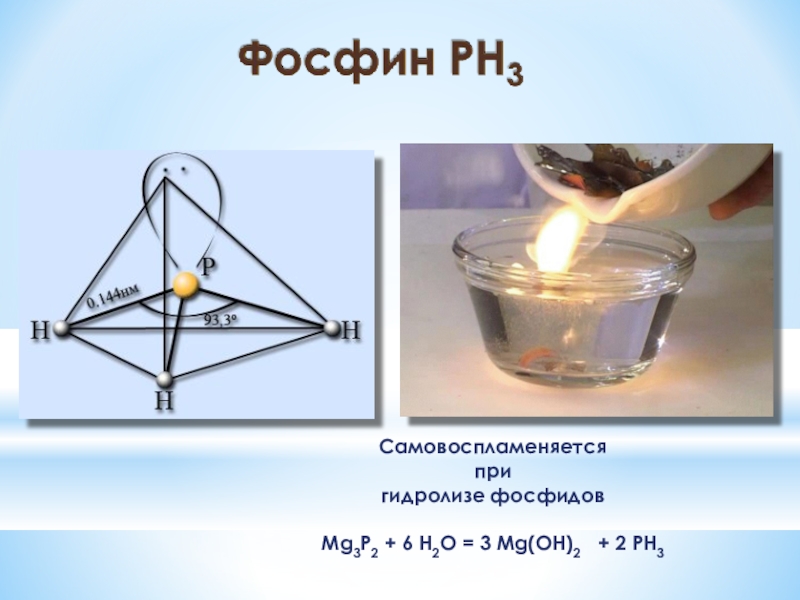
- 10. Соединения фосфораФосфинОксид фосфора (V) Ортофосфорная кислота
- 11. Самовоспламеняется при гидролизе фосфидовMg3P2 + 6 H2O = 3 Mg(OH)2 + 2 PH3
- 12. Белый гигроскопичный порошок, хорошо растворяется в воде, является кислотным оксидом.
- 13. Кислотный оксид Р2О5 Химические свойства1) с водой
- 14. Кислотный оксид Р2О5 Химические свойства2) с основными
- 15. Ортофосфорная кислота Н3РО4
- 16. Ортофосфорная кислота Н3РО4 Физические свойства Белые прозрачные
- 17. Ортофосфорная кислота Н3РО4 Химические свойства
- 18. Ортофосфорная кислота Н3РО4 Химические свойстваНекоторые реакции
- 19. Качественная реакция на фосфат-ион РО43- РО43-
- 20. Качественная реакция на фосфат-ионРО43- + 3 Ag+ = Ag3PO4↓
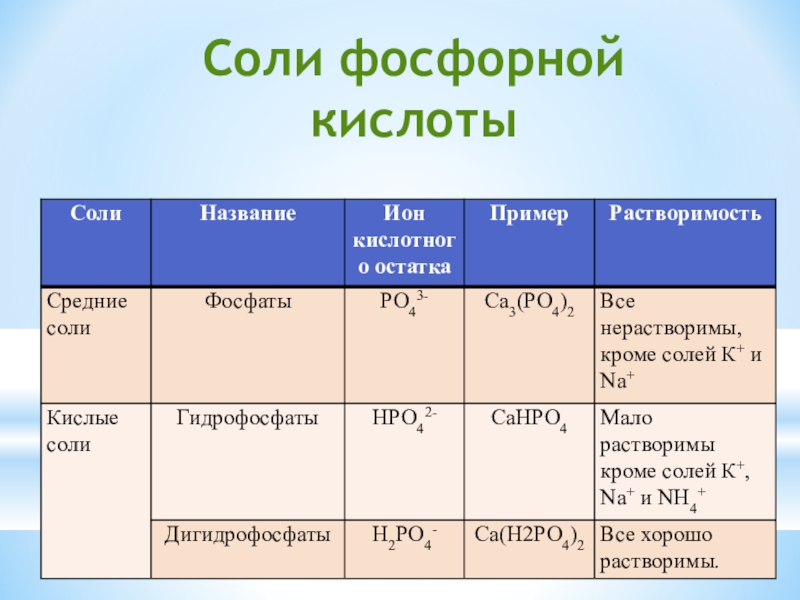
- 21. Соли фосфорной кислоты
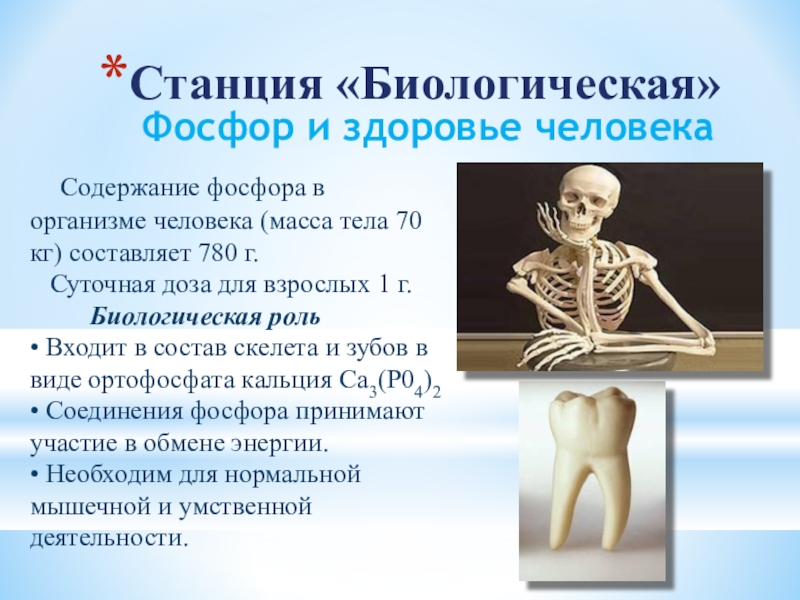
- 22. Фосфор и здоровье человека Содержание фосфора
- 23. Продукты, содержащие фосфор
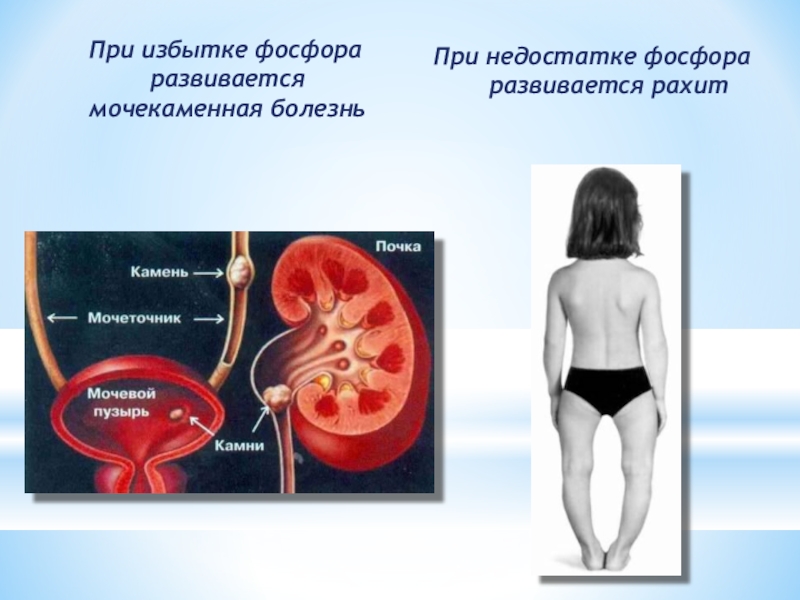
- 24. При избытке фосфора развивается мочекаменная болезньПри недостатке фосфора развивается рахит
- 25. Осторожно – фосфор!Летальная доза Р4 равна 60
- 26. Применение Производство спичекПроизводство минеральных удобренийПроизводство инсектицидов
- 27. Дана схема превращений:Для второй реакции составьте электронный
- 28. Домашнее задание§ 28 упр. 1-3 Составить сказку, или кроссворд
Станция «Историческая»Гамбургский алхимикХеннинг Бранд1669 год «Фосфор» - от греческого «светоносный»
Слайд 2Станция «Историческая»
Гамбургский алхимик
Хеннинг Бранд
1669 год
«Фосфор» -
от греческого «светоносный»
Слайд 6Твердое вещество с металлическим блеском,
жирное на ощупь, похожее на графит,
полупроводник,
малоактивен, практически негорюч
Слайд 7Взаимодействует с металлами
2Р + 3Са =
Са3Р2 (фосфид кальция)
P + 3Na = Na3P (фосфид натрия)
P + 3Na = Na3P (фосфид натрия)
Станция «Химическая»
Слайд 9Получение фосфора
нагреванием смеси фосфорита, угля и
песка в электропечи:
Ca3(PO4)2 + C
+ SiO2 → P4 + CaSiO3 + CO
Слайд 13Кислотный оксид Р2О5
Химические свойства
1) с водой
Р2О5 + 3 Н2О =
2Н3РО4
(ортофосфорная кислота)
Р2О5 + Н2О = 2НРО3
(метафосфорная кислота)
Р2О5 + 2 Н2О = Н4Р2О7
(пирофосфорная кислота)
(ортофосфорная кислота)
Р2О5 + Н2О = 2НРО3
(метафосфорная кислота)
Р2О5 + 2 Н2О = Н4Р2О7
(пирофосфорная кислота)
Слайд 14Кислотный оксид Р2О5
Химические свойства
2) с основными оксидами
Р2О5 + 3 СаО =
Са3 (РО4)3
3) со щелочами
Р2О5 + 6 Nа ОН = 2 Nа3РО4 + 3 Н2О
3) со щелочами
Р2О5 + 6 Nа ОН = 2 Nа3РО4 + 3 Н2О
Слайд 16Ортофосфорная кислота Н3РО4
Физические свойства
Белые прозрачные кристаллы,
не ядовита
Кислота средней силы
С
водой смешивается в любых соотношениях.
Тплав. = 42 0С, плавиться без разложения, при умеренном нагревании разлагается.
Окислительные свойства не проявляет (отличие от Н2SO4 (конц.), НNO3)
Тплав. = 42 0С, плавиться без разложения, при умеренном нагревании разлагается.
Окислительные свойства не проявляет (отличие от Н2SO4 (конц.), НNO3)
Слайд 17Ортофосфорная кислота Н3РО4
Химические свойства
Н3РО4 проявляет все свойства кислот
Реагирует:
1) со
щелочами: NaOH, КОН
2) с основными оксидами: Li2O, Na2O
3) c солями: К2СО3
4) с металлами не реагирует !!! ?
(см. Таблицу растворимости)
2) с основными оксидами: Li2O, Na2O
3) c солями: К2СО3
4) с металлами не реагирует !!! ?
(см. Таблицу растворимости)
Слайд 18Ортофосфорная кислота Н3РО4
Химические свойства
Некоторые реакции с металлами протекают в очень
разбавленных растворах:
2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ + 3Н2↑
2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ + 3Н2↑
Слайд 19Качественная реакция
на фосфат-ион РО43-
РО43- + 3 Ag+
= Ag3РО4 ↓ (желтый фосфат серебра)
Полученный осадок растворяется в сильных кислотах.
По этому признаку его можно отличить от других нерастворимых солей серебра желтого цвета – AgI, AgBr
AgCl – белого цвета
Полученный осадок растворяется в сильных кислотах.
По этому признаку его можно отличить от других нерастворимых солей серебра желтого цвета – AgI, AgBr
AgCl – белого цвета
Слайд 22Фосфор и здоровье человека
Содержание фосфора в организме человека (масса
тела 70 кг) составляет 780 г.
Суточная доза для взрослых 1 г. Биологическая роль • Входит в состав скелета и зубов в виде ортофосфата кальция Са3(Р04)2 • Соединения фосфора принимают участие в обмене энергии. • Необходим для нормальной мышечной и умственной деятельности.
Суточная доза для взрослых 1 г. Биологическая роль • Входит в состав скелета и зубов в виде ортофосфата кальция Са3(Р04)2 • Соединения фосфора принимают участие в обмене энергии. • Необходим для нормальной мышечной и умственной деятельности.
Станция «Биологическая»
Слайд 24 При избытке фосфора развивается мочекаменная болезнь
При недостатке фосфора развивается
рахит
Слайд 25Осторожно – фосфор!
Летальная доза Р4 равна 60 мг.
Большую опасность представляют
ожоги, возникающие при горении фосфора, из-за выделения большого количества тепла при взаимодействии образующегося при горении Р2О5 с влагой кожи.
Слайд 27Дана схема превращений:
Для второй реакции составьте электронный баланс, укажите окислитель и
восстановитель. Процессы окисления и восстановления.
7-ю реакцию запишите в ионном виде.
7-ю реакцию запишите в ионном виде.