- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Алкины (9 класс)
Содержание
- 1. Презентация по химии Алкины (9 класс)
- 2. ПодготовилаСт. гр-пы 12-15 ХТОчилова Ситора
- 3. АЛКИНЫ2.Номенклатура алкинов3.Структура тройной связи5. Нахождение в природе
- 4. 1. История открытияАлки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие
- 5. 2.Номенклатура алкиновПростейшим алкином является этин (ацетилен C2H2). По
- 6. Гомологический ряд алкиновЭтин (ацетилен): C2H2Пропин: C3H4Бутин: C4H6ПентинС5Н8Гексин: C6H10Гептин: C7H12Октин: C8H14Нонин: C9H16Децин: C10H18
- 7. 3.Структура тройной связи
- 8. У алкинов связь −С≡С− линейна (угол 180°)
- 9. Слайд 9
- 10. 4.Физические свойстваАлкины по своим физическим свойствам напоминают
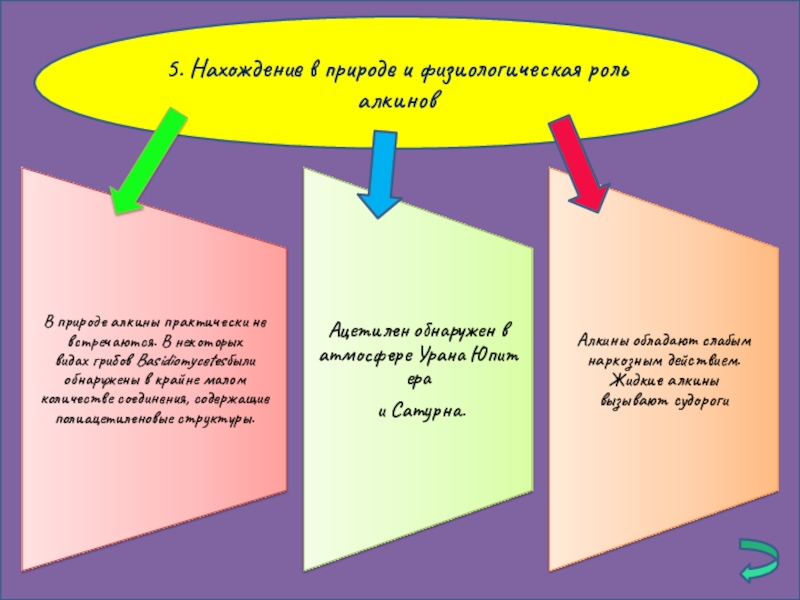
- 11. 5. Нахождение в природе и физиологическая роль алкинов
- 12. 6. Способы получения6.1 Карбидный метод (промышленный способ)6.2
- 13. 6.1 Карбидный метод (промышленный способ)Прокаливанием в электрических
- 14. 6.2 Пиролиз углеводородов (промышленный способ)Суть способа заключается
- 15. 6.4 Метод прямого синтеза6.4 Метод прямого синтеза
- 16. 6.6 Дегидрогалогенирование галогеналканов и галогеналкенов (лабораторный способ)Реакция
- 17. 6.8 Прочие лабораторные способы получения алкиновРеакция Кори-Фукса—
- 18. 7. Химические свойства
- 19. Реакции нуклеофильного замещения алкинидовАлкиниды являются сильными нуклеофилами
- 20. Реакции галогенированияАлкины способны присоединять одну или две
- 21. Гидратация.В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида
- 22. Типовые реакции нуклеофильного присоединенияХарактерным примером реакции нуклеофильного
- 23. При высокой температуре в присутствии катализатора имин
- 24. Идентификация алкиновКачественной реакцией на алкины с концевой
- 25. ЛитератураМиллер С. Ацетилен его свойства, полцчение и
Слайд 3АЛКИНЫ
2.Номенклатура алкинов
3.Структура тройной связи
5. Нахождение в природе и физиологическая роль алкинов
9.Применение
6.
7. Химические свойства
8. Идентификация алкинов
10. Литература
1. История открытия
4.Физические свойства
Слайд 41. История открытия
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей
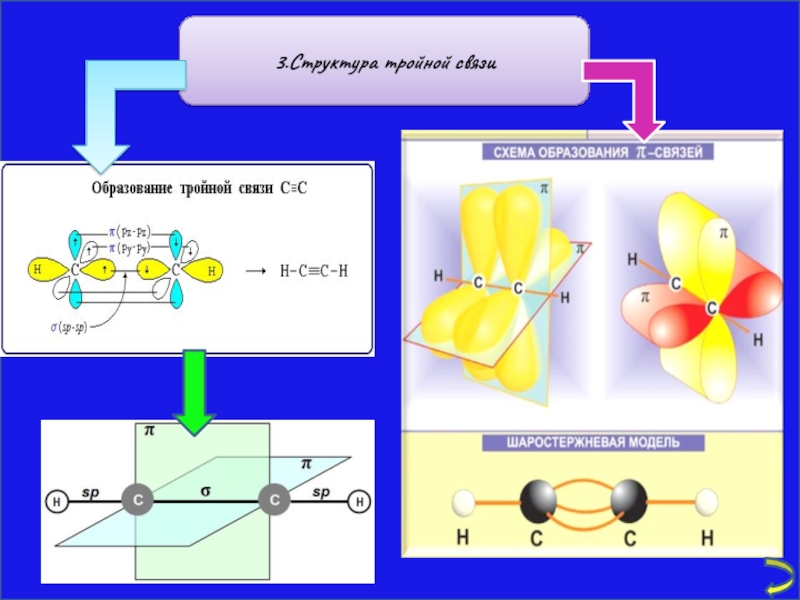
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Для алкинов характерны
реакцииприсоединения. В отличие от алкенов, которым свойственны реакции
электрофильного присоединения, алкины могут вступать также и вреакции нуклеофильногоприсоединения.
В 1863 году французский химик М. Бертло получил ацетилен, пропуская водород над раскаленными электрической дугой графитовыми электродами. Именно он дал газу имя ацетилен (от латинских слов acetum — уксус и греческого иле — дерево). Русское название «ацетилен» впервые было применено Д. И. Менделеевым
Впервые ацетилен был получен в 1836 году Эдмундом Дэви, двоюродным братом знаменитого английского химика Гемфри Дэви, нагреванием уксуснокислого калия с древесным углем и последующей реакцией с водой образовавшегося карбида калия Дэви назвал свой газ «двууглеродистым водородом».
В 1862 году немецкий химик и врач Ф. Вёлер вновь открыл ацетилен, действуя водой на карбид кальция.
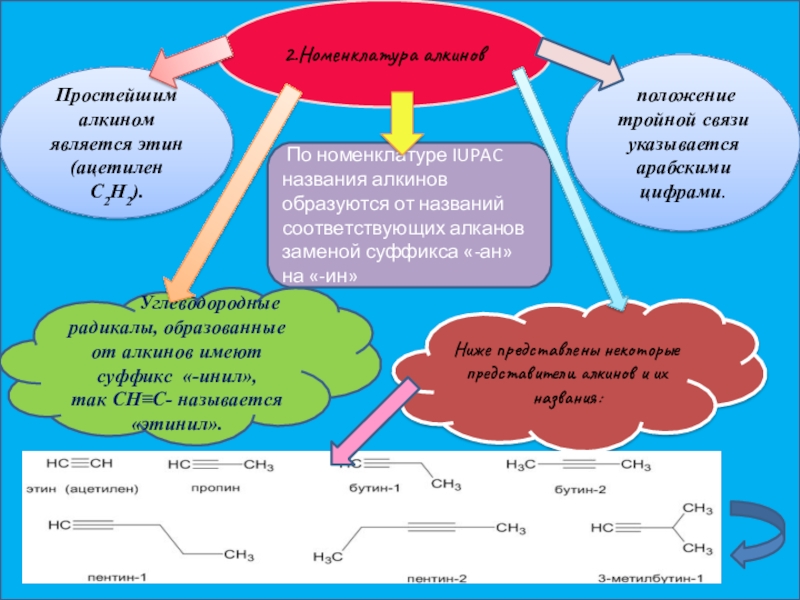
Слайд 52.Номенклатура алкинов
Простейшим алкином является этин (ацетилен C2H2).
По номенклатуре IUPAC
названия алкинов образуются от
положение тройной связи указывается арабскими цифрами.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется
«этинил».
Ниже представлены некоторые представители алкинов и их названия:
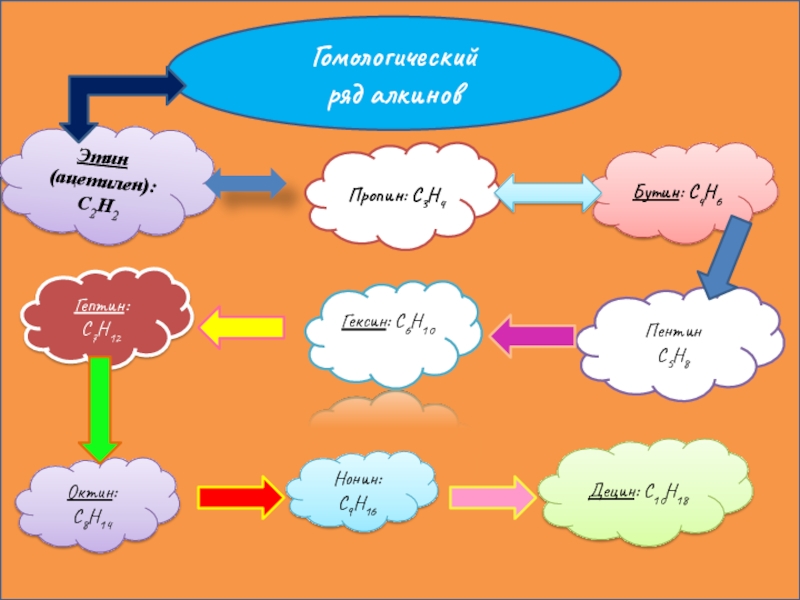
Слайд 6Гомологический ряд алкинов
Этин
(ацетилен): C2H2
Пропин: C3H4
Бутин: C4H6
Пентин
С5Н8
Гексин: C6H10
Гептин: C7H12
Октин: C8H14
Нонин: C9H16
Децин: C10H18
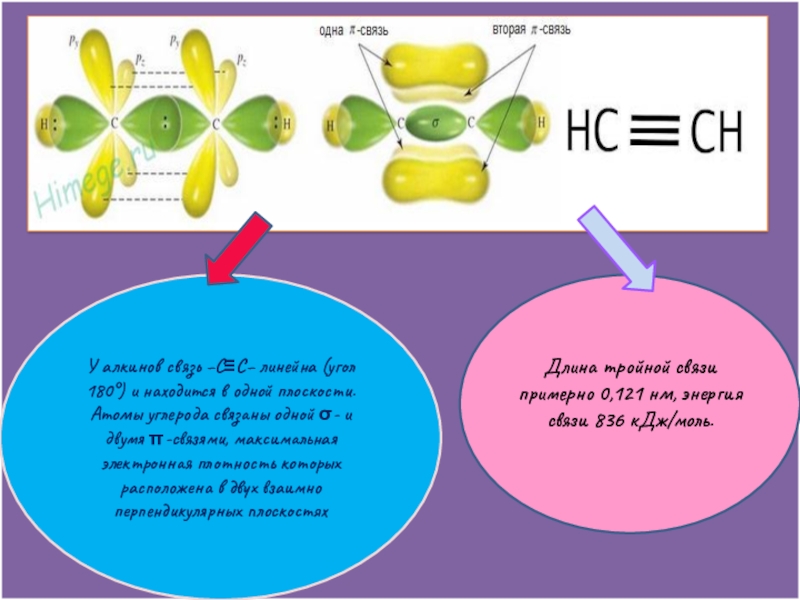
Слайд 8У алкинов связь −С≡С− линейна (угол 180°) и находится в одной
Атомы углерода связаны одной σ- и двумя π-связями, максимальная электронная плотность которых расположена в двух взаимно перпендикулярных плоскостях
Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль.
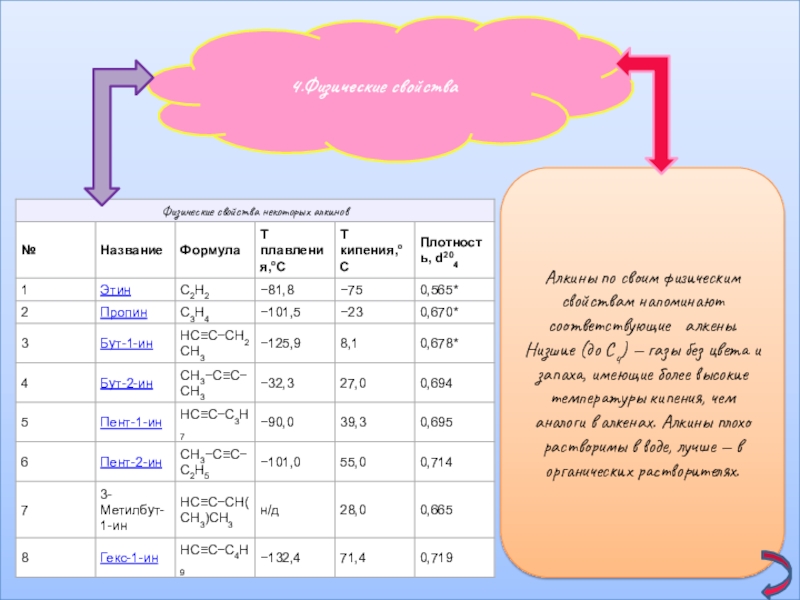
Слайд 104.Физические свойства
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до
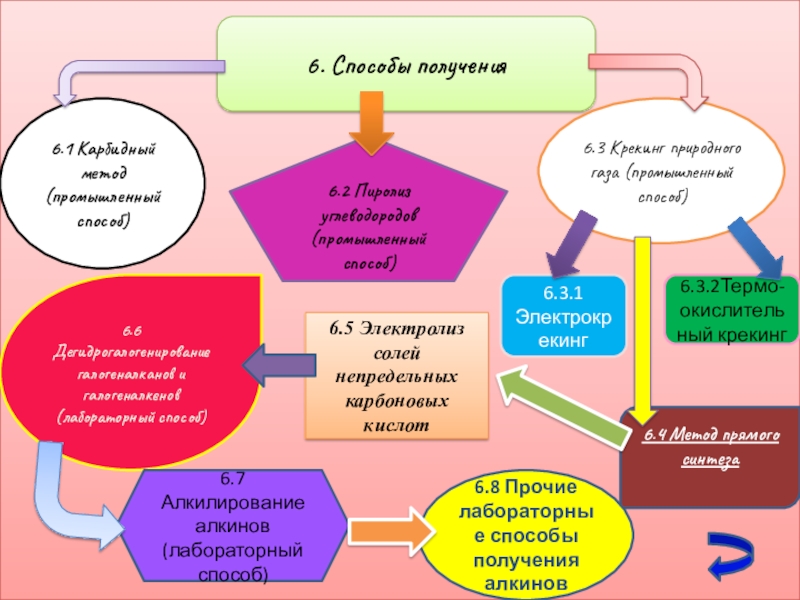
Слайд 126. Способы получения
6.1 Карбидный метод (промышленный способ)
6.2 Пиролиз углеводородов (промышленный способ)
6.3
6.4 Метод прямого синтеза
6.5 Электролиз солей непредельных карбоновых кислот
6.6 Дегидрогалогенирование галогеналканов и галогеналкенов (лабораторный способ)
6.7 Алкилирование алкинов (лабораторный способ)
6.8 Прочие лабораторные способы получения алкинов
6.3.1 Электрокрекинг
6.3.2Термо-окислительный крекинг
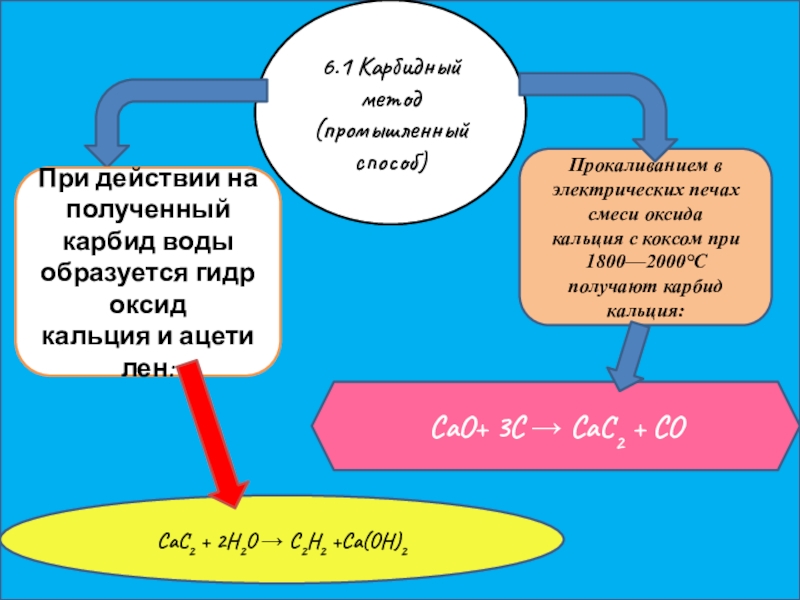
Слайд 136.1 Карбидный метод (промышленный способ)
Прокаливанием в электрических печах смеси оксида кальция с коксом при
CaO+ 3C → CaC2 + CO
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
CaC2 + 2H2O → C2H2 +Ca(OH)2
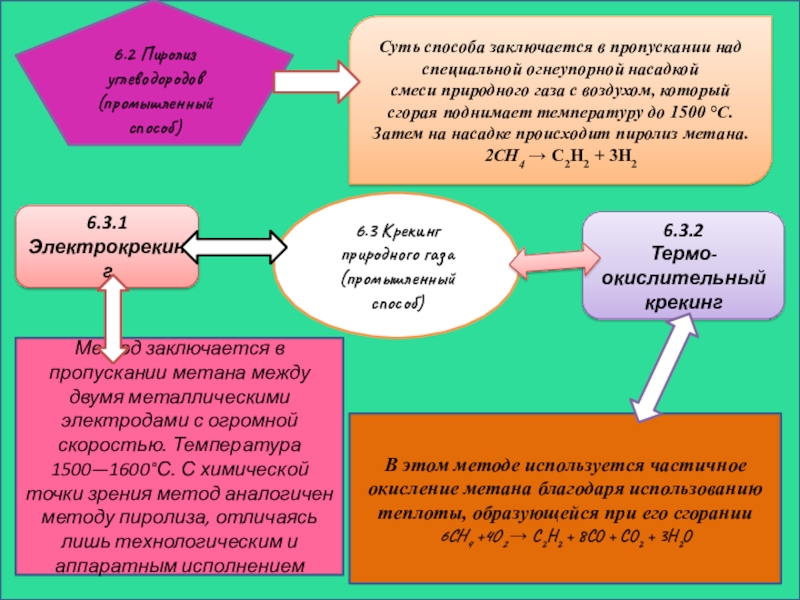
Слайд 146.2 Пиролиз углеводородов (промышленный способ)
Суть способа заключается в пропускании над специальной
2CH4 → C2H2 + 3H2
6.3 Крекинг природного газа (промышленный способ)
6.3.1 Электрокрекинг
6.3.2
Термо-окислительный крекинг
Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением
В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании
6CH4 +4O2 → C2H2 + 8CO + CO2 + 3H2O
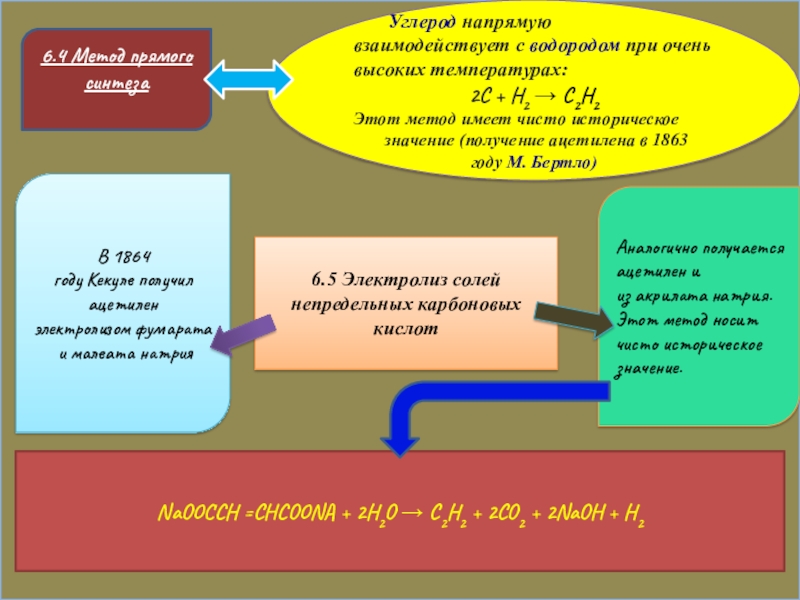
Слайд 156.4 Метод прямого синтеза
6.4 Метод прямого синтеза
Углерод напрямую
2C + H2 → C2H2
Этот метод имеет чисто историческое
значение (получение ацетилена в 1863 году М. Бертлo)
6.5 Электролиз солей непредельных карбоновых кислот
В 1864 году Кекуле получил ацетилен
электролизом фумарата и малеата натрия
Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
NaOOCCH =CHCOONA + 2H2O → C2H2 + 2CO2 + 2NaOH + H2
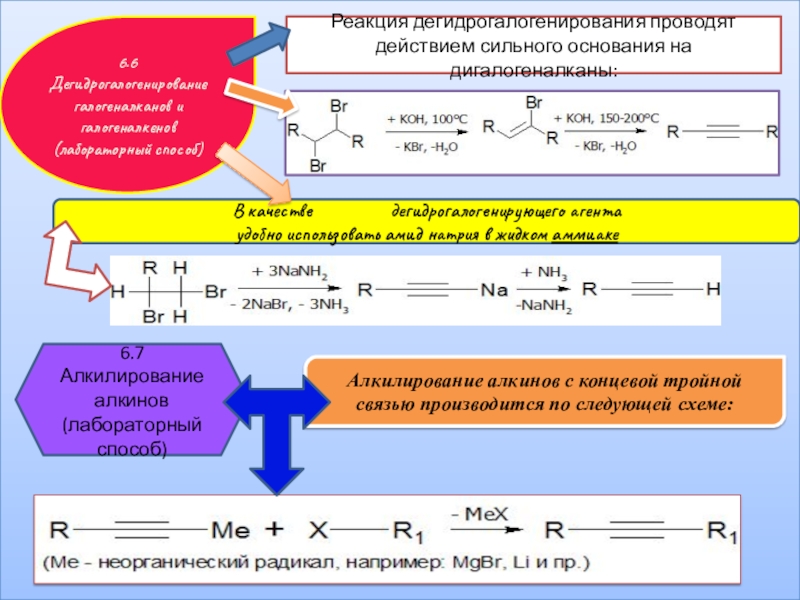
Слайд 166.6 Дегидрогалогенирование галогеналканов и галогеналкенов (лабораторный способ)
Реакция дегидрогалогенирования проводят действием сильного
В качестве дегидрогалогенирующего агента
удобно использовать амид натрия в жидком аммиаке
6.7 Алкилирование алкинов (лабораторный способ)
Алкилирование алкинов с концевой тройной связью производится по следующей схеме:
Слайд 176.8 Прочие лабораторные способы получения алкинов
Реакция Кори-Фукса— синтез алкинов из альдегидов
На первой
На второй стадии происходит отщепление брома:
Разложение дигидразонов[
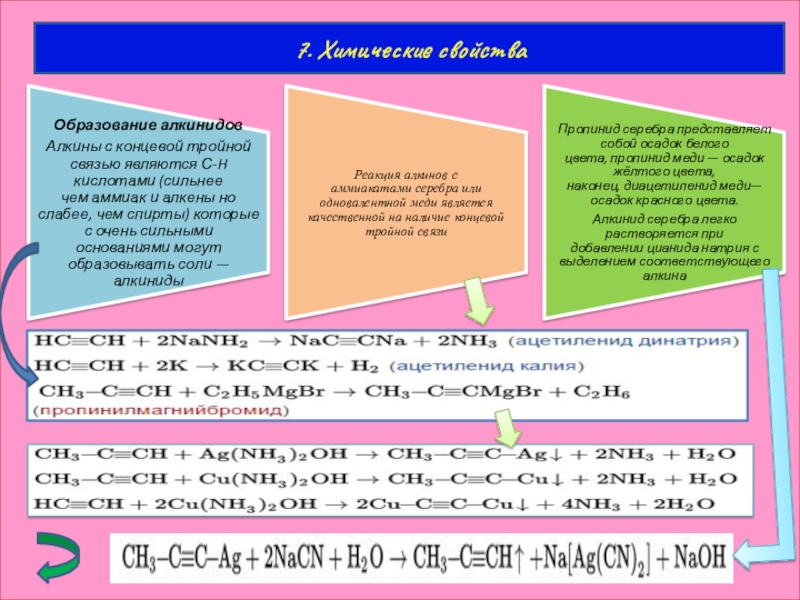
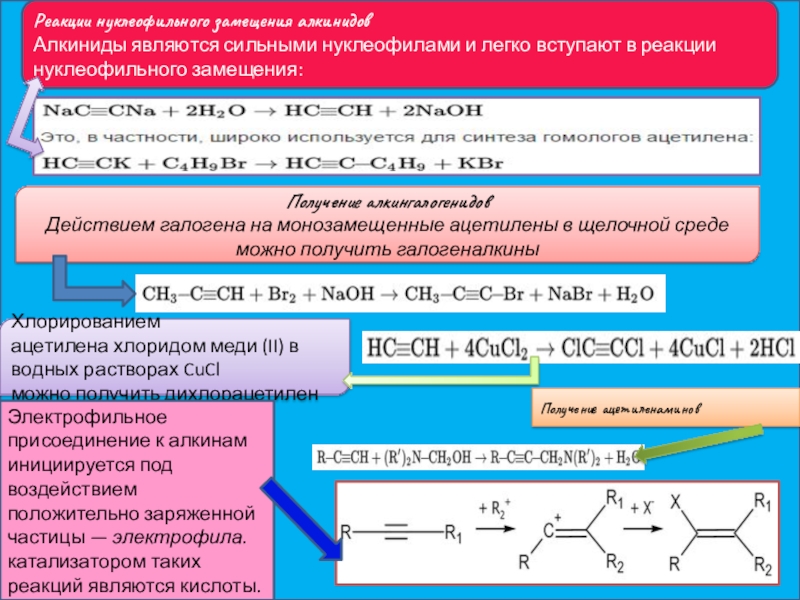
Слайд 19Реакции нуклеофильного замещения алкинидов
Алкиниды являются сильными нуклеофилами и легко вступают в реакции
Получение алкингалогенидов
Действием галогена на монозамещенные ацетилены в щелочной среде можно получить галогеналкины
Хлорированием ацетилена хлоридом меди (II) в водных растворах CuCl
можно получить дихлорацетилен
Получение ацетиленаминов
Электрофильное присоединение к алкинам инициируется под воздействием положительно заряженной частицы — электрофила.катализатором таких реакций являются кислоты.
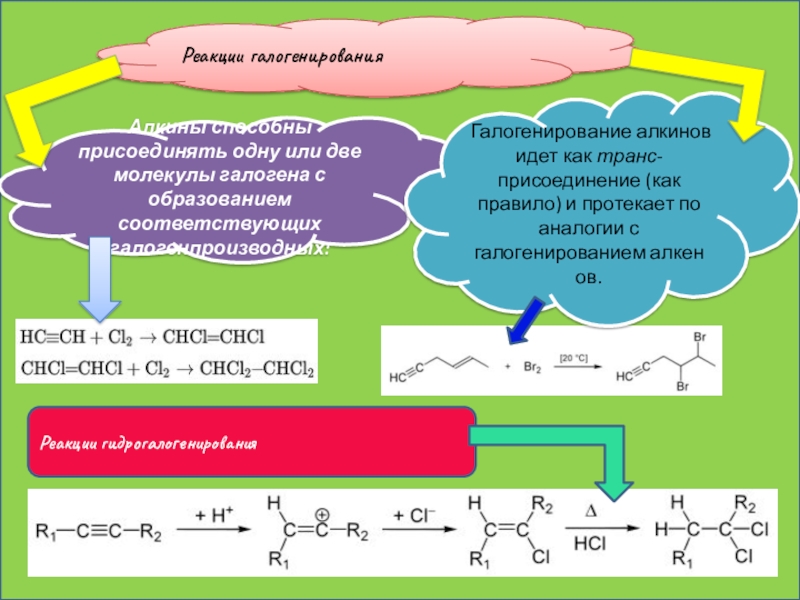
Слайд 20Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием
Реакции гидрогалогенирования
Галогенирование алкинов идет как транс-присоединение (как правило) и протекает по аналогии с галогенированием алкенов.
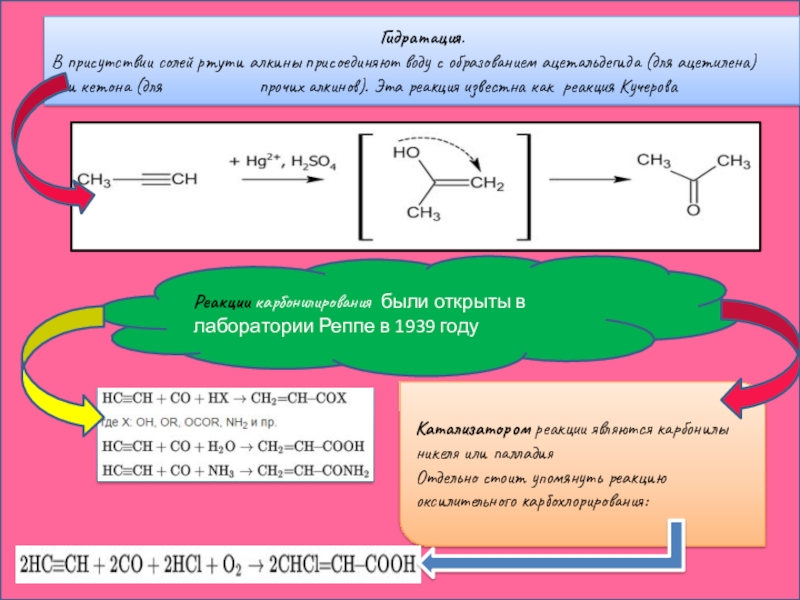
Слайд 21Гидратация.
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для
Катализатором реакции являются карбонилы никеля или палладия
Отдельно стоит упомянуть реакцию оксилительного карбохлорирования:
Реакции карбонилирования были открыты в лаборатории Реппе в 1939 году
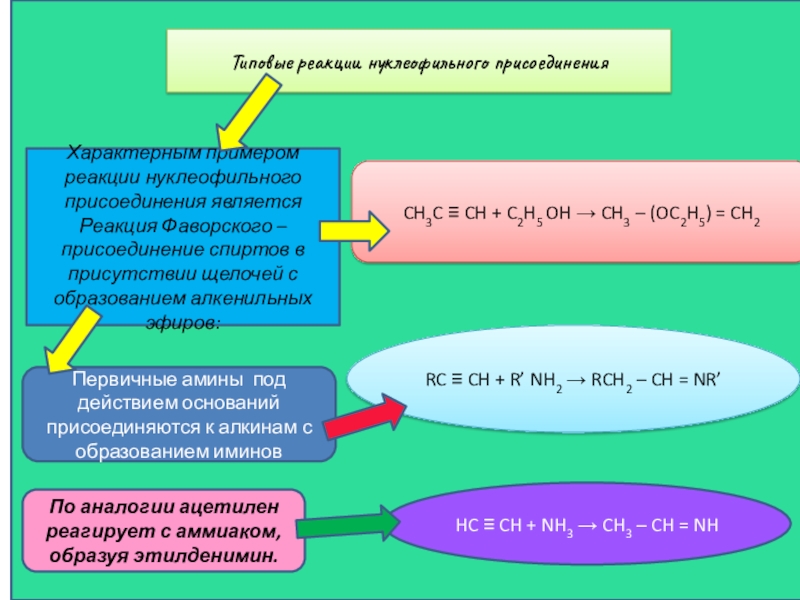
Слайд 22Типовые реакции нуклеофильного присоединения
Характерным примером реакции нуклеофильного присоединения является Реакция Фаворского
CH3C ≡ CH + C2H5 OH → CH3 – (OC2H5) = CH2
Первичные амины под действием оснований присоединяются к алкинам с образованием иминов
RC ≡ CH + R’ NH2 → RCH2 – CH = NR’
По аналогии ацетилен реагирует с аммиаком, образуя этилденимин.
HC ≡ CH + NH3 → CH3 – CH = NH
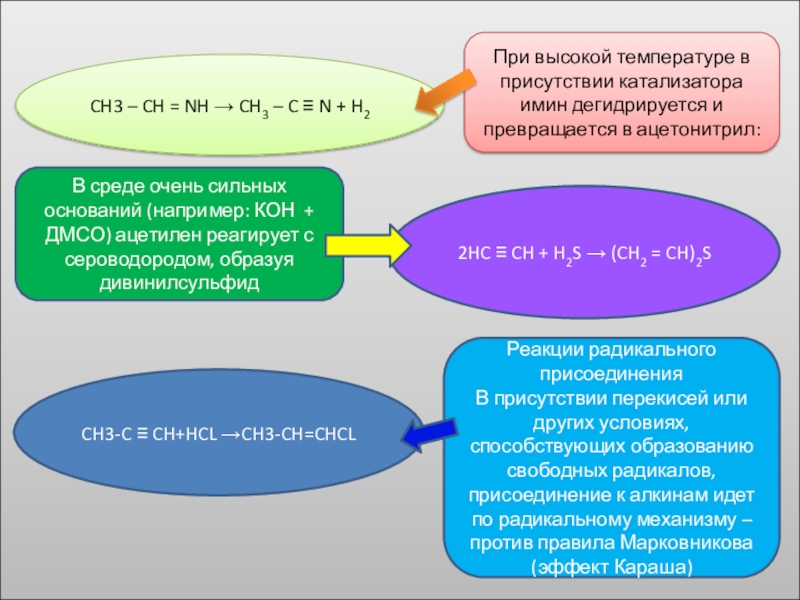
Слайд 23При высокой температуре в присутствии катализатора имин дегидрируется и превращается в
CH3 – CH = NH → CH3 – C ≡ N + H2
В среде очень сильных оснований (например: КОН + ДМСО) ацетилен реагирует с сероводородом, образуя дивинилсульфид
2HC ≡ CH + H2S → (CH2 = CH)2S
Реакции радикального присоединения
В присутствии перекисей или других условиях, способствующих образованию свободных радикалов, присоединение к алкинам идет по радикальному механизму – против правила Марковникова (эффект Караша)
CH3-C ≡ CH+HCL →CH3-CH=CHCL
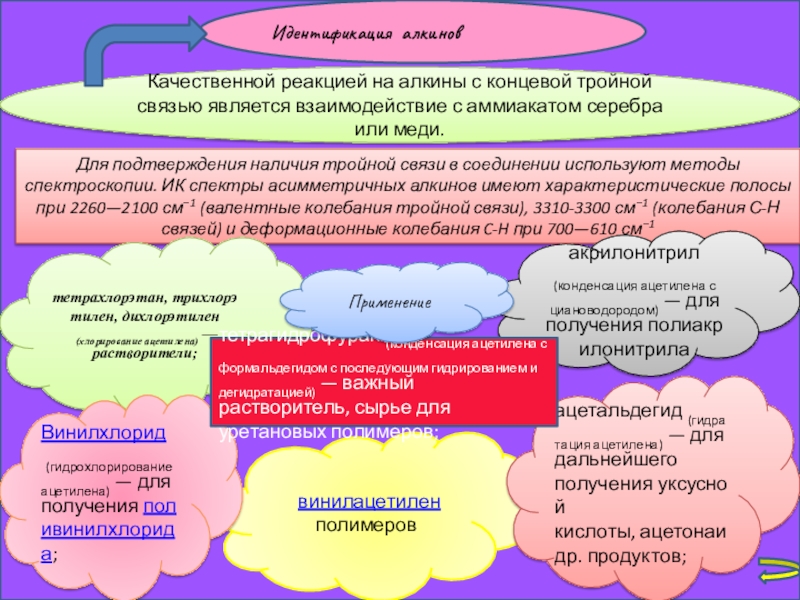
Слайд 24Идентификация алкинов
Качественной реакцией на алкины с концевой тройной связью является взаимодействие
Для подтверждения наличия тройной связи в соединении используют методы спектроскопии. ИК спектры асимметричных алкинов имеют характеристические полосы при 2260—2100 см−1 (валентные колебания тройной связи), 3310-3300 см−1 (колебания С-Н связей) и деформационные колебания C-H при 700—610 см−1
тетрахлорэтан, трихлорэтилен, дихлорэтилен
(хлорирование ацетилена) — растворители;
винилацетилен полимеров
ацетальдегид (гидратация ацетилена) — для дальнейшего получения уксусной кислоты, ацетонаи др. продуктов;
Винилхлорид
(гидрохлорирование ацетилена) — для получения поливинилхлорида;
акрилонитрил
(конденсация ацетилена с циановодородом) — для получения полиакрилонитрила
тетрагидрофуран (конденсация ацетилена с формальдегидом с последующим гидрированием и дегидратацией) — важный растворитель, сырье для уретановых полимеров;
Применение
Слайд 25Литература
Миллер С. Ацетилен его свойства, полцчение и применение
680 с. 1969 г
Общая органическая химия. Стереохимия, углкеводороды, галогкносодержащие соединения
1981г. 257-270
Темкин О.Н, Щестаков Г.К
Ацетилен: Химия
Механизмы реакций.
Химия
1991. - 416
Темкин О.Н,
Флид Р.М
Каталитические превращения