- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Алкены
Содержание
- 1. Презентация по химии Алкены
- 2. Цели урока:Познакомиться с гомологическим рядом алкенов, их
- 3. Алкены – непредельные углеводороды, в молекулах которых содержится одна двойная связь между атомами углерода.
- 4. Общая формула алкенов СпН2п
- 5. Алкан алкен - Н2
- 6. НоменклатураСН3 – СН=СН – СН (СН3) –
- 7. Модель молекулы этилена
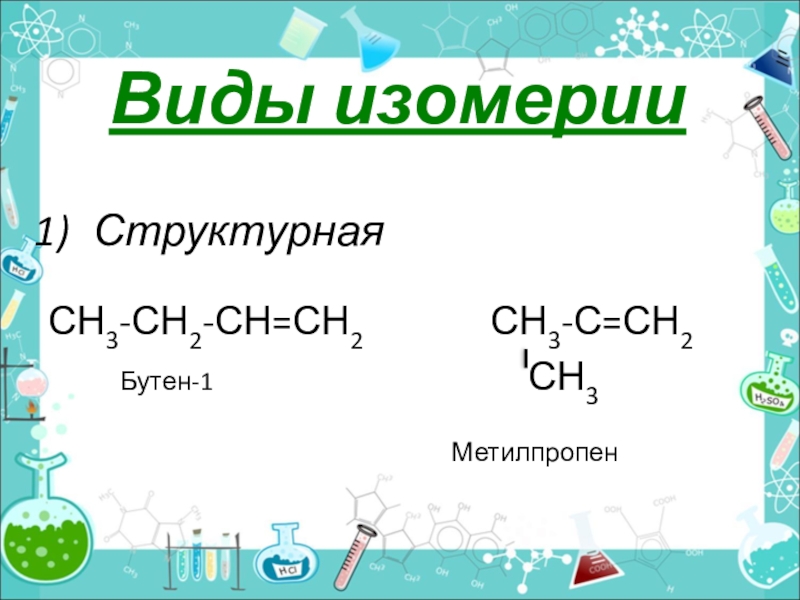
- 8. Виды изомерииСтруктурная СН3-СН2-СН=СН2
- 9. Положения двойной связи
- 10. МежклассоваяСН2=СН-СН3 Пропен
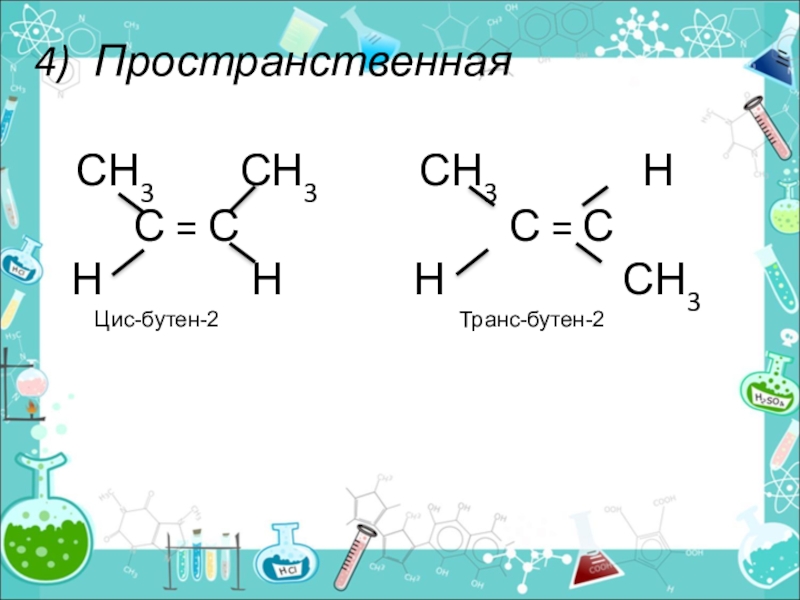
- 11. Пространственная СН3
- 12. Сколько изомеров имеет пентен? Дайте им названия.
- 13. ФИЗИЧЕСКИЕ СВОЙСТВАС2Н4-С4Н8 – газыС5Н10-С16Н32 – жидкостиот С17Н34
- 14. Получение алкенов:Крекинг нефтепродуктов С16Н34→С8Н18+С8Н16
- 15. Дегидратация спиртов (отщепление воды) СН3-СН2-ОН Н2SO4,
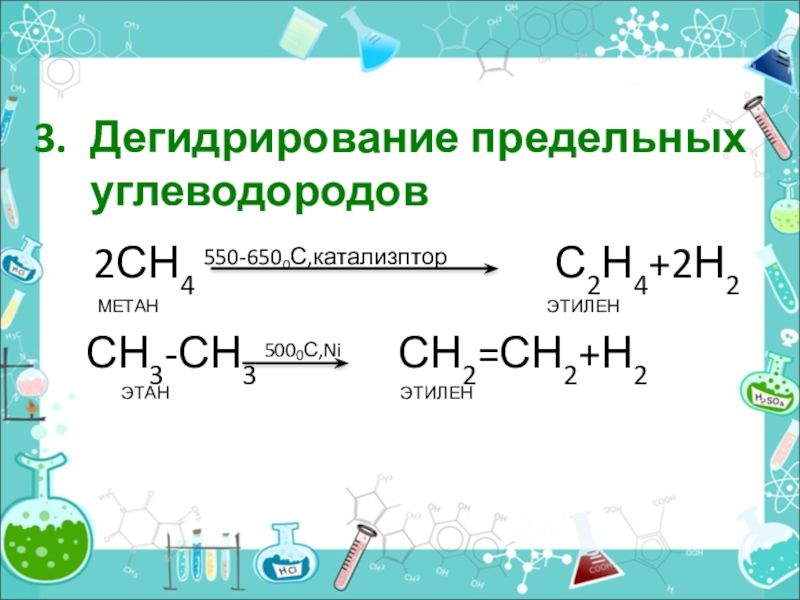
- 16. Дегидрирование предельных углеводородов 2СН4 550-6500С,катализптор
- 17. Дегидрогалогенирование (отщепление галогеноводорода) Br
- 18. Правило Зайцева: При отщеплении галогеноводорода от вторичных и
- 19. Дегалогенирование Br BrСН3-СН-СН-СН3+Zn→СН3-СН=СН-СН3+
- 20. Химические свойства алкеновОкисление Присоединение
- 21. Реакции присоединения:Гидрирование алкеновСН3-СН2-СН=СН2+Н2 Pt СН3-СН2-СН2-СН3Галогенирование
- 22. Гидрогалогенирование СН3-СН=СН2+НBr→СН3-СН Br-СН3Правило Марковникова: При присоединении галогеноводорода
- 23. Гидратация (присоединение воды)СН2=СН2+Н2О t,Н3РО4
- 24. Реакция полимеризация – это химический процесс соединения
- 25. Окисление СН2=СН2+3О2→2СО2+2Н2ОСН2=СН2+[О]+Н2О→СН2-СН2
- 26. При пропускании алкенов (этилена) через бромную воду
- 27. ПРИМЕНЕНИЕ ЭТИЛЕНА
- 28. ПРИМЕНЕНИЕ этилена
- 29. Для закрепления выполним упражненияЗадание 1.Составить формулы трёх алкенов.Задание 2.Выберите себе пару.Задание 3.Поменяйтесь формулами и назовите вещества.
- 30. Задание 4.Запишите формулу бутена.Задание 5.Для бутена-1 записать
- 31. Задание 7 – домашнее.Проработать конспект урока.Составить тест из 5 - 10 вопросов.
- 32. Спасибо за работу и приятное общение.
Цели урока:Познакомиться с гомологическим рядом алкенов, их строением, применением.Рассмотреть способы получения алкенов в лаборатории и промышленности.Изучить химические свойства этиленовых углеводородов.
Слайд 2Цели урока:
Познакомиться с гомологическим рядом алкенов, их строением, применением.
Рассмотреть способы получения
алкенов в лаборатории и промышленности.
Изучить химические свойства этиленовых углеводородов.
Изучить химические свойства этиленовых углеводородов.
Слайд 3Алкены – непредельные углеводороды, в молекулах которых содержится одна двойная связь
между атомами углерода.
Слайд 6Номенклатура
СН3 – СН=СН – СН (СН3) – СН3
3-метилпентен-2
СН2Cl – CН2 –
СН=СН – СН2 – СН2Cl
1,6 – дихлоргексен – 3
СН2 (СН3) – СН2 - СН (С2Н5)- СН= СН2
3-этилгексен-1
1,6 – дихлоргексен – 3
СН2 (СН3) – СН2 - СН (С2Н5)- СН= СН2
3-этилгексен-1
Слайд 13ФИЗИЧЕСКИЕ СВОЙСТВА
С2Н4-С4Н8 – газы
С5Н10-С16Н32 – жидкости
от С17Н34 – твердые вещества
Т кип. и Т пл. ↑ с увеличением Mr
Слайд 15Дегидратация спиртов (отщепление воды)
СН3-СН2-ОН Н2SO4, 170-1800C
СН2=СН2+Н2О
этанол этилен
этанол этилен
Слайд 16
Дегидрирование предельных углеводородов
2СН4 550-6500С,катализптор
С2Н4+2Н2
МЕТАН ЭТИЛЕН
СН3-СН3 5000С,Ni СН2=СН2+Н2
ЭТАН ЭТИЛЕН
МЕТАН ЭТИЛЕН
СН3-СН3 5000С,Ni СН2=СН2+Н2
ЭТАН ЭТИЛЕН
Слайд 17Дегидрогалогенирование (отщепление галогеноводорода)
Br
СН3-СН-СН2-СН3+NaOH спирт,t
2-бромбутан
СН3-СН=СН-СН3+NaBr+Н2О
Бутен-2
Слайд 18Правило Зайцева:
При отщеплении галогеноводорода от вторичных и третичных галогеналканов атом водорода
отщепляется от наименее гидрированного атома углерода.
Слайд 21Реакции присоединения:
Гидрирование алкенов
СН3-СН2-СН=СН2+Н2 Pt СН3-СН2-СН2-СН3
Галогенирование (присоединение галогена)
СН2=СН2+Br2→СН2 Br-СН2 Br
1,2 – дибромэтан
1,2 – дибромэтан
Слайд 22Гидрогалогенирование
СН3-СН=СН2+НBr→СН3-СН Br-СН3
Правило Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется
к более гидрированному атому углерода, а галоген – к менее гидрованному.
Слайд 23Гидратация
(присоединение воды)
СН2=СН2+Н2О t,Н3РО4 СН3-СН2ОН
этен этанол
ОН
СН3-СН=СН2+Н2О Н2SO4 СН3-СН-СН3
пропен пропанол-2
ОН
СН3-СН=СН2+Н2О Н2SO4 СН3-СН-СН3
пропен пропанол-2
Слайд 24Реакция полимеризация – это химический процесс соединения множества исходных молекул низкомолекулярного
вещества (мономера) в крупные молекулы (макромолекулы) полимера.
Полимер – это высокомолекулярное соединение, молекулы которого состоят из множества одинаковых структурных звеньев.
пСН2=СН2 УФ-свет, R (…-СН2-СН2-…)n
Этилен полиэтилен
Полимер – это высокомолекулярное соединение, молекулы которого состоят из множества одинаковых структурных звеньев.
пСН2=СН2 УФ-свет, R (…-СН2-СН2-…)n
Этилен полиэтилен
Слайд 26При пропускании алкенов (этилена) через бромную воду или раствор перманганата калия
происходит обесцвечивание растворов. Это КАЧЕСТВЕННЫЕ РЕАКЦИИ на кратную связь.
Слайд 29Для закрепления выполним упражнения
Задание 1.
Составить формулы трёх алкенов.
Задание 2.
Выберите себе пару.
Задание
3.
Поменяйтесь формулами и назовите вещества.
Поменяйтесь формулами и назовите вещества.
Слайд 30Задание 4.
Запишите формулу бутена.
Задание 5.
Для бутена-1 записать реакции с НСL и
CL2.
Задание 6.
Для бутена-2 записать реакции с HOH и H2.
Задание 6.
Для бутена-2 записать реакции с HOH и H2.





















![Презентация по химии Алкены Окисление СН2=СН2+3О2→2СО2+2Н2ОСН2=СН2+[О]+Н2О→СН2-СН2 Окисление СН2=СН2+3О2→2СО2+2Н2ОСН2=СН2+[О]+Н2О→СН2-СН2](/img/thumbs/080ffb3245840b7782a75a0269cf7018-800x.jpg)












