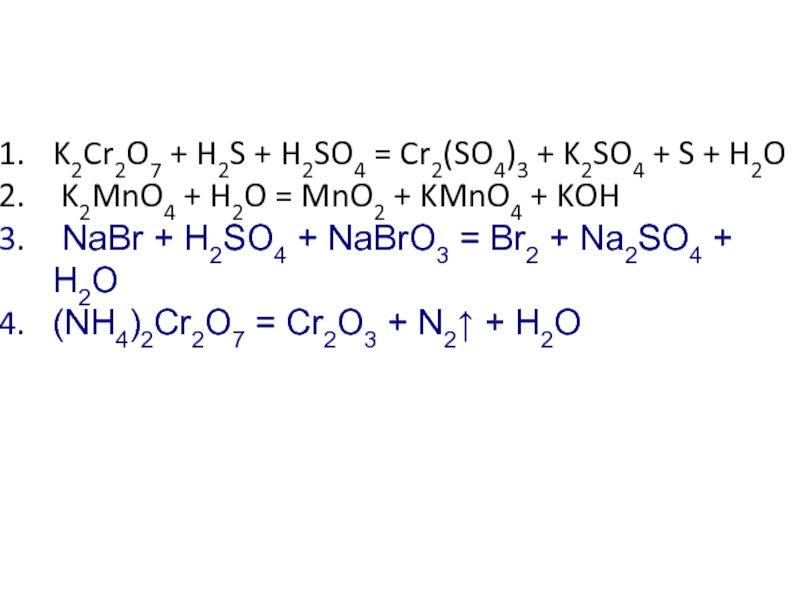- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 9 класс по теме: Окислительно-восстановительные реакции
Содержание
- 1. Презентация по химии 9 класс по теме: Окислительно-восстановительные реакции
- 2. 1.Е.Г.Рудзитис. «Химия». 9
- 3. Расставьте степень окисления элементов в соединениях. K2SO4
- 4. Окислительно –восстановительные реакции ОВР9класс
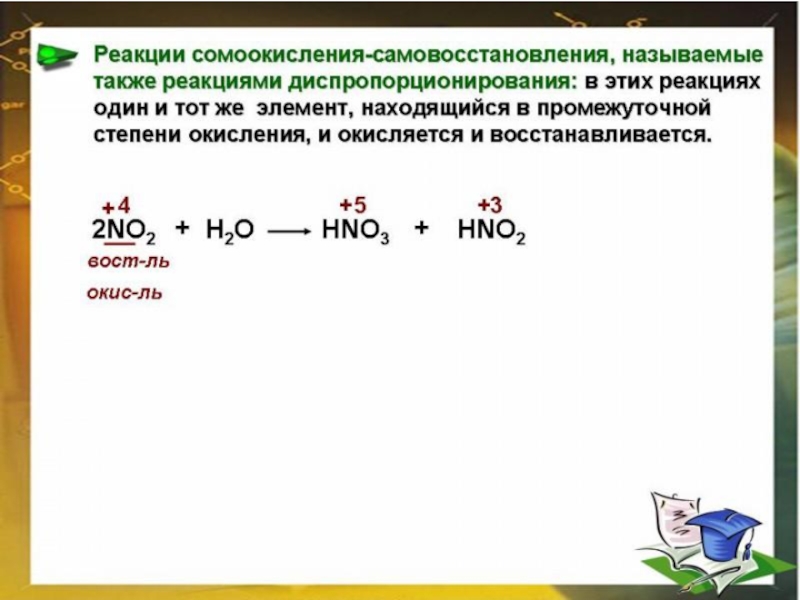
- 5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) – реакции, протекающие с
- 6. Два антипода парою ходят, Первый – теряет;
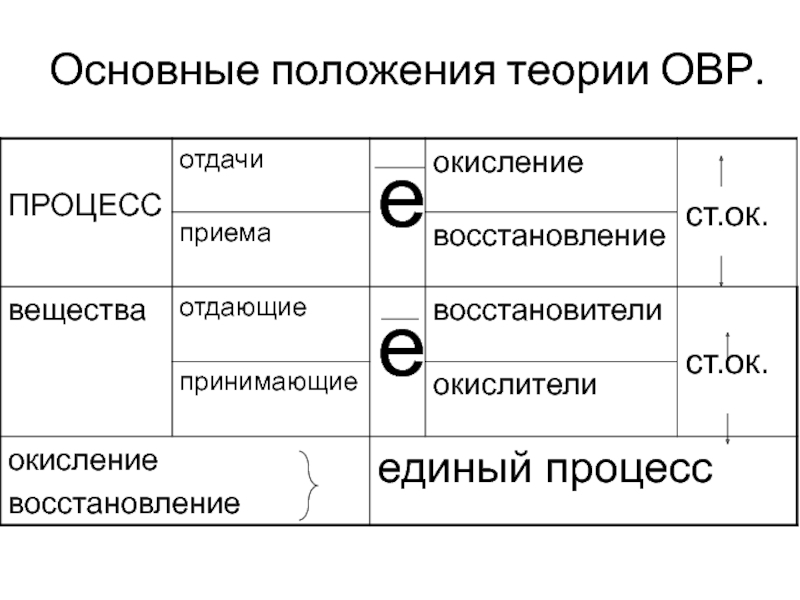
- 7. Основные положения теории ОВР.
- 8. Алгоритм составления ОВРОпределить степени окисления элементов
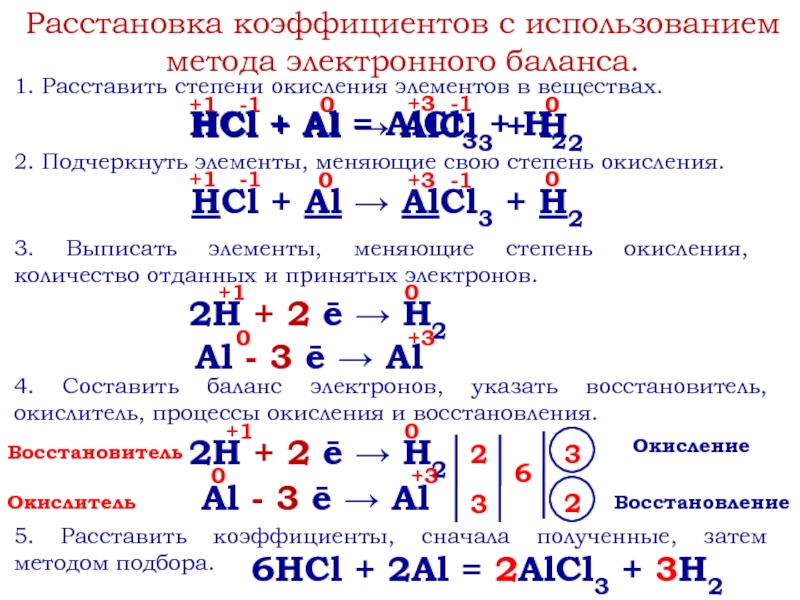
- 9. Расстановка коэффициентов с использованием метода электронного баланса.1.
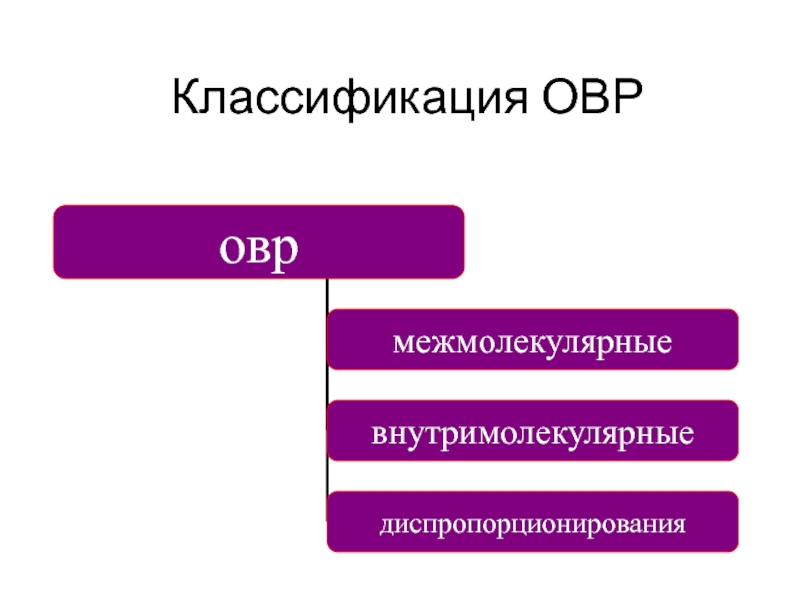
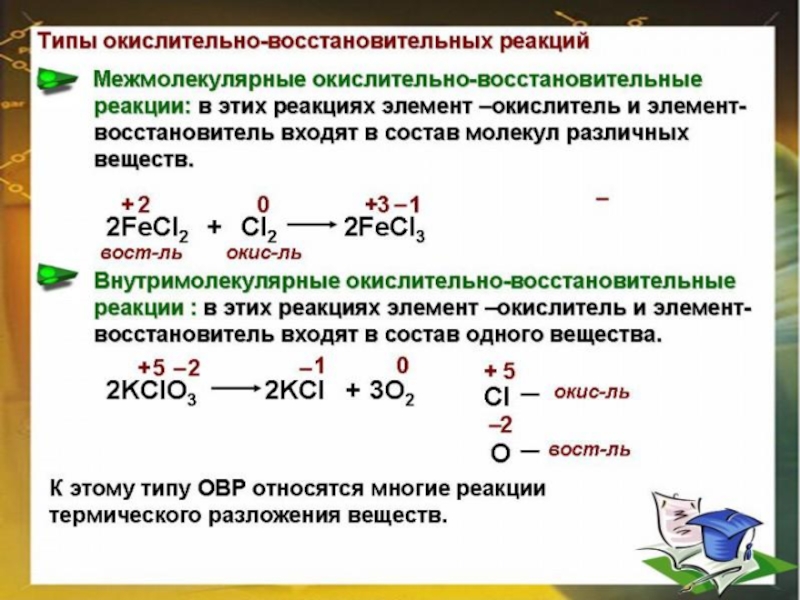
- 10. Классификация ОВР
- 11. Слайд 11
- 12. Слайд 12
- 13. Используя метод электронного баланса, преобразуйте схемы в
- 14. Т Е С ТУкажите ОВР:
- 15. K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + K2SO4 + S
Слайд 2 1.Е.Г.Рудзитис. «Химия». 9 класс. Учебник. 2. Тетрадь
Что нужно для урока?
Техника безопасности!
Слайд 3Расставьте степень окисления элементов в соединениях.
K2SO4 + BaCl2 → BaSO4
HCl + Al → AlCl3 + H2
Чем отличаются реакции?
Слайд 5ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ (ОВР)
– реакции, протекающие с изменением степени окисления.
ОВР –
Слайд 6Два антипода парою ходят, Первый – теряет; второй - находит, Ролью меняясь при
восстановитель
окислитель
Слайд 8 Алгоритм составления ОВР
Определить степени окисления элементов в соединениях, участвующих в
Выявить элемент, степень окисления которого понизилась, повысилась, окислитель и восстановитель.
Выявить число отданных и принятых электронов.
Слайд 9Расстановка коэффициентов с использованием метода электронного баланса.
1. Расставить степени окисления элементов
2. Подчеркнуть элементы, меняющие свою степень окисления.
3. Выписать элементы, меняющие степень окисления, количество отданных и принятых электронов.
Восстановитель
Окислитель
Окисление
Восстановление
4. Составить баланс электронов, указать восстановитель, окислитель, процессы окисления и восстановления.
2
3
6
3
2
5. Расставить коэффициенты, сначала полученные, затем методом подбора.
6HCl + 2Al = 2AlCl3 + 3H2
HCl + Al = AlCl3 + H2
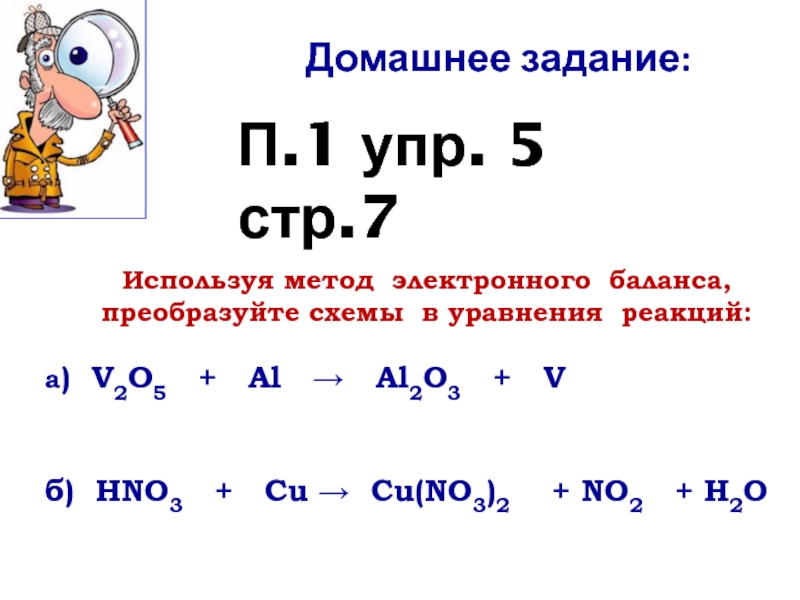
Слайд 13Используя метод электронного баланса,
преобразуйте схемы в уравнения реакций:
а) V2O5
б) HNO3 + Cu Cu(NO3)2 + NO2 + H2O
Домашнее задание:
П.1 упр. 5 стр.7
Слайд 14Т Е С Т
Укажите ОВР: а)
б) KOH + HCl = KCl + H₂O
в) CO₂ + CaO = CaCO₃
г) P₂O₅ + H₂O = 2HPO₃
ОТВЕТ: А
Укажите какие процессы происходят:
а) N⁰₂ - 4e→ 2N⁺²
б) S⁺⁶ + 2e→ S⁺⁴
в) Fe⁰ - 3e→ Fe⁺³
г) P⁺³ + 2e→ P⁺⁵
ОТВЕТ: а, в - окисление; б, г - восстановление
3. Cоставьте ОВР методом электронного баланса. Определите окислитель и восстановитель.
а) S + N₂O→ SO₂ + N₂ б) Br₂ + Zn → ZnBr₂
в) HBr + O₂ → H₂O + Br₂ г) Fe₂O₃ + H₂→ H₂O + Fe
Слайд 15K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + K2SO4 + S + H2O
K2MnO4 + H2O
NaBr + H2SO4 + NaBrO3 = Br2 + Na2SO4 + H2O
(NH4)2Cr2O7 = Cr2O3 + N2↑ + H2O