- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Окислительно-восстановительные реакции 8,9 класс
Содержание
- 1. Презентация Окислительно-восстановительные реакции 8,9 класс
- 2. Слайд 2
- 3. «Горение спички»Какой процесс мы наблюдаем?
- 4. Цель:Познакомиться с окислительно-восстановительными реакциями и выяснить,
- 5. Кто же главный герой
- 6. Повторение и обобщение изученного ранее
- 7. Слайд 7
- 8. Найти степень окисления химических соединений: 1) KMnO4, 2) Н2SО3 3) Мg CO3, 4) НСI
- 9. Второй вопрос: Учитель: Какие существуют правила определения степеней окисления?
- 10. Задание № 1. «Кто-то теряет, а кто-то
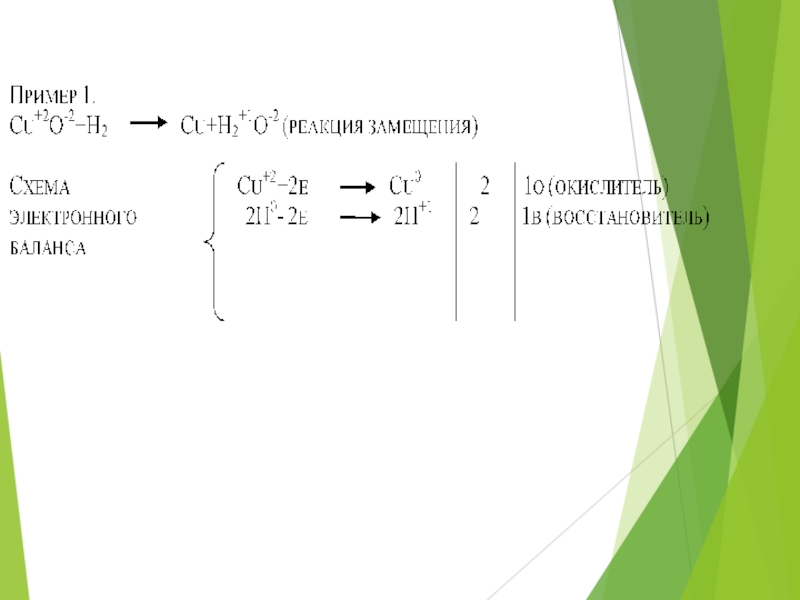
- 11. 1. Cu+2S+6O4-2 +2Na +1O-2H+1Cu +2(O -2H+1)2+Na2 +1S
- 12. Слайд 12
- 13. Что же представляют собой окислительно – восстановительные
- 14. Окислительно - восстановительные реакции – это такие
- 15. Слайд 15
- 16. Слайд 16
- 17. «В чем же заключается суть ОВР?» Окислительно-восстановительные
- 18. Закрепление знаний: Самостоятельная работа по инструктивной карте
- 19. Домашнее задание. Новый учебник § 66,67 Стр.
Слайд 2
Сами, трудясь, вы сделаете все
и для близких людей и для
а если при труде успеха не будет,
неудача – не беда, попробуйте ещё.
Д. И. Менделеев.
Девиз урока
«Кто-то теряет, а кто-то находит…»
Слайд 4
Цель:
Познакомиться с окислительно-восстановительными реакциями и выяснить, в чём отличие обменных
Научиться определять в реакциях окислитель и восстановитель.
Научиться составлять схемы процессов отдачи и принятия электронов.
Познакомиться с важнейшими окислительно-восстановительными реакциями, встречающимися в природе.
Тема урока:
«Окислительно-восстановительные реакции».
Слайд 5 Кто же главный герой окислительно-восстановительной реакции?
Слайд 6Повторение и обобщение изученного ранее
Первый вопрос:
«Что такое степень окисления?».
Слайд 10Задание № 1.
«Кто-то теряет, а кто-то находит…».
Почему
Чтобы ответить на данный вопрос, предлагаю провести небольшую лабораторную работу, используя инструкцию.
Опыт 1. Проведите химическую реакцию между растворами сульфата меди (II) и гидроксида натрия.
Опыт 2.
1. Поместите в раствор сульфата меди (II) железный гвоздь.
2. Составьте уравнения химических реакций.
3. Определите тип каждой химической реакции.
4. Определите степень окисления атома каждого химического элемента до реакции и после реакции.
5. Подумайте, чем отличаются эти реакции?
Слайд 111. Cu+2S+6O4-2 +2Na +1O-2H+1Cu +2(O -2H+1)2+Na2 +1S +6O4-2 – реакция обмена
2. Cu+2S+6O4-2 + Fe0 Fe+2 S+6O4 -2+Сu0 – реакция замещения
Cu+2 + 2 е- Сu0 – окислитель, восстанавливается
Fe0 - 2 е- Fe+2 - восстановитель, окисляется
Слайд 13
Что же представляют собой окислительно –
восстановительные реакции с точки зрения
«степень окисления химических элементов»?
Окислительно – восстановительные реакции – это
такие реакции, в которых одновременно
протекают процессы окисления и восстановления
и, как правило, изменяются степени окисления
элементов.
Слайд 14Окислительно - восстановительные реакции – это такие реакции, при которых происходит
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
4. Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.
Слайд 17«В чем же заключается суть ОВР?»
Окислительно-восстановительные реакции представляют собой единство
Вот почему выбран девиз урока:
« Кто-то теряет, а кто-то находит…»