Андреевна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тема Химические свойства оксидов и оснований
Содержание
- 1. Презентация на тема Химические свойства оксидов и оснований
- 2. Занятие 4. ЕГЭ по химии -Химические свойства оксидов, оснований. Рудакова Анастасия Андреевна
- 3. Физические свойства оксидовОсновные и амфотерные оксиды представляют собой твердые вещества разной окраски.
- 4. Большинство кислотных оксидов является газами (NO2 –
- 5. Растворимость оксидов в воде1.Все кислотные оксиды растворимы
- 6. Химические свойства основных оксидов1.осн.оксид + кислота =
- 7. Каждому кислотному оксиду соответствует кислотный остаток кислородсодержащей кислоты
- 8. Подобное можно рассчитать для любого кислотного остатка
- 9. 3.Осн. Оксид + H2O = щелочь СаО+Н2О=Са(ОН)2
- 10. Хим. Св-ва кислотных оксидов 1.Кислотный оксид +
- 11. Хим. Св-ва амфотерных оксидовАмфотерные оксиды в реакциях
- 12. Амфотерные оксиды в реакциях с основными оксидами,
- 13. Хим. Св-ва несолеобразующих оксидов1.N2O + H2 =
- 14. Получение оксидов1.Ме(НеМе)+О2 = оксид2Mg+O2 = 2MgO (t)C+O2
- 15. 4.Разложение нерастворимых оснований до основного оксида и
- 16. ПероксидыВ этих соединениях кислород имеет степень окисления -1.
- 17. Слайд 17
- 18. Д.з. 1.Доделать работу в классе.2.На фото “справочник химия. Оксиды” 1а,2а,3а,4а,5а,6а,7в,8в,9в,10в Привести реакции3.Тест “Оксиды”
- 19. Физические свойства оснований1.Растворимым являются основания Металлов lА
- 20. Химические свойства1.Изменение окраски индикатора
- 21. 2.Нетрализация Кислота+основание = соль + Н2ОHCl +
- 22. 5.Щелочь + Неметалл (Si, S, галогены) 2KOH
- 23. Получение1.Щелочные Ме (Щелочноземельные) + Н2О = щелочь + водород 2Na + 2H2O = 2NaOH + H2
- 24. НЕ ЗАБЫВАЕМ, ЧТО МНОГИЕ РЕАКЦИИ , КАСАЮЩИЕСЯ ОСНОВАНИЙ БЫЛИ ПРОЙДЕНЫ В ОКСИДАХ
- 25. Д.З. Фото: “Справочник химия. Основания” сделать 1а-5а ,7в, 8в, 9в, 11с ПРИВЕСТИ РЕАКЦИИ
Занятие 4. ЕГЭ по химии -Химические свойства оксидов, оснований. Рудакова Анастасия Андреевна
Слайд 3Физические свойства оксидов
Основные и амфотерные оксиды представляют собой твердые вещества разной
окраски.
Слайд 4Большинство кислотных оксидов является газами (NO2 – бурый газ, Cl2O –
темножелтого цвета)
Или бесцветные жидкости (N2O3 – синего цвета, ClO3 – тёмно-красного) бывают и твердые вещества (SiO2 , P2O5 , As2O5 - белого цвета, CrO3 – красно-фиолетового цвета)
Или бесцветные жидкости (N2O3 – синего цвета, ClO3 – тёмно-красного) бывают и твердые вещества (SiO2 , P2O5 , As2O5 - белого цвета, CrO3 – красно-фиолетового цвета)
Слайд 5Растворимость оксидов в воде
1.Все кислотные оксиды растворимы в воде , кроме
SiO2
2.Оксиды Ме IA и llA группы ,кроме Be и Mg являются растворимыми в воде.
3. Все амфотерные оксиды не растворяются в воде.
2.Оксиды Ме IA и llA группы ,кроме Be и Mg являются растворимыми в воде.
3. Все амфотерные оксиды не растворяются в воде.
Слайд 6Химические свойства основных оксидов
1.осн.оксид + кислота = соль + H2O
MgO +
2HCl = MgCl2 + H2O
2. осн. оксид + кисл. Оксид = соль
СаО+CO2 = CaCO3
2. осн. оксид + кисл. Оксид = соль
СаО+CO2 = CaCO3
Слайд 10Хим. Св-ва кислотных оксидов
1.Кислотный оксид + щелочь = соль +
H2O
N2O5 + Ba(OH)2 = Ba(NO3)2 +H2O
2.Кислотный оксид + Н2О = кислота
S(+6)O3+H2O = H2S(+6)O4
N2O5 + Ba(OH)2 = Ba(NO3)2 +H2O
2.Кислотный оксид + Н2О = кислота
S(+6)O3+H2O = H2S(+6)O4
Слайд 11Хим. Св-ва амфотерных оксидов
Амфотерные оксиды в реакциях с кислотами, кислотными оксидами
ведут себя как основные оксиды т.е. дают атом Ме на образование соли
1.Амф оксид + к-та = соль + Н2О
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2.Амф. Оксид + кисл. Оксид = соль (реакция идет при t)
ZnO+C(+4)O2 = ZnC(+4)O3
1.Амф оксид + к-та = соль + Н2О
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2.Амф. Оксид + кисл. Оксид = соль (реакция идет при t)
ZnO+C(+4)O2 = ZnC(+4)O3
Слайд 12Амфотерные оксиды в реакциях с основными оксидами, основаниями ведут себя как
кислотные оксиды т.е. дают кислотный остаток.
1.Амф. Оксид + щелочь = соль + Н2О
ZnO + 2KOH = K2ZnO2 + H2O (сплавление)
Если раствор щелочи:
ZnO + 2KOH + H2O = K2[Zn(OH)4] или может быть (ОН)6 раз.
2.амф. Оксид + осн. Оксид = соль (при нагревание)
ZnO+Na2O = Na2ZnO2 (температура)
1.Амф. Оксид + щелочь = соль + Н2О
ZnO + 2KOH = K2ZnO2 + H2O (сплавление)
Если раствор щелочи:
ZnO + 2KOH + H2O = K2[Zn(OH)4] или может быть (ОН)6 раз.
2.амф. Оксид + осн. Оксид = соль (при нагревание)
ZnO+Na2O = Na2ZnO2 (температура)
Слайд 13Хим. Св-ва несолеобразующих оксидов
1.N2O + H2 = N2 + H2O
CO +
H2O (пар) = CO2 + H2
10NO + 4P (красн) = 5N2 + P4O10
2NO + O2 = 2NO2
10NO + 4P (красн) = 5N2 + P4O10
2NO + O2 = 2NO2
Слайд 14Получение оксидов
1.Ме(НеМе)+О2 = оксид
2Mg+O2 = 2MgO (t)
C+O2 = CO2 (t)
2. Окисление
(горение,обжигание) сложных веществ.
C2H5OH+O2 = 2CO2 + 3H2O (t)
2ZnS + 3O2 = 2ZnO + 2SO2
3.Разложение оксокислот до кислотного оксида и воды.(в основном под действием катализаторов P2O5 или H2SO4 (конц))
H2S(+4)O3 = S(+4)O2 + H2O (t)
C2H5OH+O2 = 2CO2 + 3H2O (t)
2ZnS + 3O2 = 2ZnO + 2SO2
3.Разложение оксокислот до кислотного оксида и воды.(в основном под действием катализаторов P2O5 или H2SO4 (конц))
H2S(+4)O3 = S(+4)O2 + H2O (t)
Слайд 154.Разложение нерастворимых оснований до основного оксида и воды.
Cu(OH)2 = CuO +
H2O (t)
5.Разложение солей до основного оксида и кислотного оксида
-карбонаты
CaCO3 = CaO + CO2 (t)
-нитраты Ме средней активности
2Pb(NO3)2=2PbO+4NO2+O2 (t)
5.Разложение солей до основного оксида и кислотного оксида
-карбонаты
CaCO3 = CaO + CO2 (t)
-нитраты Ме средней активности
2Pb(NO3)2=2PbO+4NO2+O2 (t)
Слайд 18Д.з. 1.Доделать работу в классе.
2.На фото “справочник химия. Оксиды” 1а,2а,3а,4а,5а,6а,7в,8в,9в,10в Привести
реакции
3.Тест “Оксиды”
3.Тест “Оксиды”
Слайд 19Физические свойства оснований
1.Растворимым являются основания Металлов lА группы и llА группы
(кроме Be, Mg)
2.Все твердые вещества, кроме NH4OH
3.Имеют разный цвет
Cr(OH)2 желтый
Ni(OH)2, Cr(OH)3 зеленые
Co(OH)2 розовый
Сu(OH)2 – синий
Fe(OH)3 – бурый
2.Все твердые вещества, кроме NH4OH
3.Имеют разный цвет
Cr(OH)2 желтый
Ni(OH)2, Cr(OH)3 зеленые
Co(OH)2 розовый
Сu(OH)2 – синий
Fe(OH)3 – бурый
Слайд 212.Нетрализация
Кислота+основание = соль + Н2О
HCl + KOH = KCl +
H2O
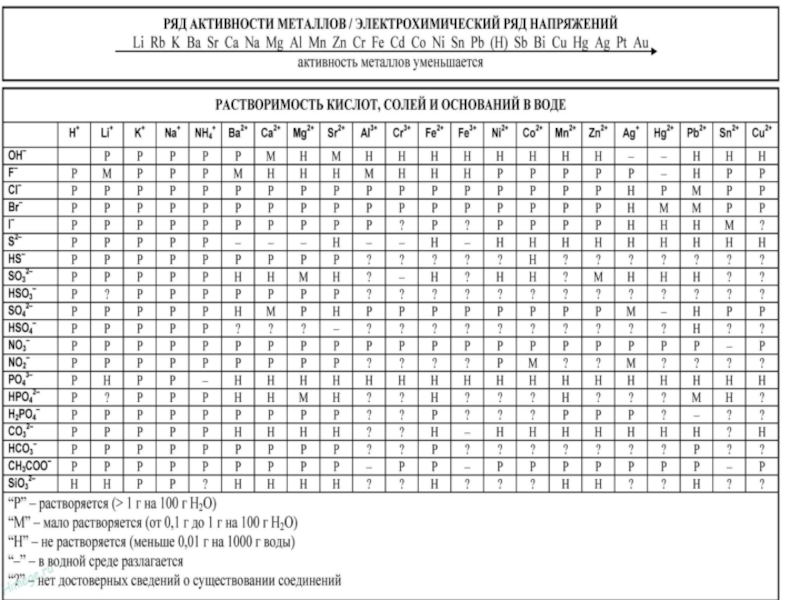
3.р-р щелочи + р-р соли (растворимая, смотреть табл. Растворимости) = новое основание + новая соль (ОБЯЗАТЕЛЬНО ОСАДОК)
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
4. щелочь + амфотерный Металл = соль + водород (сплавление при t)
Zn + 2NaOH = Na2ZnO2 + H2
р-р щелочи + амф. Металл = комплексная соль + водород
Al + NaOH = Na3[Al(OH)6] + H2 или Na[Al(OH)4] зависит от концентрации щелочь, чем она больше, тем больше ОН групп.
3.р-р щелочи + р-р соли (растворимая, смотреть табл. Растворимости) = новое основание + новая соль (ОБЯЗАТЕЛЬНО ОСАДОК)
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
4. щелочь + амфотерный Металл = соль + водород (сплавление при t)
Zn + 2NaOH = Na2ZnO2 + H2
р-р щелочи + амф. Металл = комплексная соль + водород
Al + NaOH = Na3[Al(OH)6] + H2 или Na[Al(OH)4] зависит от концентрации щелочь, чем она больше, тем больше ОН групп.
Слайд 225.Щелочь + Неметалл (Si, S, галогены)
2KOH + Cl2 = KCl
+ KClO + H2O (на холоде или при нормальной температура, ДЛЯ ВСЕХ ГАЛОГЕНОВ)
KOH + Cl2 = KCl + KClO3 + H2O (при нагревание , ДЛЯ ВСЕХ ГАЛОГЕНОВ)
2NaOH + Si + H2O = Na2SiO3 + 2 H2
KOH + Cl2 = KCl + KClO3 + H2O (при нагревание , ДЛЯ ВСЕХ ГАЛОГЕНОВ)
2NaOH + Si + H2O = Na2SiO3 + 2 H2