- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Строение атома(8 класс)
Содержание
- 1. Презентация к уроку Строение атома(8 класс)
- 2. ИнформированиеИз истории. Демокрит.Модель ТомсонаОпыт Резерфорда. Планетарная модель.Строение
- 3. ДемокритВ основе философии Демокрита лежит учение об
- 4. Модель ТомсонаВ 1904 году Томсон представил свою
- 5. Опыт Резерфорда Резерфорд исследовал особенности
- 6. Планетарная модель Резерфордав центре атома расположено положительно
- 7. Протон Нейтрон
- 8. Слайд 8
- 9. Атом – микрочастица, имеющая форму шара.Атом состоит
- 10. Строение атома
- 11. Периодическая система и строение атомаЧисло протоновЧисло электроновЗаряд
- 12. НАПРИМЕР6 протонов6 электронов6 нейтронов
- 13. Строение атома
- 14. У кислорода порядковый номер равен 8 ,поэтому
- 15. Практическая часть Закончи определенияАТОМ –это …ОРБИТАЛЬ –это…ПОРЯДКОВЫЙ НОМЕР –показывает …
- 16. АТОМ - мельчайшая , химически неделимая, частицаОРБИТАЛИ
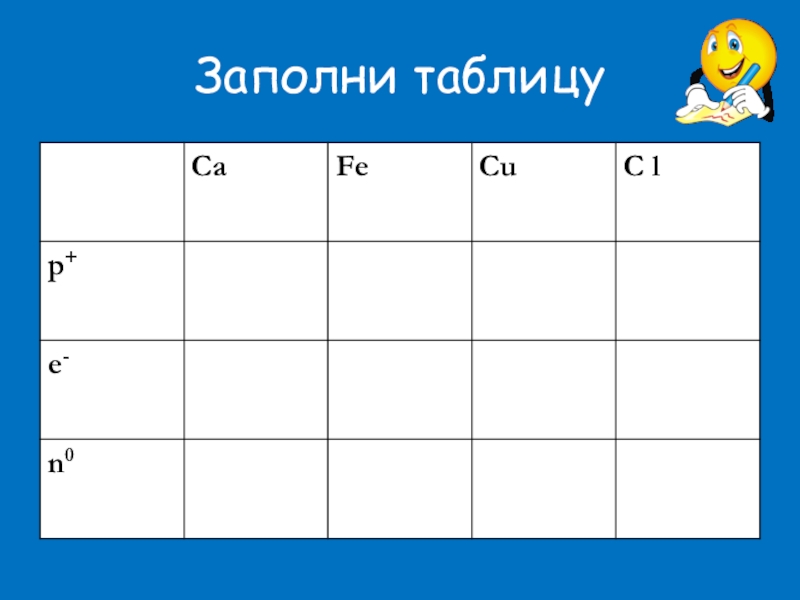
- 17. Заполни таблицу
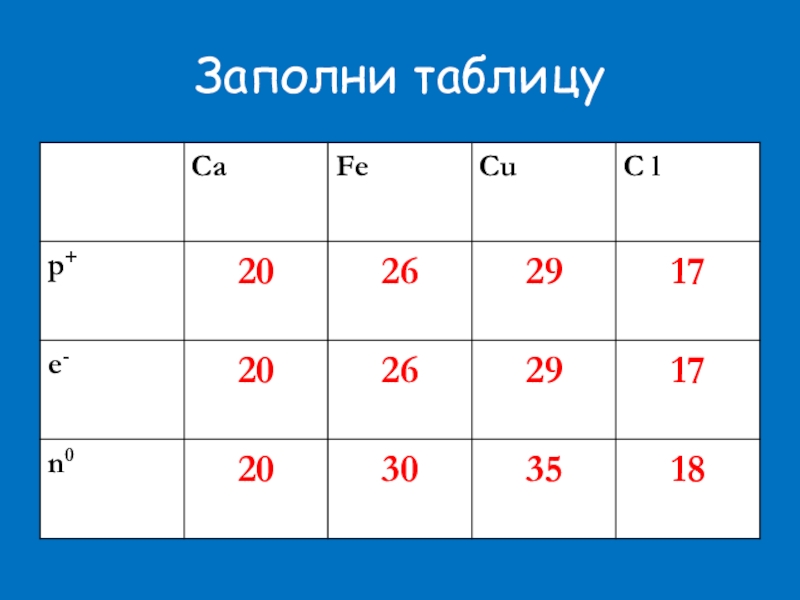
- 18. Заполни таблицу
- 19. Домашнее задание§ 6 Упр .3 ( письменно)
- 20. Тестовые заданияЗаряд ядра атома азота равен : а)
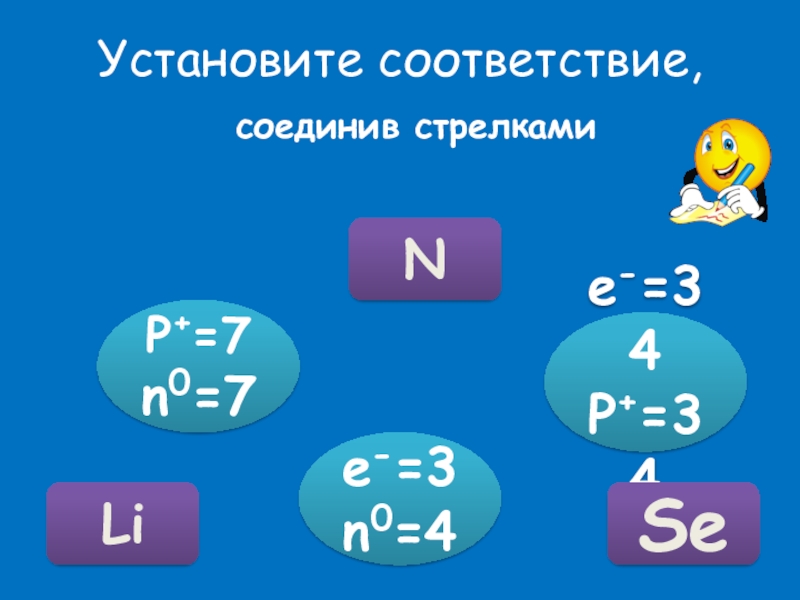
- 21. Установите соответствие, соединив стрелкамиP+=7n0=7e-=34P+=34e-=3n0=4NSeLi
- 22. Тестовые заданияЗаряд ядра атома азота равен :а)
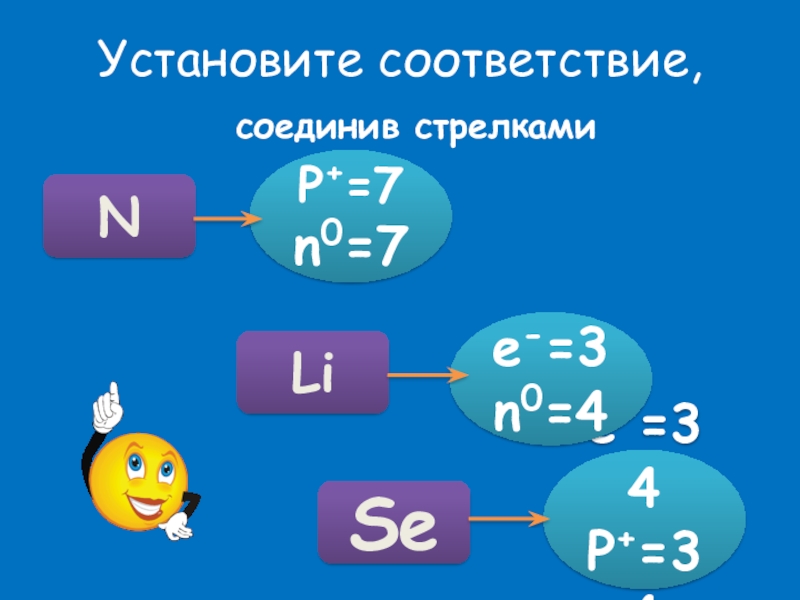
- 23. Установите соответствие, соединив стрелкамиP+=7n0=7e-=34P+=34e-=3n0=4NSeLi
- 24. Желаю дальнейших успехов в изучении химии!
Слайд 2Информирование
Из истории. Демокрит.
Модель Томсона
Опыт Резерфорда. Планетарная модель.
Строение атома
Обсудим некоторые термины
Периодическая система
Практическая часть.
Заполни таблицу.
Закончи определения .
Контроль.
Выполни тест.
Установи соответствие.
ПЛАН УРОКА
Слайд 3Демокрит
В основе философии Демокрита лежит учение об атомах и пустоте как
Слайд 4Модель Томсона
В 1904 году Томсон представил свою новую модель атома. Она
« Пудинг с изюмом »
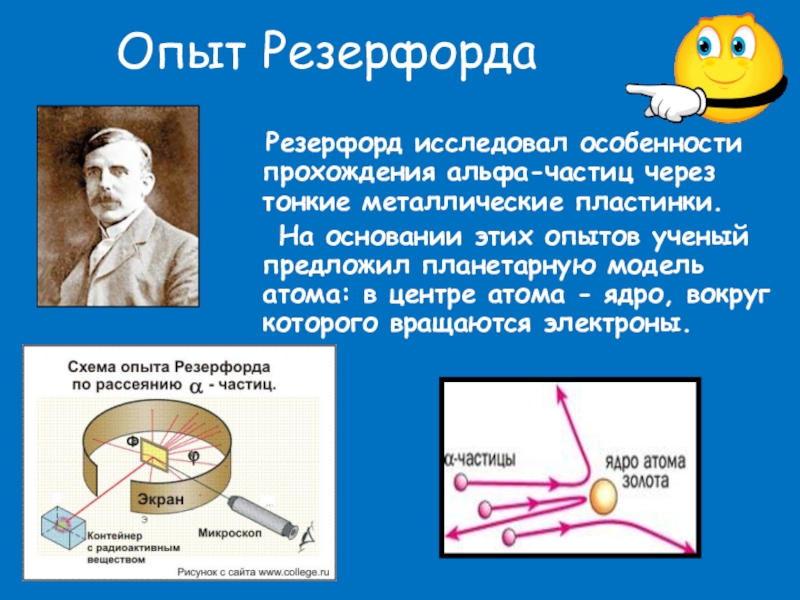
Слайд 5Опыт Резерфорда
Резерфорд исследовал особенности прохождения альфа-частиц через тонкие
На основании этих опытов ученый предложил планетарную модель атома: в центре атома - ядро, вокруг которого вращаются электроны.
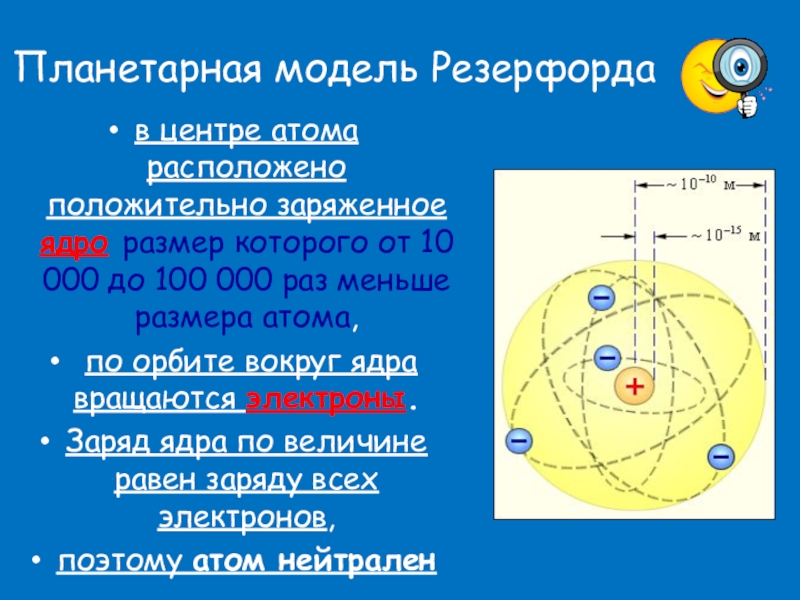
Слайд 6Планетарная модель Резерфорда
в центре атома расположено положительно заряженное ядро размер которого
по орбите вокруг ядра вращаются электроны.
Заряд ядра по величине равен заряду всех электронов,
поэтому атом нейтрален
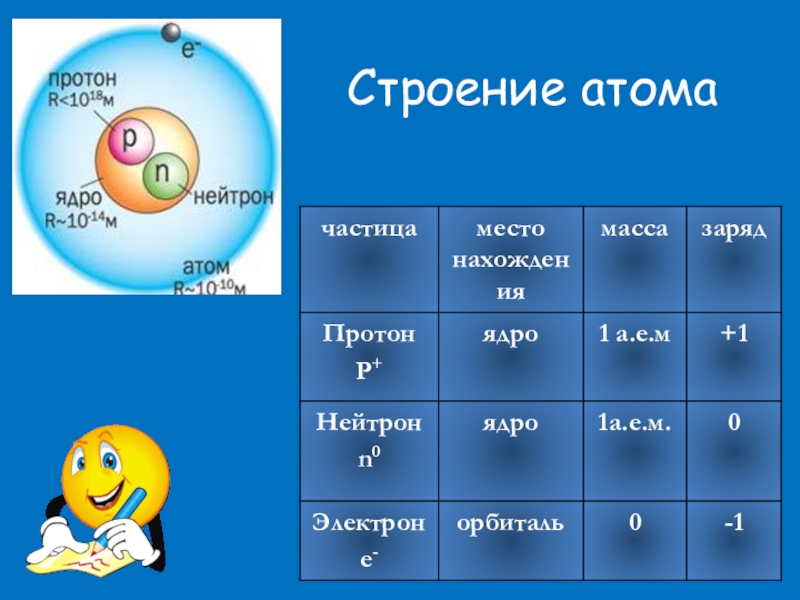
Слайд 7Протон Нейтрон P+
«Нуклеус» (латинское nucleus) – ядро.
Масса атома сосредоточена в ядре.
Поэтому эта модель называется - нуклеарная.
Атом Ядро Электронная оболочка Состоит из нуклонов Состоит из электронов (ē)
Слайд 9Атом – микрочастица, имеющая форму шара.
Атом состоит из ядра и электронов.
Ядро
(r (атома) / r (ядра) = 100000).
Ядро имеет положительный заряд.
Атом – электронейтрален, так как число протонов и электронов одинаково.
Электроны обладают отрицательным зарядом и движутся вокруг ядра.
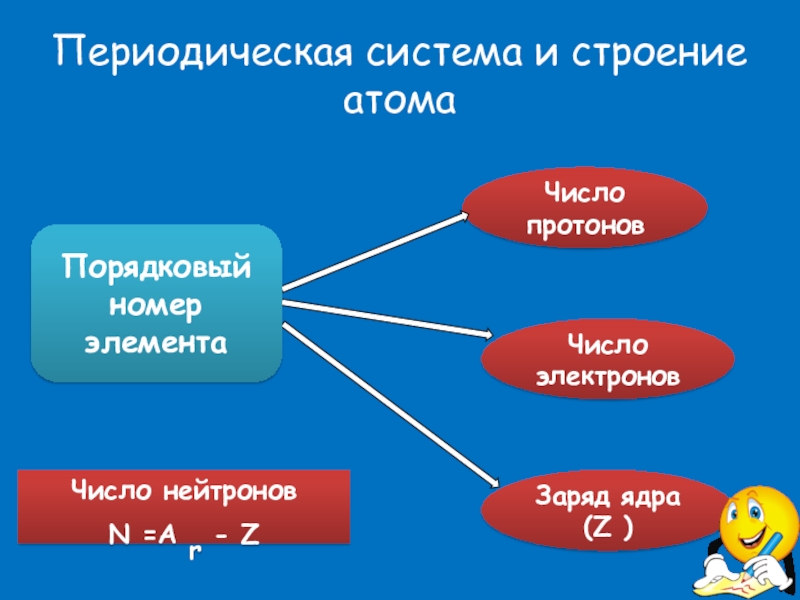
Слайд 11Периодическая система и строение атома
Число протонов
Число электронов
Заряд ядра (Z )
Число нейтронов
Порядковый номер элемента
Слайд 13 Строение атома на примере О
1)Число протонов
2)Что бы найти число нейтронов,
нужно из молекулярной массы элемента вычесть количество протонов или электронов.
Слайд 14 У кислорода порядковый номер
равен 8 ,
поэтому число электронов и протонов
а молекулярная масса кислорода равна 16,
поэтому чтобы найти число нейтронов
надо из 16
(молекулярной массы кислорода)
вычесть заряд ядра
(или число протонов или число электронов)
Слайд 15Практическая часть
Закончи определения
АТОМ –это …
ОРБИТАЛЬ –это…
ПОРЯДКОВЫЙ НОМЕР –показывает …
Слайд 16АТОМ - мельчайшая , химически неделимая, частица
ОРБИТАЛИ - место расположения электрона
ПОРЯДКОВЫЙ НОМЕР –показывает количество электронов и протонов
Слайд 20Тестовые задания
Заряд ядра атома азота равен :
а) 7 б)
Число протонов в ядре атома криптона
а ) 36 б) 17 в) 4 г) 31 д) 6
Число нейтронов в ядре атома цинка :
а) 8 б) 35 в)11 г)30 д)4
Число электронов в атоме железа :
а) 11 б)8 в)56 г)26 д)30
Слайд 22Тестовые задания
Заряд ядра атома азота равен :
а) 7 б)
Число протонов в ядре атома криптона :
а ) 36 б) 17 в) 4 г) 31 д) 6
Число нейтронов в ядре атома цинка :
а) 8 б) 35 в)11 г)30 д)4
Число электронов в атоме железа :
а) 11 б)8 в)56 г)26 д)30