- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку по химии 9 класса Соединения серы. Оксиды.
Содержание
- 1. Презентация к уроку по химии 9 класса Соединения серы. Оксиды.
- 2. Слайд 2
- 3. Оксиды серыСоединения серы§ 27, упр. 2-5 стр. 204, р.т.
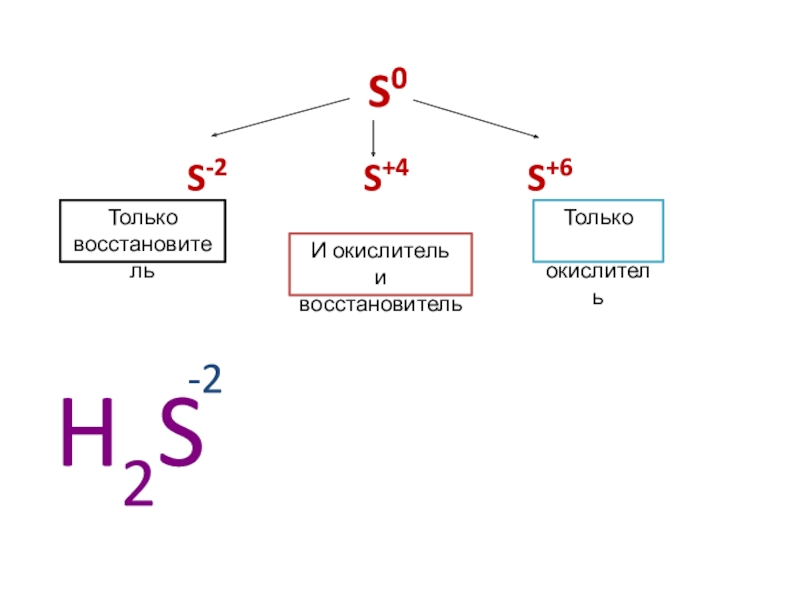
- 4. S0S-2S+4S+6H2S-2Только восстановительТолько окислительИ окислитель и восстановитель
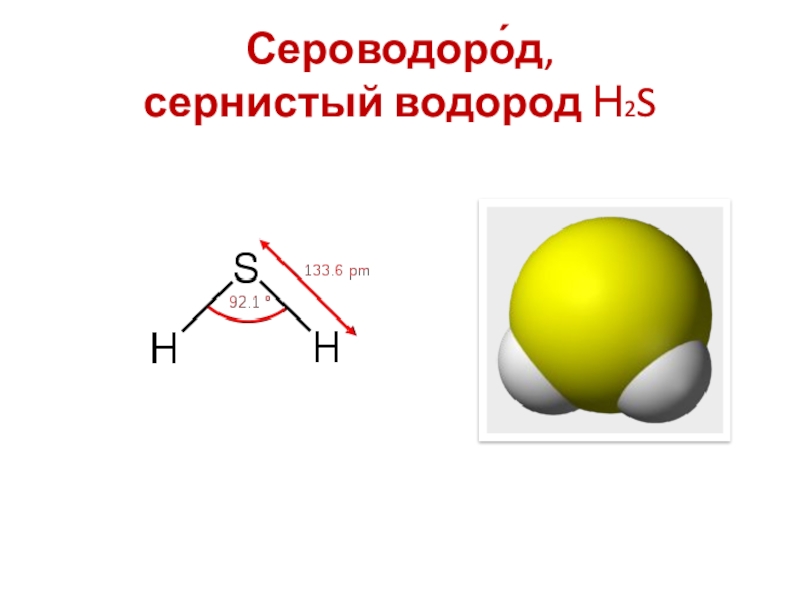
- 5. Сероводоро́д, сернистый водород Н2S
- 6. Сероводоро́д, сернистый водород Н2SОбщиеСистематическое наименование сероводородХимическая
- 7. Сероводоро́д, сернистый водород Н2SБесцветный газ с
- 8. Задание:Напишите УХР горения сероводорода, укажите условия их протекания (стр. 196)
- 9. Рис. 120 стр. 196
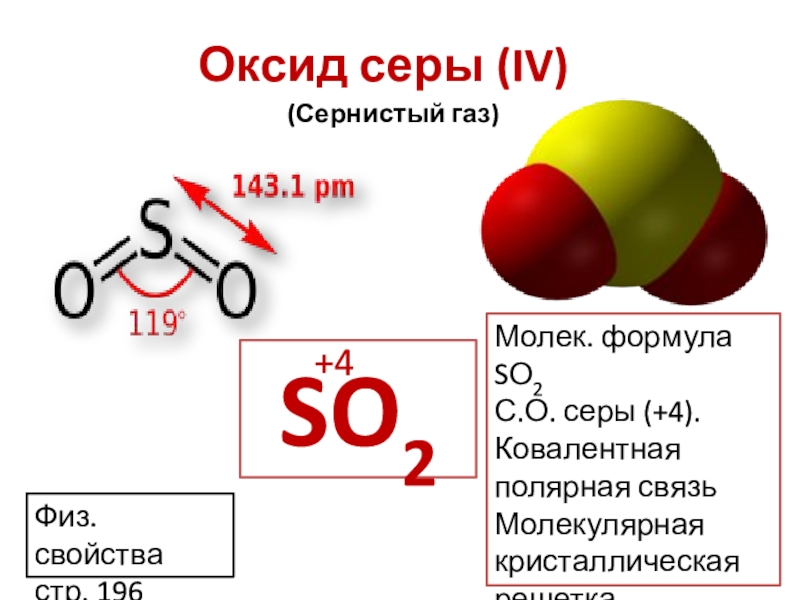
- 10. Оксид серы (IV)SO2+4(Сернистый газ)Молек. формула SО2С.О. серы (+4). Ковалентная полярная связьМолекулярная кристаллическая решеткаФиз. свойства стр. 196
- 11. «Последний день Помпеи»При извержении Везувия в Римской
- 12. Сернистая кислота очень неустойчива и разлагается на
- 13. Качественная реакция на сульфит-ионы — 1. обесцвечивание
- 14. 1. Кислотный оксид +Вода= Кислота SO2
- 15. Оксид серы (VI)Се́рный ангидри́д, трео́кись се́ры, се́рный
- 16. Получение оксида серы (VI)Получают, окисляя оксид серы(IV)
- 17. Оксид серы (VI) Химические свойства1. Кислотно-основные: SO3
- 18. Оксид серы (VI) Химические свойства2. Окислительно-восстановительные: SO3
- 19. Серная кислота Н2 SO4Серная кислота - бесцветная
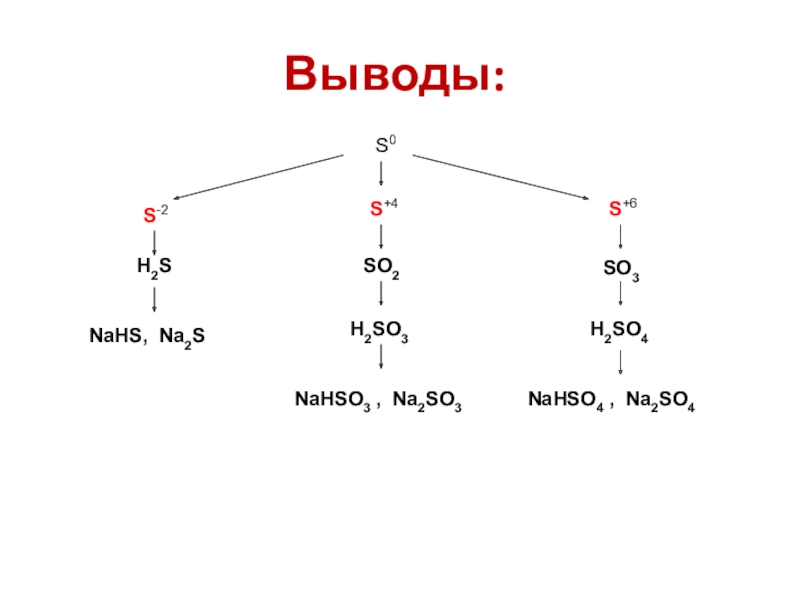
- 20. Выводы:S0S-2S+4S+6SO2 SO3H2SNaНSО3 , Na2SО3 NaНSО4 , Na2SО4
- 21. § 27, упр. 2-5 стр. 204, р.т.
- 22. Интернет ресурсы:http://nsportal.ru/shkola/khimiya/library/2015/08/13/razrabotka-uroka-v-9-klasse-tema-soedineniya-seryhttps://yandex.ru/images/search?p=21&text=сульфиды&noreask=1&lr=102555https://ru.wikipedia.org/wiki/Оксид_серы(IV)http://www.studfiles.ru/preview/1149967/https://yandex.ru/images/search?text=оксиды%20серы%20и%20их%20свойства&stype=image&lr=102555&noreask=1&parent-reqid=1481820670477317-34620356146574742961794-sas1-5732&source=wizhttp://ru.solverbook.com/spravochnik/ximiya/9-klass/soedineniya-sery/
Слайд 1§ 27, упр. 2-5 стр. 204, р.т.
подготовить сообщение/ презентацию на
«Применение серной кислоты в промышленности»,
«Применение серной кислоты в медицине,
«Соединения серы в природе»,
«Осторожно! Соединения серы!».
Слайд 6Сероводоро́д,
сернистый водород Н2S
Общие
Систематическое наименование сероводород
Химическая формула H2S
Отн. молек. Масса 34.082 а. е. м.
Молярная
Физические свойства
Состояние (ст. усл.)бесцветный газ
Плотность1.5392 г/л г/см³
Термические свойства
Температура плавления-82.30 °C
Температура кипения-60.28 °C
Растворимость в воде0.25 (40 °C) г/100 мл
Слайд 7Сероводоро́д,
сернистый водород Н2S
Бесцветный газ с неприятным запахом (тухлого яйца) и
В природе встречается очень редко в виде смешанных веществ нефти и газа. Имеет очень неприятный запах, вреден для лёгких и всего организма. Сейчас сероводород используют в лечебных целях, например, в сероводородных ваннах
H2S является очень слабой сероводородной кислотой.
Слайд 10Оксид серы (IV)
SO2
+4
(Сернистый газ)
Молек. формула SО2
С.О. серы (+4).
Ковалентная полярная связь
Молекулярная
Физ. свойства
стр. 196
Слайд 11«Последний день Помпеи»
При извержении Везувия в Римской
империи погибло много
людей
при землетрясении.
Назовите ещё одну причину, которая вызвала
гибель людей.
Сернистый газ выделяется
из трещин пород с кристаллической
серой.
К. П. Брюллов
Пользуясь учебником и конспектом
напишите известные вам способы получения
сернистого газа.
Назовите вещество, в которое превращается
сернистый газ при растворении его в воде.
Напишите уравнение этой реакции.
H2O + SO2 = H2SO3
Слайд 12Сернистая кислота очень неустойчива и разлагается на
исходные вещества:
Сернистая кислота двухосновная
NaHSO3
Гидросульфит
натрия
Na2SO3
Сульфит
натрия
Какого применение солей сернистой кислоты? (стр. 196). Записать в тетрадь
Слайд 13Качественная реакция на сульфит-ионы —
1. обесцвечивание раствора перманганата калия:
Запишите
2. Взаимодействие соли с сильной кислотой, при этом выделяется газ с резким запахом
Na2SO3+H2SO4=Na2SO4+S02+H2O
2NaHSO3+H2SO4=Na2SO4+2SO2+2H2O
2HSO3-+2H+=2SO2+2H2O
Слайд 141. Кислотный оксид +Вода= Кислота
SO2 + H2O = H2SO3
2.
SO2 + 2KOH = K2SO3 + H2O
SO2 + 2OH - = SO3 2- + H2O
3. Основной оксид + Кислотный оксид = Соль
CaO + SO2 = CaSO3
Химические свойства оксида серы (IV)
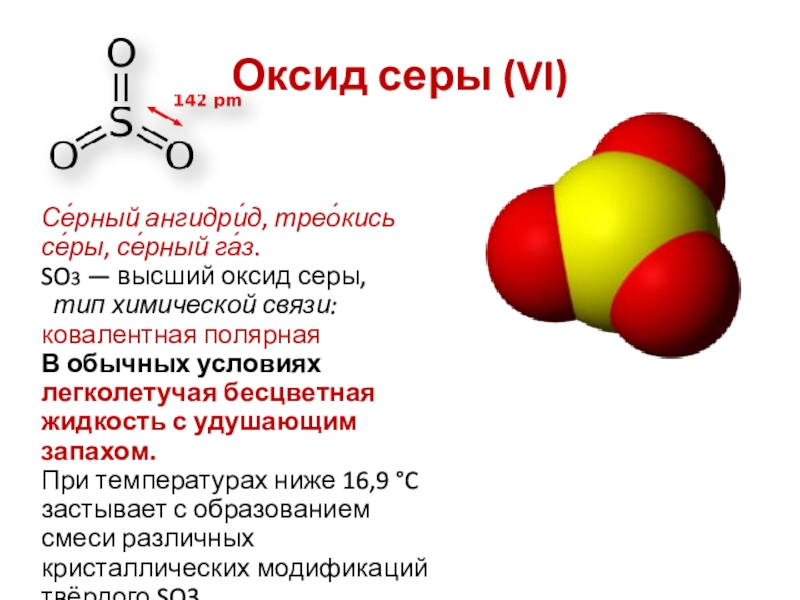
Слайд 15Оксид серы (VI)
Се́рный ангидри́д, трео́кись се́ры, се́рный га́з.
SO3 — высший
тип химической связи: ковалентная полярная
В обычных условиях легколетучая бесцветная жидкость с удушающим запахом.
При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Слайд 16Получение оксида серы (VI)
Получают, окисляя оксид серы(IV) кислородом воздуха при нагревании,
2SO2 + O2 → 2SO3 + Q.
Можно получить термическим разложением сульфатов:
Fe2(SO4)3 → Fe2O3 + 3SO3,
или взаимодействием SO2 с озоном:
SO2 + O3 → SO3 + O2↑.
Для окисления SO2 используют также NO2:
SO2 + NO2 → SO3 + NO↑.
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Слайд 17Оксид серы (VI)
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид
При взаимодействии с водой образует серную кислоту:
SO3 + H2O → H2SO4.
Взаимодействует с основаниями:
2KOH + SO3 → K2SO4 + H2O,
основными оксидами:
CaO + SO3 → CaSO4,
c амфотерными оксидами:
3SO3 + Al2O3 → Al2(SO4)3.
SO3 растворяется в 100%-й серной кислоте, образуя олеум:
H2SO4 (100 %) + SO3 → H2S2O7.
Слайд 18Оксид серы (VI)
Химические свойства
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается,
5SO3 + 2P→ P2O5 + 5SO2
3SO3 + H2S → 4SO2 + H2O
2SO3 + 2KI → SO2 + I2 + K2SO4.
3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:
SO3 + HCl → HSO3Cl
Также присоединяет хлор, образуя тионилхлорид:
SO3 + Cl2 + 2SCl2 → 3SOCl2
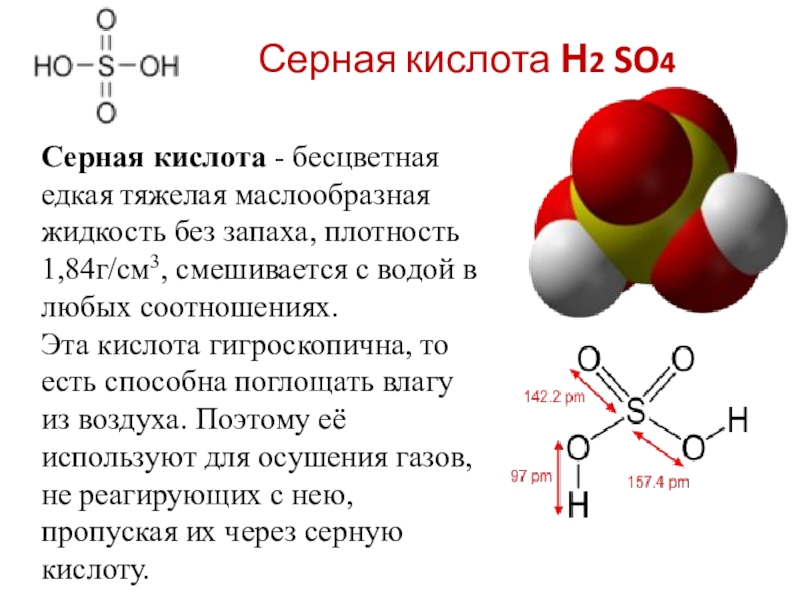
Слайд 19Серная кислота Н2 SO4
Серная кислота - бесцветная едкая тяжелая маслообразная жидкость
Слайд 21§ 27, упр. 2-5 стр. 204, р.т.
подготовить сообщение/ презентацию на
«Применение серной кислоты в промышленности»,
«Применение серной кислоты в медицине,
«Соединения серы в природе»,
«Осторожно! Соединения серы!».