- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии в 11 классе Обратимость химических реакций. Химическое равновесие
Содержание
- 1. Презентация к уроку химии в 11 классе Обратимость химических реакций. Химическое равновесие
- 2. Обратимые и необратимые химические реакцииХимические реакции, протекающие
- 3. Химическое равновесие с, моль
- 4. Слайд 4
- 5. Химическое равновесие -
- 6. Принцип Ле-Шателье: Если на
- 7. Французский физикохимик и металловед. Сформулировал (1884) общий
- 8. В каком направлении
Слайд 2Обратимые и необратимые химические реакции
Химические реакции, протекающие в одном направлении, называются
Химические реакции, протекающие при одних и тех же условиях одновременно в двух противоположных направлениях, называются обратимыми
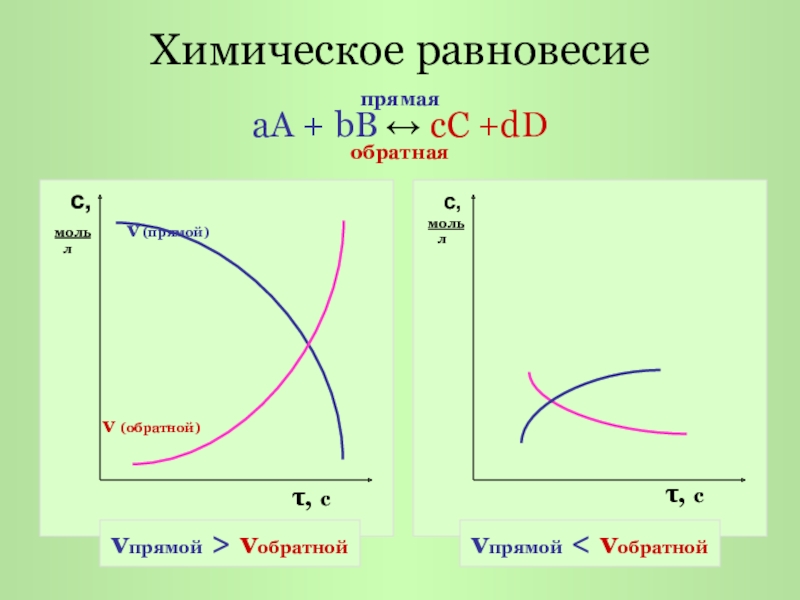
Слайд 3Химическое равновесие
с,
моль v
л
v (обратной)
τ, с
с,
моль
л
τ, с
прямая
аА + bB ↔ cC +dD
обратная
vпрямой > vобратной
vпрямой < vобратной
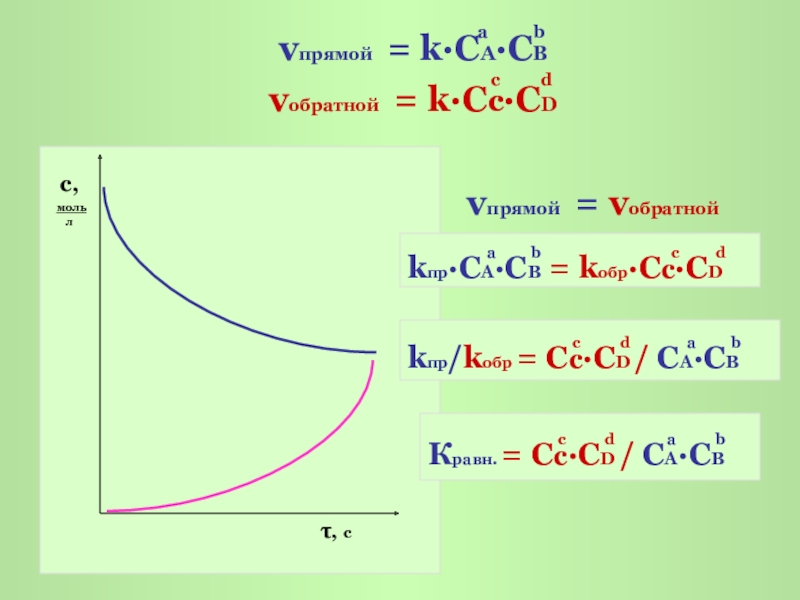
Слайд 4
с,
моль
л
τ, с
vпрямой = vобратной
a b с d
kпр·CA·СB = kобр·Cс·СD
с d a b
kпр/kобр = Cс·СD / CA·СB
с d a b
Кравн. = Cс·СD / CA·СB
Слайд 5 Химическое равновесие - состояние
системы, при котором
реакции равна скорости обратной реакции.
Химическое равновесие – подвижное (динамическое)
Напишите выражения констант равновесия для обратимых реакций, протекающих по следующим схемам:
а) N2(г) + H2(г) ↔ NH3(г)
б) Zn(тв) + Н2О(г) ↔ ZnO(тв) + Н2(г)
в) HI(г) ↔ H2(г) + I2(г)
г) CO(г) +Cl2(г) ↔ COCl2(г)
д) Cu(тв) + Ag+(р-р) ↔ Cu²+(р-р) + Ag(тв)
е) NO(г) + O2(г) ↔ NO2(г)
ж) CO(г) + H2(г) ↔ CH4(г) + CO2(г)
Слайд 6Принцип Ле-Шателье:
Если на систему, находящуюся в равновесии,
внешнее воздействие (изменяются концентрация, температура,
давление), то равновесие смещается в сторону той реакции,
которая ослабляет это воздействие
1. Концентрация:
а) при увеличении концентрации исходных веществ равновесие смещается в сторону прямой реакции (вправо);
б) при увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции (влево).
2. Температура:
При увеличении температуры равновесие всегда смещается в
сторону эндотермической реакции.
3. Давление:
При увеличении давления равновесие смещается в сторону той
реакции, которая приводит к уменьшению объёмов газообразных
веществ.
Слайд 7Французский физикохимик и
металловед. Сформулировал (1884)
общий закон смещения химического
равновесия,
внешнем воздействии на равновесную
систему химическое равновесие
смещается в сторону, противо-
положную этому воздействию
(принцип Ле Шателье). Изучал
химические процессы в металлургии.
Сконструировал термоэлектрический
пирометр. Создал металлографический
микроскоп и усовершенствовал
методику исследования строения
металлов и сплавов. Изучал свойства и
способы приготовления цементов.
Изобрел платинородиевую термопару.
Независимо от Ф. Габера нашел (1901)
условия синтеза аммиака.
Ле Шателье Анри Луи
(8.10.1850–7.09.1936)
Слайд 8 В каком направлении сместится химическое
равновесие в
а) SO3(г) ↔ SO2(г) + O2(г) – Q
б) C2H6(г) ↔ C2H4(г) + H2(г) – Q
в) Fe3O4(тв) + CO(г) ↔ Fe(тв) + CO2(г) – Q
г) CH4(г) + S(ж) ↔ CS2(г) + H2S(г) + Q
д) CO2(г) + C(тв) ↔ CO(г) + Q
е) CO(г) + H2O(г) ↔ CO2(г) + H2(г) + Q
ж) С2H4(г) + H2O(ж) ↔ C2H5OH(р-р) + Q
а) при увеличении концентрации; б) при нагревании;
в) при уменьшении давления?
Напишите выражение константы равновесия в
системах и укажите её примерное значение.