- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии в 10 классе Алканы
Содержание
- 1. Презентация к уроку химии в 10 классе Алканы
- 2. Состав алканов Алканы – углеводороды с
- 3. Гомологический ряд алкановАлканы, имея общую формулу СnH2n+2,
- 4. Строение алканов В алканах имеются
- 5. Строение метана и этанаВ алканах атомы углеродаимеют
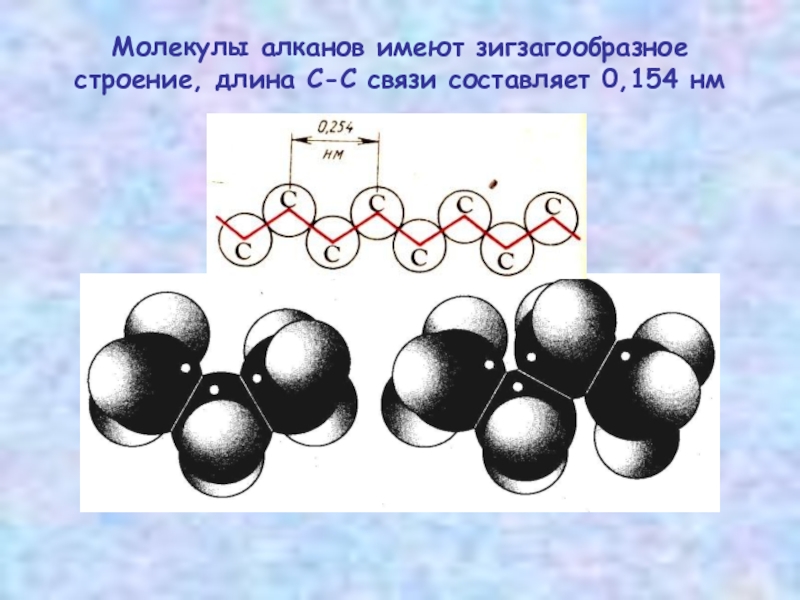
- 6. Молекулы алканов имеют зигзагообразное строение, длина С-С связи составляет 0,154 нм
- 7. Изомерия и номенклатура алканов Для
- 8. Изомерия алканов Изомерия – явление
- 9. Приёмы построения структурных формул изомеров
- 10. Основы систематической номенклатуры ИЮПАК (Международный союз
- 11. Физические свойства алканов С увеличением Мr
- 12. Слайд 12
- 13. Химические свойства алканов Химические свойства
- 14. Химическиесвойства алканов
- 15. Горение – полное окисление
- 16. Крекинг (частичное разложение)⮛ Термический крекинг заключается в
- 17. Радикальное замещение Н
- 18. Замещение у хлорметана идёт
- 19. Отщепление При повышенной температуре на
- 20. Получение алканов Алканы выделяют из
- 21. Синтез алканов Галогенопроизводные алканов широко
- 22. Галогеналканы Галогенопроизводные алканов (галогеналканы) имеют
- 23. Применение алканов Предельные углеводороды находят
- 24. Проверка знанийКакие УВ относятся к алканам?Почему в
- 25. Тест 1. Состав алканов отражает общая формула
- 26. 6. С какими реагентами могут взаимодействовать алканы:
- 27. Ответы: 1 - б 2 – бвг
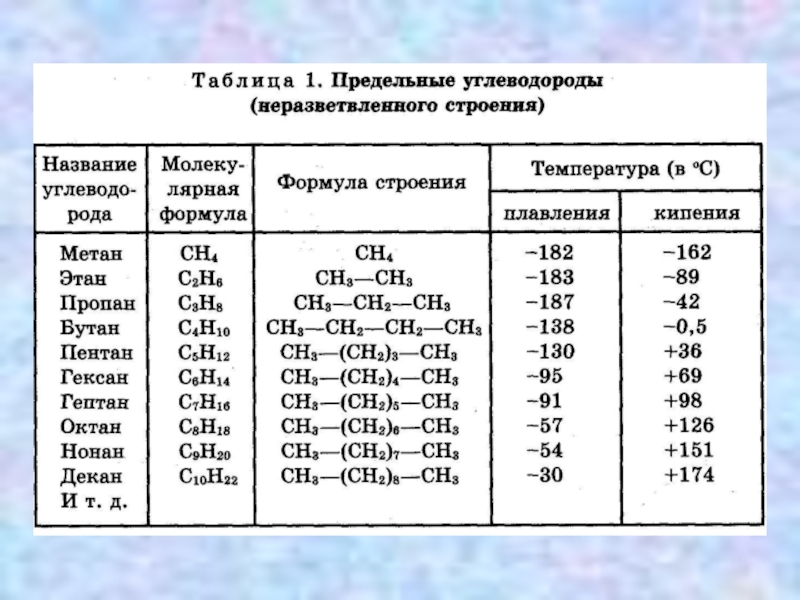
Слайд 2Состав алканов
Алканы – углеводороды с общей формулой СnH2n+2,
CH4 метан
C2H6 этан СН3 – СН3
C3H8 пропан СН3 – СН2 – СН3
C4H10 бутан СН3 – СН2 – СН2 – СН3
C5H12 пентан СН3 – СН2 – СН2 – СН2 – СН3
C6H14 гексан СН3 – СН2 – СН2 – СН2 – СН2 – СН3
C7H16 гептан и так далее
C8H18 октан
C9H20 нонан
C10H22 декан
Слайд 3Гомологический ряд алканов
Алканы, имея общую формулу СnH2n+2, представляют собой ряд родственных
соединений
от предыдущего на постоянную группу атомов (-CH2-). Такая последовательность
соединений называется гомологическим рядом (от греч. homolog – сходный), отдельные
члены этого ряда – гомологами, а группа атомов, на которую различаются соседние
гомологи, – гомологической разностью.
Гомологический ряд алканов легко составить, прибавляя каждый раз к предыдущей
цепочке новый атом углерода и дополняя его оставшиеся валентности до 4-х атомами
водорода. Другой вариант – добавление в цепь группы -СН2-:
CH4 или Н-СН2-Н – первый член гомологического ряда – метан (содержит 1 атом
углерода);
CH3−CH3 или Н-СН2-СН2-Н – 2-й гомолог – этан (2 атома С);
CH3−CH2−CH3 или Н-СН2-СН2-СН2-Н – 3-й гомолог – пропан (3 атома С);
CH3−CH2−CH2−CH3 или Н-СН2-СН2-СН2-СН2-Н – бутан (4 атома С)
Суффикс -ан является характерным для названия всех алканов. Начиная с пятого
гомолога, название алкана образуется из греческого числительного, указывающего число
атомов углерода в молекуле, и суффикса –ан: пентан С5Н12, гексан С6Н14, гептан С7Н16,
октан С8Н18, нонан С9Н20, декан С10Н22 и т.д.
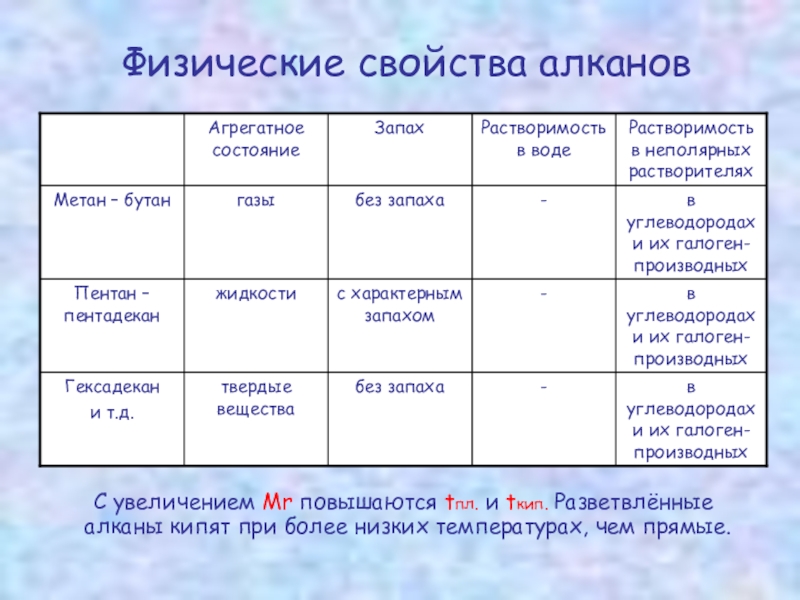
Гомологи отличаются молекулярной массой и, следовательно, физическими
характеристиками. С увеличением числа углеродных атомов в молекуле алкана (с ростом
молекулярной массы) в гомологическом ряду наблюдается закономерное изменение
физических свойств гомологов (переход количества в качество): повышаются температуры
кипения и плавления, увеличивается плотность. Алканы от СН4 до С4Н10 – газы, от С5Н12
до С17Н36 – жидкости, далее – твердые вещества.
Гомологи, имея одинаковый качественный состав и однотипные химические связи,
обладают сходными химическими свойствами. Поэтому, зная химические свойства одного
из членов гомологического ряда, можно предсказать химическое поведение и других
членов этого ряда. Для получения гомологов используются общие методы синтеза.
Слайд 4Строение алканов
В алканах имеются два типа химических связей:
Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества.
Пространственное строение, т.е. взаимное расположение атомов молекулы
в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации . Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp³-гибридизации. В этом случае каждая из четырех sp³-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp³-АО другого атома углерода, образуя σ-связь С-Н или С-С. Четыре σ-связи углерода направлены в пространстве под тетраэдрическим углом 109°28′.
Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода. Валентный угол Н-С-Н равен 109°28’.
Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей. Для записи удобнее использовать пространственную (стереохимическую) формулу.
В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp³-атома углерода образуют более сложную пространственную конструкцию. Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы .
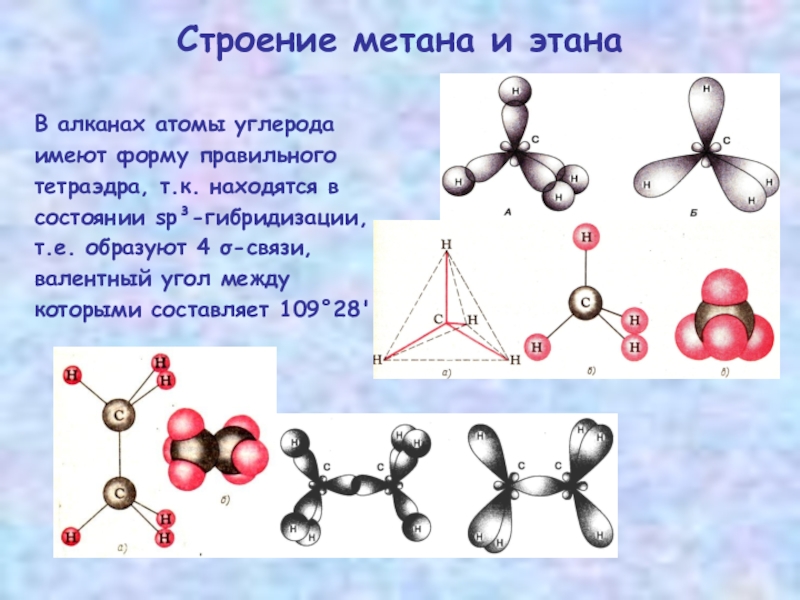
Слайд 5Строение метана и этана
В алканах атомы углерода
имеют форму правильного
тетраэдра, т.к. находятся
состоянии sp³-гибридизации,
т.е. образуют 4 σ-связи,
валентный угол между
которыми составляет 109°28'
Слайд 7Изомерия и номенклатура алканов
Для алканов характерна только структурная
2
СН3-СН2-СН2-СН3 СН3-СН-СН3
СН3
бутан 2-метилпропан
СН3
2 2
СН3-СН2-СН2-СН2-СН3 СН3-СН-СН2-СН3 СН3-С-СН3
СН3 СН3
пентан 2-метилбутан 2,2-диметилпропан
Межклассовые изомеры у алканов отсутствуют.
Слайд 8Изомерия алканов
Изомерия – явление существования соединений, которые имеют
Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве, то наблюдается пространственная изомерия (стереоизомерия). В этом случае использование структурных формул недостаточно и следует применять модели молекул или пространственные (стереохимические) формулы. Алканы, начиная с этана С2Н6, существуют в различных пространственных формах, обусловленных внутримолекулярным вращением по σ-связям С–С, и проявляют так называемую поворотную изомерию. Кроме того, при наличии в молекуле 7-ми и более углеродных атомов, возможен еще один вид пространственной изомерии, когда два изомера относятся друг к другу как предмет и его зеркальное изображение (подобно тому, как левая рука относится к правой). Такие различия в строении молекул называют зеркальной или оптической изомерией.
Структурная изомерия алканов
Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами. Различия в порядке соединения атомов в молекулах (т. е. в химическом строении) приводят к структурной изомерии. Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т. е. начиная с бутана С4Н10.
Причиной проявления структурной изомерии в ряду алканов является способность атомов углерода образовывать цепи различного строения. Этот вид структурной изомерии называется изомерией углеродного скелета. Например, алкан состава C4H10 может существовать в виде двух, а алкан С5Н12 – в виде трех структурных изомеров, отличающихся строением углеродной цепи.
Структурные изомеры отличаются физическими свойствами. Алканы с разветвленным строением из-за менее плотной упаковки молекул и,соответственно, меньших межмолекулярных взаимодействий, кипят при более низкой температуре, чем их неразветвленные изомеры.
Слайд 9Приёмы построения структурных формул изомеров
Рассмотрим на примере алкана
1. Сначала изображаем молекулу линейного изомера (ее углеродный скелет)
С−С−С−С−С−С (1)
2. Затем цепь сокращаем на 1 атом углерода и этот атом присоединяем к какому-либо атому углерода цепи как ответвление от нее, исключая крайние положения:
С−С−С−С−С (2) или С−С−С−С−С (3)
⏐ ⏐
С С
Если присоединить углеродный атом к одному из крайних положений, то химическое строение цепи не изменится: С−С−С−С−С
⏐
С
Кроме того, нужно следить, чтобы не было повторов. Так, структура С−С−С−С−С идентична структуре (2).
⏐
С
3. Когда все положения основной цепи исчерпаны, сокращаем цепь еще на 1 атом углерода: С−С−С−С
Теперь в боковых ответвлениях разместятся 2 атома углерода. Здесь возможны следующие сочетания атомов:
С С
⏐ ⏐
С−С−С−С (4) и С−С−С−С (5)
⏐ ⏐
С С
Боковой заместитель может состоять из 2-х или более последовательно соединенных атомов углерода, но для гексана изомеров с такими боковыми ответвлениями не существует, и структура
С−С−С−С
⏐ идентична структуре (3).
С−С
Боковой заместитель −С−С можно размещать только в цепи, содержащей не меньше 5-ти углеродных атомов и присоединять его можно только к 3-му и далее атому от конца цепи.
4. После построения углеродного скелета изомера необходимо дополнить все углеродные атомы в молекуле связями с водородом, учитывая, что углерод четырехвалентен.
Итак, составу С6Н14 соответствует 5 изомеров: СН3
1) CH3−CH2−CH2−CH2−CH2−CH3 (н-гексан) l
2) CH3−CH−CH2−CH2−CH3 3) CH3−CH2−CH−CH2−CH3 4) СН3-СН -СН-СН3 5) CH3 −C−CH2−CH3
⏐ ⏐ l l l
CH3 CH3 CH3 CH3 CH3
Слайд 10Основы систематической номенклатуры ИЮПАК (Международный союз теоретической и прикладной химии) (заместительная
Названия первых четырёх алканов сложились исторически: метан, этан, пропан, бутан. Начиная с пятого
название строят сочетанием греческого числительного (1 – моно, 2 – ди, 3 – три, 4 - тетра, 5 – пента, 6 – гекса, 7 –
гепта, 8 – окта, 9 – нона, 10 – дека) и суффикса -ан : пентан, гексан, октан, нонан, декан и т.д.
Если от алкана «отнять» один атом водогода, то образуется одновалентный «остаток» - угле-
водородный радикал (R)
Общее название таких радикалов – алкилы (название образовано заменой суффикса –ан на –ил).
Алгоритм составления названия разветвлённых алканов:
1. В структурной формуле выбирают самую длинную углеродную цепь.
2. Выбранную цепь нумеруют с того конца, к которому ближе расположено ответвление цепи (радикал).
3. Название алкана производят в следующем порядке: перечисляют в цепи номера углеродных атомов (цифрой), при
которых имеются ответвления (радикалы). Если при одном и том же углеродном атоме находятся два радикала, то
одну и ту же цифру повторяют дважды. Затем называют радикалы в порядке старшинства : метил, этил и т.д. Если
одинаковых радикалов несколько, то их число указывается греческими числительными. Наконец, называют главную
цепь по углеводороду с соответствующим числом углеродных атомов в молекуле.
Слайд 11Физические свойства алканов
С увеличением Мr повышаются tпл. и tкип.
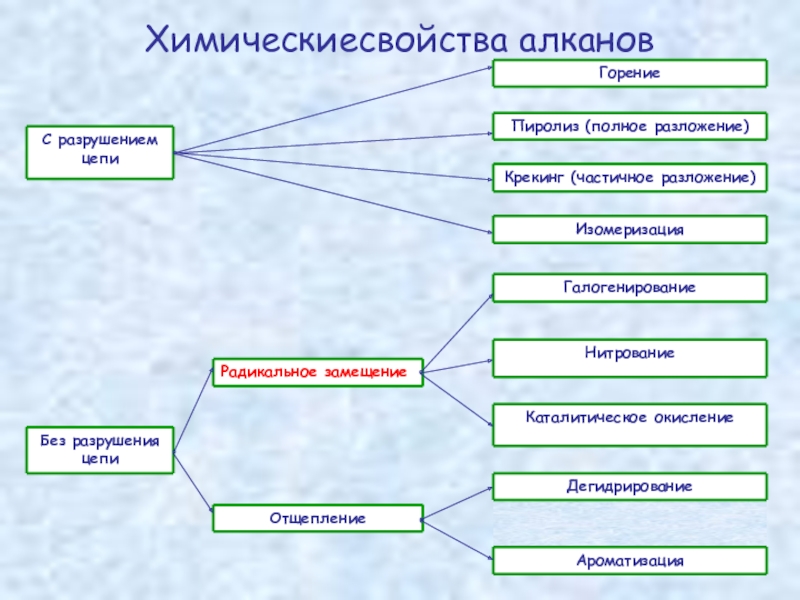
Слайд 13Химические свойства алканов
Химические свойства любого соединения определяются его
Во-вторых, симметричность неполярных С–С и слабополярных С–Н ковалентных связей предполагает их гомолитический (симметричный) разрыв на свободные радикалы. Следовательно, для реакций алканов характерен радикальный механизм. Поскольку гетеролитический разрыв связей С–С и С–Н в обычных условиях не происходит, то в ионные реакции алканы практически не вступают. Это проявляется в их устойчивости к действию полярных реагентов (кислот, щелочей, окислителей ионного типа: КMnO4, К2Сr2O7 и т.п.). Такая инертность алканов в ионных реакциях и послужила ранее основанием считать их неактивными веществами и назвать парафинами.
Итак, алканы проявляют свою реакционную способность в основном в радикальных реакциях. Условия проведения таких реакций: повышенная температура (часто реакцию проводят в газовой фазе), действие света или радиоактивного излучения, присутствие соединений - источников свободных радикалов (инициаторов), неполярные растворители.
В зависимости от того, какая связь в молекуле разрывается в первую очередь, реакции алканов подразделяются на следующие типы.
С разрывом связей С–С происходят реакции разложения (крекинг алканов) и изомеризации углеродного скелета.
По связям С–Н возможны реакции замещения атома водорода или его
отщепления (дегидрирование алканов). Кроме того, атомы углерода в алканах находятся в наиболее восстановленной форме (степень окисления углерода, например, в метане равна –4, в этане –3 и т.д.) и в присутствии окислителей в определенных условиях будут происходить реакции окисления алканов с участием связей С–С и С–Н.
Слайд 15Горение – полное окисление
Углеводороды горят на воздухе,
теплоты:
СН4 + 2О2 ⭢ СО2 + 2Н2О + 880 кДж
С2Н6 + 3,5О2 ⭢ 2СО2 + 3Н2О + Q
С3Н8 + 5О2 ⭢ 3СО2 + 4Н2О + Q
Газообразные алканы хорошо смешиваются с воздухом и
поэтому сгорают полностью. При горении твёрдых алканов
(парафинов) для сгорания всего углерода кислорода не хватает
и углерод выделяется в свободном виде (копоть). Образование
при горении углекислого газа определяют по помутнению
известковой воды.
Пиролиз – полное термическое разложение
При сильном нагревании алканы разлагаются на простые
вещества – углерод и водород:
СН4 ⭢ С + 2Н2 – Q
С2Н6 ⭢ 2С + 3Н2 - Q
Слайд 16Крекинг (частичное разложение)
⮛ Термический крекинг заключается в расщеплении молекул с длинной
СН4 ⭢ СНΞСН + 3Н2
ацетилен
С16Н34 ⭢ С8Н18 + С8Н16
С8Н18 ⭢ С4Н10 + С4Н8
СН3-СН2-СН2-СН3 ⭢ СН3-СН3 + СН2=СН2
⮛ Каталитический крекинг (изомеризация) протекает в присутствии катализаторов, в качестве которых используют природные алюмосиликаты состава nAl2O3▪mSiO2, а также Cr2O3, AlCl3. осуществление крекинга протекает при температуре 470°С до 550°С и приводит в основном к образованию углеводородов, имеющих разветвлённое или циклическое строение углеродной цепи:
СН3-СН2-СН2-СН3 ⭢ СН3-СН-СН3
|
СН3
бутан изо-бутан
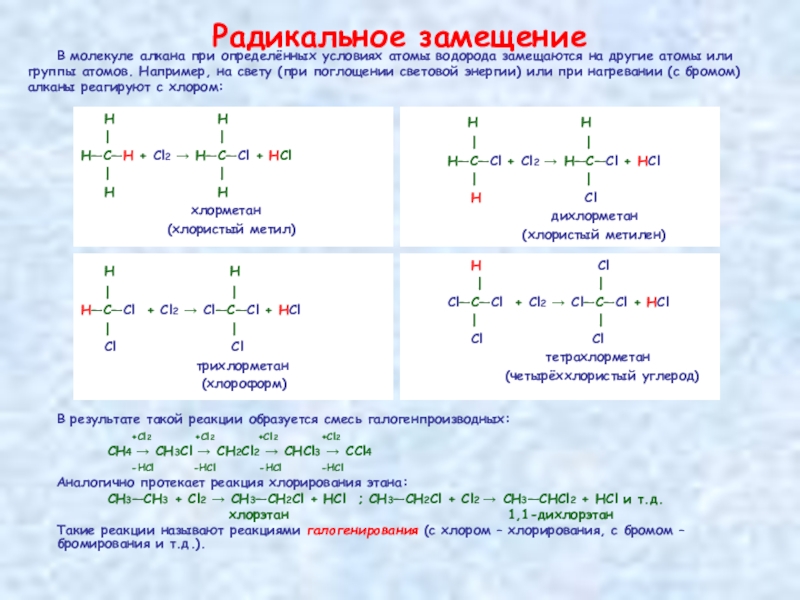
Слайд 17Радикальное замещение
Н
| |
Н—С—Н + Сl2 → Н—С—Сl + НСl
| |
Н Н
хлорметан
(хлористый метил)
В молекуле алкана при определённых условиях атомы водорода замещаются на другие атомы или
группы атомов. Например, на свету (при поглощении световой энергии) или при нагревании (с бромом)
алканы реагируют с хлором:
В результате такой реакции образуется смесь галогенпроизводных:
+Cl2 +Cl2 +Cl2 +Cl2
СН4 → CH3Cl → CH2Cl2 → CHCl3 → CCl4
-HCl -HCl -HCl -HCl
Аналогично протекает реакция хлорирования этана:
СН3—СН3 + Cl2 → CH3—CH2Cl + HCl ; CH3—CH2Cl + Cl2 → CH3—CHCl2 + HCl и т.д.
хлорэтан 1,1-дихлорэтан
Такие реакции называют реакциями галогенирования (с хлором – хлорирования, с бромом – бромирования и т.д.).
Н Н
| |
Н—С—Cl + Сl2 → Н—С—Сl + НСl
| |
Н Cl
дихлорметан
(хлористый метилен)
Н Н
| |
Н—С—Cl + Сl2 → Сl—С—Сl + НСl
| |
Cl Cl
трихлорметан
(хлороформ)
Н Cl
| |
Cl—С—Cl + Сl2 → Сl—С—Сl + НСl
| |
Cl Cl
тетрахлорметан
(четырёххлористый углерод)
Слайд 18 Замещение у хлорметана идёт легче, чем у метана,
δ+ δ-
более реакционноспособными: Н3С→Cl.
Легче всего замещение идёт у третичного атома углерода, сложнее – у вторичного, первичного атомов:
Сl
|
CH3-CH2-CH3 + Cl2 → CH3-CH-CH3 + HCl
2-хлорпропан
Механизм реакции замещения – свободнорадикальный, состоит из трёх стадий:
зарождение цепи Cl-Cl → 2Cl·
развитие цепи СН4 + Cl· → ·CH3 + HCl
·CH3 + Cl2 → CH3Cl + Cl· и т.д.
- обрыв цепи 2·CH3 → C2H6
Замещение может происходить с азотной кислотой при t=140ºС (реакция Коновалова), при этом получаются
нитросоединения: t
CH4 + HO-NO2→ CH3-NO2 + H2O
нитрометан
Такие реакции называются реакциями нитрования.
К свободнорадикальному замещению относятся реакции каталитического окисления алканов:
СН3ОН метанол
Н-C=О метаналь
СН4 + [О] |
Н
Н-С=О метановая кислота
|
ОН
Слайд 19Отщепление
При повышенной температуре на никелевом или платиновом катализаторе
СН3-СН3 → СН2=СН2 + Н2
СН3-СН2-СН2-СН3 → СН3-СН=СН-СН3 + Н2
бутен-2
СН3-СН-СН2-СН2-СН3 → СН3-С=СН-СН2-СН3 + Н2
| |
СН3 СН3
2-метилбутен-2
Алканы с шестью и более атомами углерода вступают в реакции дегидрирования с образованием циклоалканов и аренов:
С6Н14 → + Н2
циклогексан
С6Н14 → + 4H2
бензол
Слайд 20Получение алканов
Алканы выделяют из природных источников (природный и
Используются также синтетические методы.
1. Крекинг нефти (промышленный способ)
CnH2n+2 ⎯→ CmH2m+2 + Cn-mH2(n-m)
алкан алкен
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ
важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического
синтеза: пропан, бутан, изобутан, изопентан и др.
2. Гидpиpование непpедельных углеводоpодов:
+H2 +2H2
CnH2n ⎯⎯→ CnH2n+2 ←⎯⎯ CnH2n-2
алкены алканы алкины
3. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni):
С + 2Н2 → СН4
4. Из синтез-газа (СО + Н2) получают смесь алканов:
nCO + (2n+1)H2 ⎯→ CnH2n+2 + nH2O
5. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода:
2CH3Cl + 2Na ⎯→ CH3−CH3 + 2NaCl (синтез Вюpца)
хлорметан этан
6. Из солей карбоновых кислот (декарбоксилирование):
а) сплавление со щелочью (реакция Дюма)
t°
CH3COONa + NaOH ⎯→ CH4 + Na2CO3
ацетат натрия
б) электролиз по Кольбе
электролиз
2RCOONa + 2H2O ⎯⎯⎯→ R−R + 2CO2 + H2 + 2NaOH
на аноде на катоде
7. Разложение карбидов металлов (метанидов) водой (гидролиз):
Al4C3 + 12H2O ⎯→ 4Al(OH)3↓ + 3CH4↑
Слайд 21Синтез алканов
Галогенопроизводные алканов широко применяются для синтеза алканов
с
взаимодействия их с активными металлами (реакция Вюрца):
C2H5I + 2Na + IC2H5 ⎯→ C4H10 + 2NaI
Если в реакции использовать разные галоидные алкилы, то получается
смесь трех продуктов. Например:
C2H5Br + 2Na + BrCH3 ⎯→ C3H8 + 2NaBr
пропан
Кроме пропана образуются бутан C4H10 (из 2-х молекул C2H5Br) и этан
C2H6 (из 2-х молекул CH3Br).
Для получения алканов несимметричного строения или с нечетным
числом атомов углерода в цепи применяется реакция Вюрца-Гриньяра,
которая позволяет избежать образования смеси углеводородов:
эфир
CH3Br + Mg ⎯⎯→ CH3–MgBr (реактив Гриньяра)
CH3–MgBr + Br–CH2–CH3 ⎯→ CH3-CH2-CH3 + MgBr2
Слайд 22Галогеналканы
Галогенопроизводные алканов (галогеналканы) имеют очень важное значение для
синтеза многих соединений. Замена атомов водорода на галоген делает соединение
химически активным, т.к. связь углерода с более лектроотрицательным атомом галогена
является полярной и довольно реакционноспособной в реакциях ионного типа.
Полярность ковалентной связи, например С-Cl, приводит к смещению электронной
плотности соседних связей в молекуле (индуктивный_эффект).
Галогенопроизводные алканов широко применяются для синтеза алканов с заданным
строением молекул. Для этого используется реакция взаимодействия их с активными
металлами (реакция Вюрца):
C2H5I + 2Na + IC2H5 ⎯→ C4H10 + 2NaI
Если в реакции использовать разные галоидные алкилы, то получается смесь трех
продуктов. Например:
C2H5Br + 2Na + BrCH3 ⎯→ C3H8 + 2NaBr
пропан
Кроме пропана образуются бутан C4H10 (из 2-х молекул C2H5Br) и этан C2H6 (из 2-х
молекул CH3Br).
Для галогенпроизводных характерно замещение галогена на другие группы атомов
при действии воды, оснований и солей. Эти реакции протекают по механизму
нуклеофильного замещения, т.к. положительно заряженный углеродный атом, связанный
с галогеном, является центром атаки нуклеофильными частицами (OH−, Cl−, CN−)
H3Cδ+–Clδ− + Na+OH− → CH3OH + Na+Cl− (нуклеофил - OH−).
Механизм нуклеофильного замещения обозначается символом SN (по первым буквам
английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Слайд 23Применение алканов
Предельные углеводороды находят широкое применение в самых
сферах жизни и деятельности человека.
Газообразные алканы (метан и пpопан-бутановая смесь) используется в качестве
ценного топлива. Жидкие углеводоpоды составляют значительную долю в моторных и
ракетных топливах и используются в качестве растворителей. Вазелиновое масло (смесь
жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха
и вкуса, используется в медицине, паpфюмеpии и косметике. Вазелин (смесь жидких и
твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для
пpиготовления мазей, используемых в медицине.
Паpафин (смесь твеpдых углеводоpодов С19 – С35) – белая твеpдая масса без запаха
и вкуса (т.пл.=50-70°C). Пpименяется для изготовления свечей, пpопитки спичек и
упаковочной бумаги, для тепловых пpоцедуp в медицине и т.д.
В современной нефтехимической промышленности
предельные улеводороды являются базой для
получения разнообразных органических соединений,
важным сырьем в процессах получения полупродуктов
для производства пластмасс, каучуков,
синтетических волокон, моющих средств и многих
других продуктов. Нормальные предельные
углеводороды средней молекулярной массы
используются как питательный субстрат
в микробиологическом синтезе белка из нефти.
Большое значение имеют галогенопроизводные
алканов, которые используются как растворители,
хладоагенты и сырье для дальнейших синтезов.
Слайд 24Проверка знаний
Какие УВ относятся к алканам?
Почему в состав алкана не может
Как на основе электронной теории объяснить зигзагообразное строение углеродной цепи?
Что берётся за основу номенклатуры алканов?
Почему алканы не растворяются в воде?
Как опытным путём можно отличить метан от водорода?
Какой тип реакций наиболее характерен для алканов?
Объясните смысл названия «дегидрирование»?
Укажите именные реакции, характеризующие свойства и способы получения алканов.
Назовите природные источники алканов.
Слайд 25Тест
1. Состав алканов отражает общая формула . . .
а) CnH2n
2. Какие соединения относятся к гомологическому ряду метана:
а) С2Н4 б) С3Н8 в) С4Н10 г) С5Н12 д) С7Н14 ?
3. Какое из соединений, получится при нагревании метана без доступа воздуха при температуре 1500°С
а) этилен б) ацетилен в) углекислый газ г) сажа
4. Укажите названия углеводородных радикалов, соответствующих алканам: метан, пропан, пентан
а) метил, пропил, пентил; б) изопропил, пропил, бутил;
в) пентил, н-пропил, метил
С
|
5. Назовите по систематической номенклатуре "изооктан" С-С-С- С-С
| | С С
а) тетраметилбутан б) 2,2,4-метилпентан
в) 2,4,4-триметилпентан г) триметилпентан
Слайд 266. С какими реагентами могут взаимодействовать алканы:
а) Br2 (р-р); б) Br2,
г) HNO3 (разб), t°; д) KMnO4 (25 °С); е) NaOH ?
7. Какой галогеналкан нужен для получения 2,5-диметилгексана
по реакции Вюрца без побочных продуктов?
а) 2-бром-2-метилпропан б) 2-бромпропан + 1-бром-3-метилбутан
в) 1-бром-2-метилпропан г) бромэтан + 1-бромбутан
8. Укажите наиболее вероятный продукт взаимодействия 1 моль
2,2,3-триметилбутана и 1 моль Br2 (на свету).
а) 2-бром-2,3,3-триметилбутан б) 1-бром-2,2,3-триметилбутан
в) 1-бром-2,3,3-триметилбутан г) 3-бром-2,2,3-триметилбутан
9. К какому типу относится реакция взаимодействия хлора с метаном (на свету)
а) окисления б) изомеризации в) замещения г) соединения
10. Механизм реакции хлорирования метана:
а) ионный б) радикальный