- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии Строение атома (8 класс)
Содержание
- 1. Презентация к уроку химии Строение атома (8 класс)
- 2. Цели урокаСформировать понятие о составе атома и
- 3. Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все его свойства.
- 4. Демокрит считал, атомы мельчайшими частицами всего
- 5. СТОНИ (Стоуни) (Stoney) Джордж Джонстон
- 6. М. Склодовская-Кюри и П. Кюри открыли (1898)
- 7. Радиоактивность – свойство атомов некоторых
- 8. 1897 г. – Дж.Томсон открыл катодные лучи. Считал, что «атом подобен пудингу».
- 9. МАЛЛИКЕН (Mulliken) Роберт Сандерсон (1896-1986),
- 10. Эрнест Резерфорд В 1911 году сформулировалпланетарную модель
- 11. Модель атома Резерфорда
- 12. МОЗЛИ (Moseley) Генри Гвин Джефрис (1887-1915), английский
- 13. Нильс Бор — основатель (1920) и руководитель
- 14. БРОЙЛЬ (де Брольи) (de Broglie) Луи (1892-1987),
- 15. ПРОТОН – элементарная положительно заряженная частица с
- 16. ЭЛЕКТРОН (е, е-), (от греческого слова elektron
- 17. Слайд 17
- 18. Совокупность электронов в атоме называется электронной оболочкой.Атом
- 19. Числа ПСХЭ Д.И. Менделеева:Заряд
- 20. Характеристика элемента: сера S3 малый период, VI
- 21. Атомы одного химического элемента, содержащие различное число
- 22. Домашнее задание: § 18, упражнения 1-6, № 6-1.
Цели урокаСформировать понятие о составе атома и составе атомного ядра.Сформировать умения определять состав атома химического элемента по положению в периодической системе химических элементов Д.И. Менделеева.
Слайд 2Цели урока
Сформировать понятие о составе атома и составе атомного ядра.
Сформировать умения
определять состав атома химического элемента по положению в периодической системе химических элементов Д.И. Менделеева.
Слайд 3 Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая
все его свойства.
Слайд 4 Демокрит считал, атомы мельчайшими частицами всего сущего:
«Начала вселенной –
атомы и пустота. Все же остальное существует лишь во мнении. Атомы не поддаются никакому воздействию, и они неизменяемы вследствие твердости…»
Слайд 5 СТОНИ (Стоуни) (Stoney) Джордж Джонстон (1826-1911), английский физик и
математик. Первым указал в 1874 на существование элементарного электрического заряда и вычислил (1881) его величину.
Ввел (1891) термин электрон.
Ввел (1891) термин электрон.
Слайд 6М. Склодовская-Кюри и П. Кюри открыли (1898) полоний и радий, исследовали
радиоактивное излучение. П.Кюри ввел термин «радиоактивность»,1896 г. Нобелевская премия (1903, П.Кюри, Склодовская-Кюри и
А. Беккерель).
А. Беккерель).
Слайд 7 Радиоактивность – свойство атомов некоторых элементов самопроизвольно излучать невидимые
глазом частицы; оно обусловлено распадом их атомных ядер, превращением в другие элементы.
Слайд 9 МАЛЛИКЕН (Mulliken) Роберт Сандерсон (1896-1986), американский физикохимик. Труды по
квантовой химии. Рассчитал методом молекулярных орбиталей электронные структуры многих сложных молекул. Нобелевская премия (1966).
-19
Рассчитал заряд электрона 1,601·10 Кл.
-19
Рассчитал заряд электрона 1,601·10 Кл.
Слайд 10Эрнест Резерфорд
В 1911 году сформулировал
планетарную модель атома:
атом состоит из положительно
заряженного ядра и электронов, вращающихся вокруг ядра по замкнутым орбитам подобно движению планет вокруг Солнца.
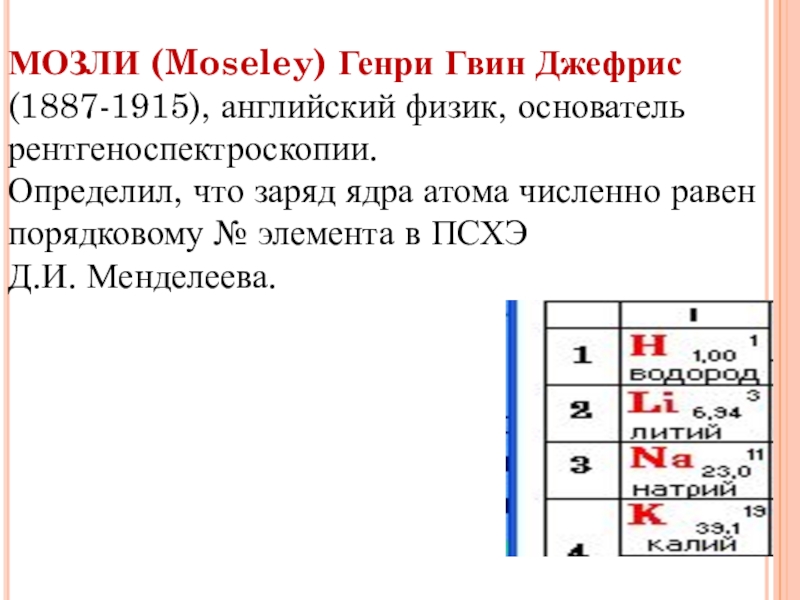
Слайд 12МОЗЛИ (Moseley) Генри Гвин Джефрис (1887-1915), английский физик, основатель рентгеноспектроскопии.
Определил, что
заряд ядра атома численно равен порядковому № элемента в ПСХЭ
Д.И. Менделеева.
Д.И. Менделеева.
Слайд 13
Нильс Бор — основатель (1920) и руководитель Института теоретической физики в
Копенгагене (Институт Нильса Бора), создатель мировой научной школы, иностранный член АН СССР (1929). Дополнил планетарную модель атома.
Слайд 14
БРОЙЛЬ (де Брольи) (de Broglie) Луи (1892-1987), иностранный член АН СССР
(1958), один из создателей квантовой механики, выдвинул (1924) идею о волновых свойствах материи. Труды по строению атомного ядра, распространению электромагнитных волн в волноводах, истории и методологии физики. Нобелевская премия (1929).
Установил, что электрон имеет двойственную природу:
электрон – волна,
электрон – частица.
Установил, что электрон имеет двойственную природу:
электрон – волна,
электрон – частица.
Слайд 15ПРОТОН – элементарная положительно заряженная частица с m=1.
НЕЙТРОН (англ. neutron, от
лат. neuter — ни тот, ни другой) (n), нейтральная элементарная частица с m=1. В свободном состоянии нейтрон нестабилен и имеет время жизни около 16 мин.
Вместе с протонами нейтрон образуют атомные ядра; в ядрах нейтрон стабилен.
Вместе с протонами нейтрон образуют атомные ядра; в ядрах нейтрон стабилен.
Слайд 16ЭЛЕКТРОН (е, е-), (от греческого слова elektron — янтарь, предложено в
1891 г. ирландским физиком Дж.Стони). Электрический заряд электрона условились считать отрицательным в соответствии с более ранним соглашением называть отрицательным заряд наэлектролизованного янтаря.
Электрон — составная часть атома, число электронов в нейтральном атоме равно числу протонов в ядре.
Электрический заряд электрона составляет е = (4,8032068 0,0000015).10-10 единиц СГСЕ, или 1,60217733.10-19Кл.
Масса электрона, me = 9,11.10-31кг.
Электрон — составная часть атома, число электронов в нейтральном атоме равно числу протонов в ядре.
Электрический заряд электрона составляет е = (4,8032068 0,0000015).10-10 единиц СГСЕ, или 1,60217733.10-19Кл.
Масса электрона, me = 9,11.10-31кг.
Слайд 17
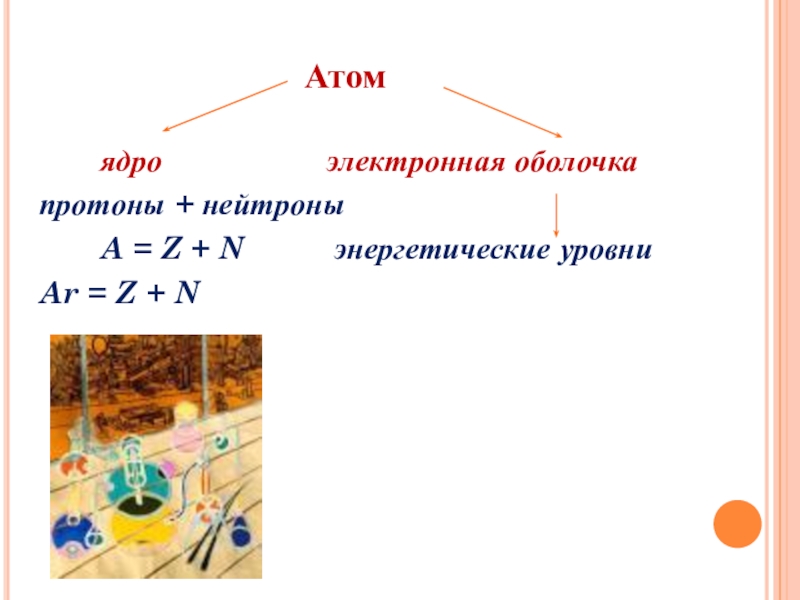
Атом
ядро электронная оболочка
протоны + нейтроны
A = Z + N энергетические уровни
Ar = Z + N
ядро электронная оболочка
протоны + нейтроны
A = Z + N энергетические уровни
Ar = Z + N
Слайд 18Совокупность электронов в атоме называется электронной оболочкой.
Атом – это устойчивая система
элементарных единиц, состоящая из ядра, образованного протонами и нейтронами, и электронной оболочки.
Химический элемент – это вид атомов с одинаковым зарядом ядра.
Химический элемент – это вид атомов с одинаковым зарядом ядра.
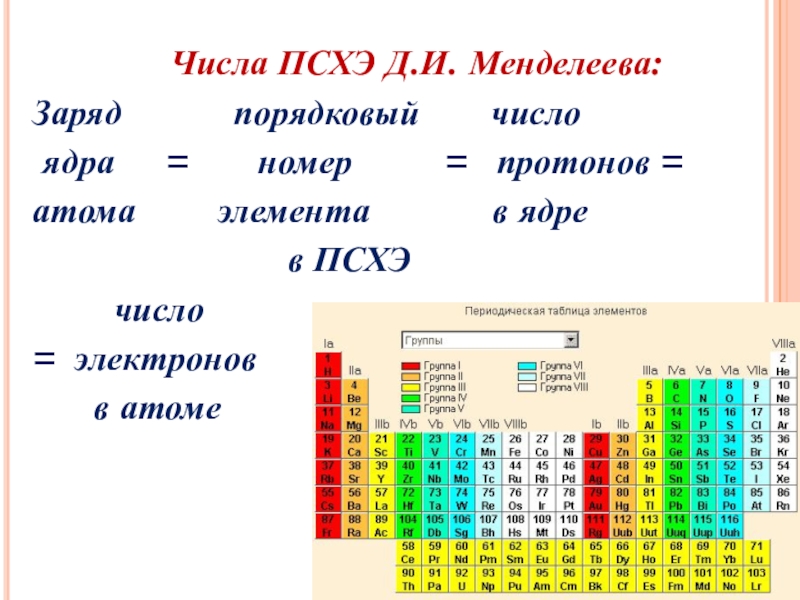
Слайд 19 Числа ПСХЭ Д.И. Менделеева:
Заряд
порядковый число
ядра = номер = протонов =
атома элемента в ядре
в ПСХЭ
число
= электронов
в атоме
ядра = номер = протонов =
атома элемента в ядре
в ПСХЭ
число
= электронов
в атоме
Слайд 20Характеристика элемента:
сера S
3 малый период, VI A группа
Z(S) =
16, заряд ядра+16,
N(p) = 16, N(n) = 16, N(℮) = 16.
неметалл.
Определите важнейшие характеристики по данному плану атомов элементов с
№ 8, 19, 9, 13, 15 .
N(p) = 16, N(n) = 16, N(℮) = 16.
неметалл.
Определите важнейшие характеристики по данному плану атомов элементов с
№ 8, 19, 9, 13, 15 .
Слайд 21Атомы одного химического элемента, содержащие различное число нейтронов в ядре и,
следовательно, имеющие различные массовые числа, называют изотопами.
Аr(35Сl) ·ω(35Сl)+ Аr(37Сl) ·ω(37Сl)
Аr(Сl)= =
100%
= 35·75% + 37·25% = 35,5
100%
Аr(35Сl) ·ω(35Сl)+ Аr(37Сl) ·ω(37Сl)
Аr(Сl)= =
100%
= 35·75% + 37·25% = 35,5
100%