- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии по теме Железо
Содержание
- 1. Презентация к уроку химии по теме Железо
- 2. Тема урока: «Железо. Генетические ряды Fe2+ и Fe3+»
- 3. Метеоритное железо
- 4. Природные соединения железа
- 5. (Красный железняк)Fe2O3(Бурый железняк)Fe2O3*nH2OГематитЛимонит
- 6. сидеритпиритмагнетитгематит Fe2O3 – красный железняк
- 7. Вычислите, в каком из природных соединений Fe3O4 или Fe2O3 содержание железа больше?Задание 1
- 8. Дайте характеристику железа по положению в ПСХЭ.Задание 2
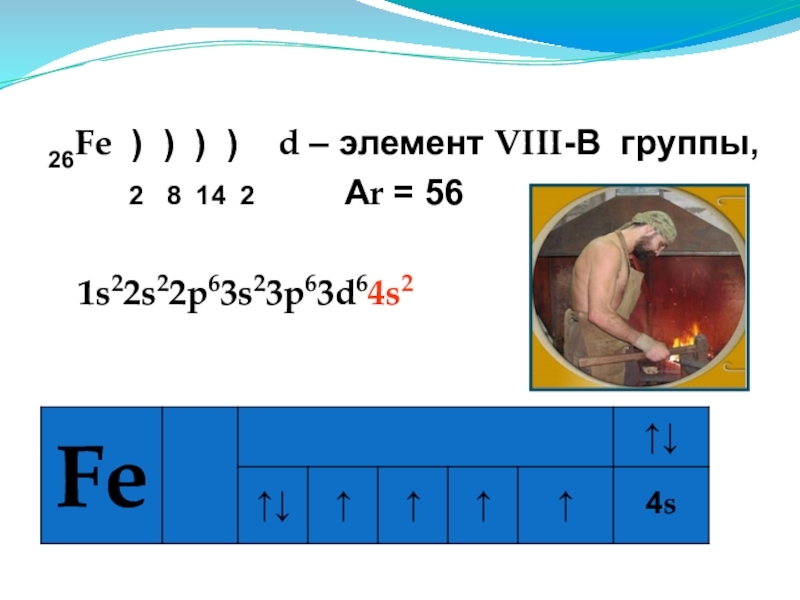
- 9. 26Fe ) ) ) ) d
- 10. Объясните, почему железо проявляет переменную степень окисления?
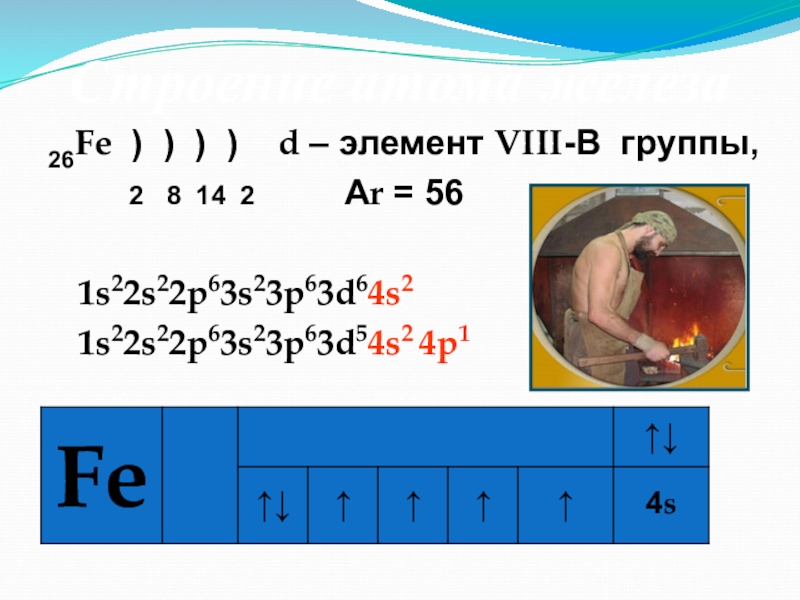
- 11. 26Fe ) ) ) ) d
- 12. Металл, реагирующий с раствором H2SO4 (н.у.):а)
- 13. Вещество, в котором степень окисления Fe+3:а) FeCl2, б) Fe2О3, в) FeSO4,
- 14. Пластинка, вытесняющая медь из ее солей:
- 15. Среда, в которой коррозия железа происходит
- 16. Укажите металл, более активный, чем Fe:а) Са,б) Cu,в) Sn.
- 17. Характер оксида железа (II): а) кислотный,б) основный, в) амфотерный.
- 18. Укажите вещество, взаимодействующее с железом:а) О2, б) ZnSO4, в) CO2.
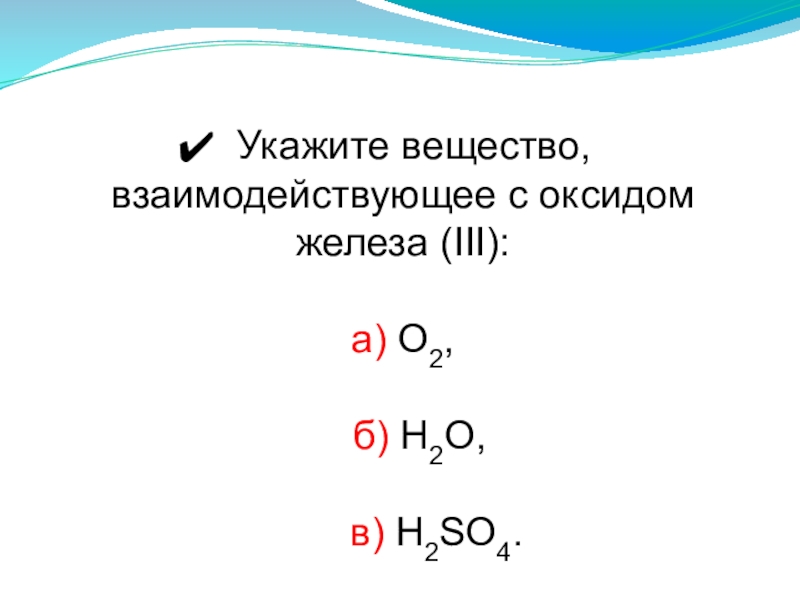
- 19. Укажите вещество, взаимодействующее с оксидом железа (III):а) О2, б) H2O, в) H2SO4.
- 20. Установите соответствие между исходными веществами и
- 21. Тип связи в простом веществе Fe:а) ионная; б) ковалентная; в) металлическая
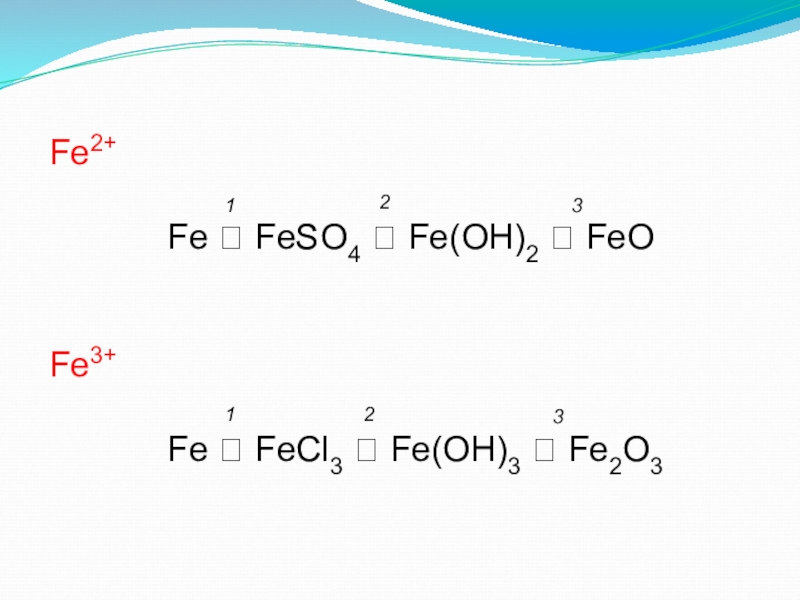
- 22. Из предложенных формул составьте генетический ряд Fe2+
- 23. Fe2+
- 24. Уравнение 1 написать в свете окислительно-восстановительных реакций.
- 25. Осуществить практически превращение 2.
- 26. Уравнение 2 написать в молекулярном и ионном виде.
- 27. Написать уравнение 3 и сделать вывод об окислительно-восстановительных процессах этой реакции.
- 28. Какой характер имеют оксиды и гидроксиды Fe2+ и Fe3+?
- 29. Соединения Fe2+ проявляют основный характер.Соединения Fe3+ проявляют амфотерный характер.ЗАПОМНИТЕ
- 30. Железо – самый употребляемый металл, на него
- 31. Применение железа и его соединений.
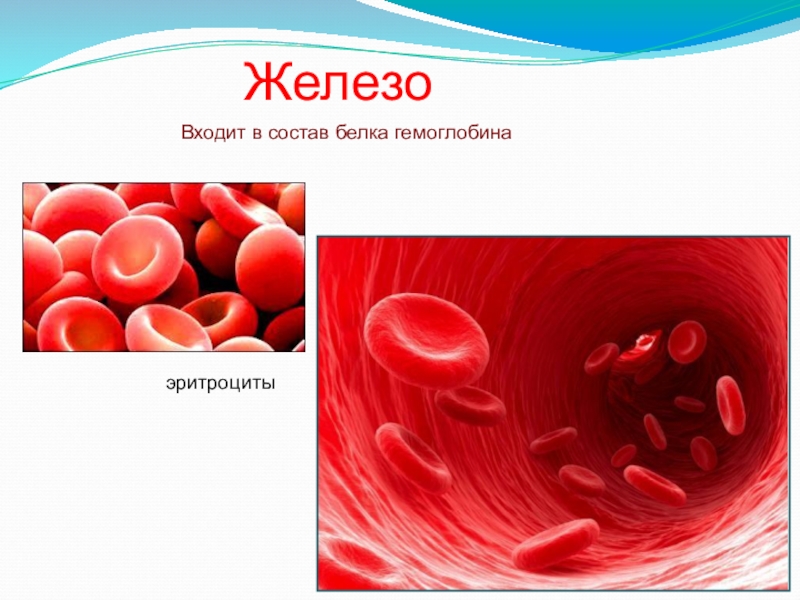
- 32. ЖелезоВходит в состав белка гемоглобинаэритроциты
- 33. Железо входит в состав гемоглобина, миоглобина, различных
- 34. Важнейшие источники железаСодержание железа в 100 г
- 35. «Все моё», - сказало злато.«Все моё», -
- 36. Слайд 36
Слайд 6сидерит
пирит
магнетит
гематит
Fe2O3 –
красный железняк
FeS2 –
пирит
магнитный железняк
или железная окалина
Слайд 7Вычислите, в каком из природных соединений Fe3O4 или Fe2O3 содержание железа
Задание 1
Слайд 926Fe ) ) ) ) d – элемент VIII-В группы,
2 8 14 2 Аr = 56
1s22s22p63s23p63d64s2
Строение атома железа
Слайд 1126Fe ) ) ) ) d – элемент VIII-В группы,
2 8 14 2 Аr = 56
1s22s22p63s23p63d64s2
1s22s22p63s23p63d54s2 4р1
Строение атома железа
Слайд 12 Металл, реагирующий с раствором H2SO4 (н.у.):
а) Ag, б) Сu, в)
Задание 3
Fe- представитель элементов
побочной подгруппы.
Слайд 15 Среда, в которой коррозия железа происходит наиболее быстро:
а) вода,
в) влажный воздух.
Слайд 20 Установите соответствие между исходными веществами и продуктами реакции:
Исходные вещества продукты реакции
1.
2. Fe + Cl2 ? б) Fe(OH)2 + NaCl
3. Fe + HCl(p) ? в) FeCl2
4. FeCl2 + NaOH ? г) FeCl2 + H2
д) FeCl3
е) FeSO4 + H2
Слайд 22Из предложенных формул составьте генетический ряд
Fe2+ (I вариант) и Fe3+
Fe(OH)3, Fe, Fe(OH)2,
FeCl3, Fe2O3, FeSO4, FeO
Задание 4
Слайд 27
Написать уравнение 3 и сделать вывод об окислительно-восстановительных процессах этой реакции.
Слайд 29Соединения Fe2+ проявляют основный характер.
Соединения Fe3+ проявляют амфотерный характер.
ЗАПОМНИТЕ
Слайд 30Железо – самый употребляемый металл, на него приходится до 90% мирового
Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для производства трансформаторов, электромоторов и мембран микрофонов.
Основная масса железа на практике используется в виде сплавов - чугуна и стали.
Применение железа и его соединений.
Слайд 33Железо входит в состав гемоглобина, миоглобина, различных ферментов и других сложных
В теле взрослого человека содержится примерно 4-6 г железа, из них 65% в крови.
Ежедневно с пищей должно поступать 5-15 мг железа
Слайд 34Важнейшие источники железа
Содержание железа в 100 г продукта
Грибы свежие – 5
Печень – 9 мг
Грибы сушеные –
35 мг
Хлеб – 2 мг
Персики – 4 мг
Яблоки – 3 мг
Слайд 35
«Все моё», - сказало злато.
«Все моё», - сказал булат.
«Все куплю», -
«Все возьму», - сказал булат.
А.С. Пушкин, 1826 г.