- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии Основания, классификация, свойства
Содержание
- 1. Презентация к уроку химии Основания, классификация, свойства
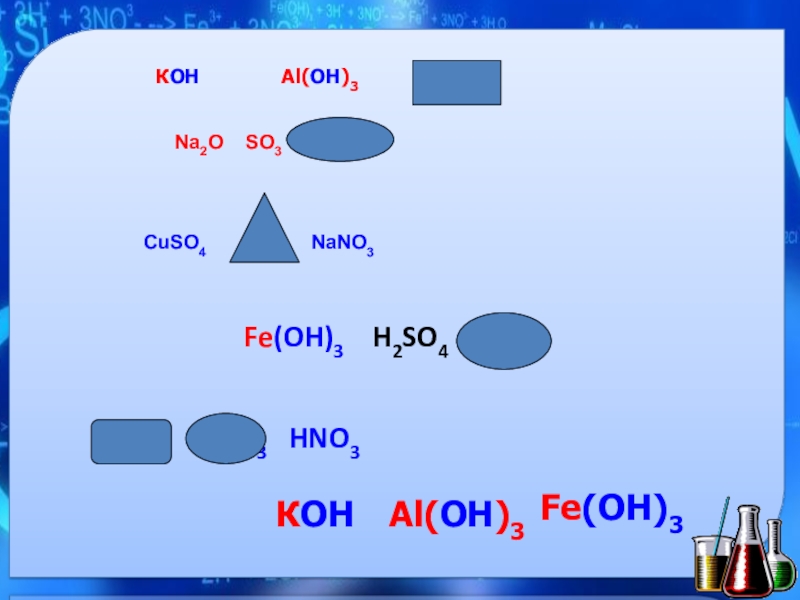
- 2. КОН Al(ОН)3 HNO3Na2O SO3 HNO3CuSO4
- 3. Определение основанийМе(ОН)nКОН Ca(ОН)2 Al(ОН)3
- 4. Слайд 4
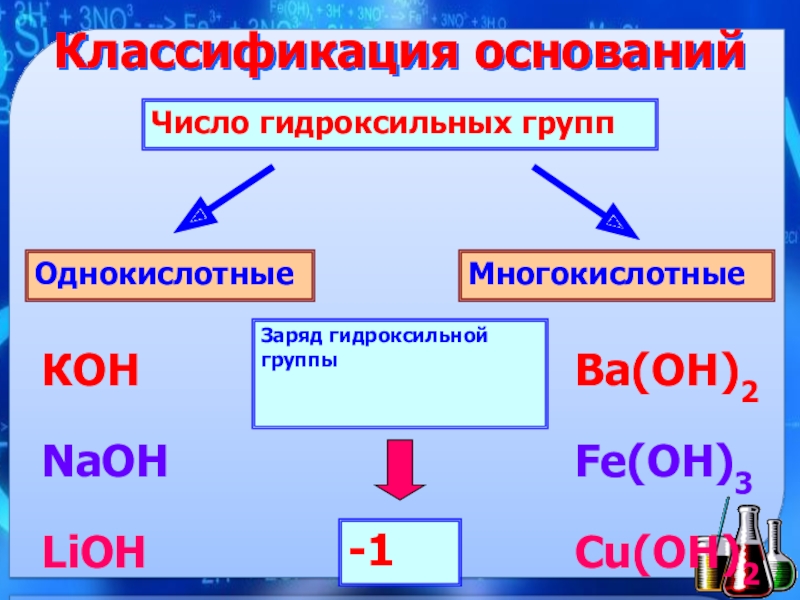
- 5. Классификация основанийЧисло гидроксильных группОднокислотные Многокислотные КОНNaOHLiOHBa(ОН)2Fe(OH)3Cu(OH)2Заряд гидроксильной группы-1
- 6. РастворимостьРастворимые в воде Нерастворимые
- 7. Получение основанийЩелочи 2Na + 2H2O 2NaOH
- 8. Нерастворимые в воде основанияРеакция обмена = соль
- 9. Химические свойства основанийЩелочи изменяют окраску индикаторовЛакмус Метиловый оранжевыйФенолфталеиновыйСинийЖелтыйМалиновый
- 10. Основания реагируют с кислотамиНейтрализациящелочинерастворимыеоснованиесолькислотавода
- 11. Слайд 11
- 12. Щелочи реагируют с кислотными оксидами
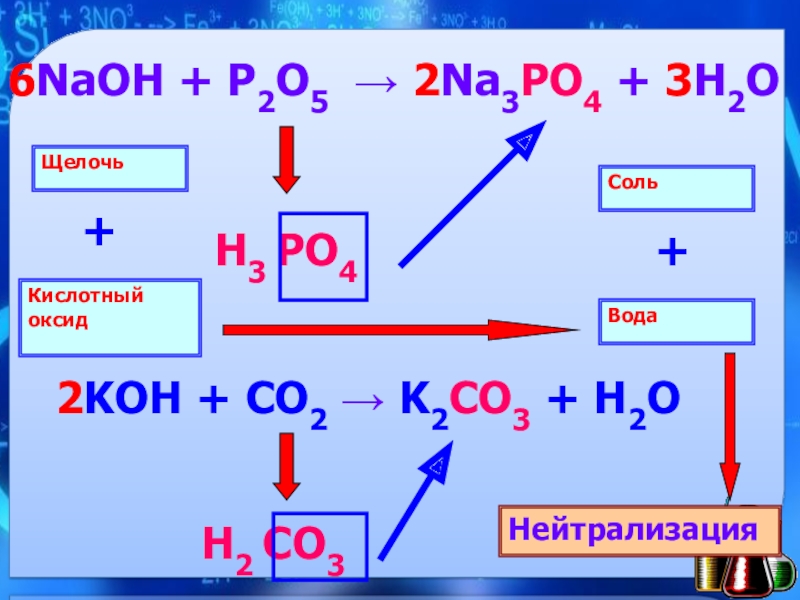
- 13. 6NaOH + P2O5 2Na3PO4 + 3H2O Н3 PO4Н2 CO3Щелочь Кислотный оксид+Вода Соль +Нейтрализация
- 14. Нерастворимые основания
- 15. Cu(OH)2 –t°® CuO + H2O––
- 16. Тест1. К основаниям относится каждое из двух
- 17. Слайд 17
- 18. Рефлексия
- 19. Задание 3. Допишите уравнения реакций. Назовите вещества.1).
- 20. Задание 4. С какими из веществ будет
Слайд 2КОН
Al(ОН)3
HNO3
Na2O SO3 HNO3
CuSO4 FeO
Fe(OH)3 H2SO4 K2O
HCl H2CO3 HNO3
КОН
Al(ОН)3
Fe(OH)3
Слайд 3Определение оснований
Ме(ОН)n
КОН Ca(ОН)2 Al(ОН)3 Ba(ОН)2
Гидроксиды
KOH
Ba(ОН)2 Ba+2 + 2 OH-1
Основания – вещества, в растворах которых содержатся гидроксильные ионы
Слайд 5Классификация оснований
Число гидроксильных групп
Однокислотные
Многокислотные
КОН
NaOH
LiOH
Ba(ОН)2
Fe(OH)3
Cu(OH)2
Заряд гидроксильной группы
-1
Слайд 6Растворимость
Растворимые в воде
Нерастворимые в воде
Щелочи
Металлы
КОН
NaOH
Ca(ОН)2
LiOH
Fe(OH)3
Cu(OH)2
Al(ОН)3
Металлы III А и Б групп
Слайд 7Получение оснований
Щелочи
2Na + 2H2O 2NaOH + H2
K2O + H2O
Активный металл + вода
Основной оксид + вода
Слайд 8Нерастворимые в воде основания
Реакция обмена = соль + щелочь
Косвенный
способ
CuSO4 +2NaOH
Zn(NO3)2 +2KOH 2KNO3 + Zn(OH)2
FeCl2 +Ba(OH)2 BaCl2 + Fe(OH)2
Слайд 9Химические свойства оснований
Щелочи изменяют окраску индикаторов
Лакмус
Метиловый оранжевый
Фенолфталеиновый
Синий
Желтый
Малиновый
Слайд 14Нерастворимые основания
2Fe(OH)3 Fe2O3 + 3H2O
Гидроксид
Оксид металла
Вода
+
Слайд 16Тест
1. К основаниям относится каждое из двух веществ:
в) H₂CO₃, N₂O₅ г) NaOH, Cu(OH)₂
2. Формула, которая соответствует
гидроксиду железа (II):
а) FeO б) Fe(OH)₃ в) Fe(OH)₂ г) Fe₂O₃
3. Какое основание разлагается при нагревании:
а) NaOH б) Fe(OH)₃ в) KOH г) Ba(OH)₂
4. В цепочке превращений веществом Х является:
Na→ X → NaOH
а) NaСl б) NaOH в) Na₂O г) Na₂SO₄
г
в
б
в
Слайд 19Задание 3. Допишите уравнения реакций. Назовите вещества.
1). NaOH + H2SO4 =
2).
3). LiOH + CuSO4 =
4). NaOH + фенолфталеин =
5). Zn(OH)2 =
Рефлексия
Слайд 20Задание 4. С какими из веществ будет реагировать KOH.Напишите реакции. Назовите
H3PO4 ;CaO ; СO2 ;Al2 (SO4)3 ; Zn(OH)2
Рефлексия