- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии: Физические и химические явления. Химические реакции
Содержание
- 1. Презентация к уроку химии: Физические и химические явления. Химические реакции
- 2. Содержание1. Химические и физические явления2. Признаки протекания
- 3. «Ах сколько нам открытий чудных
- 4. Химические и физические явленияФизические явленияХимический состав молекул
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Признаки протекания химической реакцииПоявление запахаВыделение осадкаВыделение
- 9. Проверь себя!В каком случае произошла химическая реакция?
- 10. Условия протекания химических реакцийЧистота веществ (минимум примесей)Пропорциональность
- 11. 3. Тщательное перемешивание4. Применение катализатора Катализатор -
- 12. Михаил Васильевич Ломоносов
- 13. Суть закона сохранения веществАтомы двух веществ встречаются
- 14. Проверь себя!Сколько атомов каждого элемента потребовалось для
- 15. Для получения сульфида железа смешали 36 г
- 16. Химические уравненияХимическим уравнением называется условная запись химической
- 17. Алгоритм составления химического уравненияВ левой части
- 18. Попробуйте свои силыРасставьте коэффициенты в уравнениях P+O2
- 19. Слайд 19
- 20. ЛЮБОЗНАТЕЛЬНОСТЬ СОЗДАЕТ УЧЕНЫХ И ПОЭТОВ
Слайд 1Физические и химические явления. Химические уравнения
«О сколько нам
открытий
Слайд 2Содержание
1. Химические и физические явления
2. Признаки протекания химических реакций
3. Условия протекания
4. Закон сохранения масс
5. Уравнения химических реакций
Слайд 3«Ах сколько нам открытий чудных готовит просвещенья дух»
Цель :
Формирование представлений об особенностях физических и химических явлений, их отличительных признаках.
Формирование представлений о признаках и условиях протекания химических реакций.
Слайд 4Химические и физические явления
Физические явления
Химический состав молекул не меняется
Кристаллизация
Плавление
Фильтрация
Отстаивание
Перегонка
Химические явления
Химический
Изменяются
физические свойства веществ ( цвет, запах, агрегатное состояние, электропроводность, теплопроводность, упругость, пластичность и т.д.)
Слайд 8Признаки протекания
химической реакции
Появление запаха
Выделение осадка
Выделение газа
Изменение цвета
Выделение тепла
(экзотермическая
Поглощение тепла
(эндотермическая реакция)
Слайд 9Проверь себя!
В каком случае произошла химическая реакция? Почему вы так думаете?
В
Осадок в ведре с водой
В негашеную известь добавили воды
В печке сгорел уголь
Слайд 10Условия протекания химических реакций
Чистота веществ (минимум примесей)
Пропорциональность веществ по массе
S : Fe = 32 : 56 = 4 : 7
Для проведения реакции между серой и
железом надо взять четыре части серы и семь частей железа ( 12г серы и 21г железа)
Задание : В какой пропорциональности надо взять углерод и кислород для протекания химической реакции?
Решение : Ar (O) = 16, Ar (C)= 12,
О : С = 16 : 12 = 4 : 3
Ответ : в отношении 4:3
Слайд 113. Тщательное перемешивание
4. Применение катализатора
Катализатор - Вещества, которые изменяют скорость
5. Площадь соприкосновения реагирующих веществ
Слайд 12 Михаил Васильевич Ломоносов
Создатель многих химических производств в России (неорганических пигментов, глазурей, стекла, фарфора). Изложил в 1741-1750 гг. основы своего атомно-корпускулярного учения, выдвинул кинетическую теорию теплоты. Первым из русских академиков написал учебники по химии и металлургии. Основатель Московского Университета
Антуан Лоран Лавуазье
1743-1794 гг.
Французский химик. Один из основоположников классической химии. Ввел в химию строгие количественные методы исследования. Доказал сложный состав атмосферного воздуха. Правильно объяснив процессы горения и окисления, создал основы кислородной теории. Заложил основы органического анализа.
В 1756 г М.В. Ломоносов открыл закон сохранения масс. Позднее А.Л. Лавуазье подтвердил правильность этого закона
Масса веществ, вступивших в реакцию, равна массе веществ , получившихся в результате её
Антуан Лоран Лавуазье
1743-1794 гг.
Антуан ЛоранЛавуазье
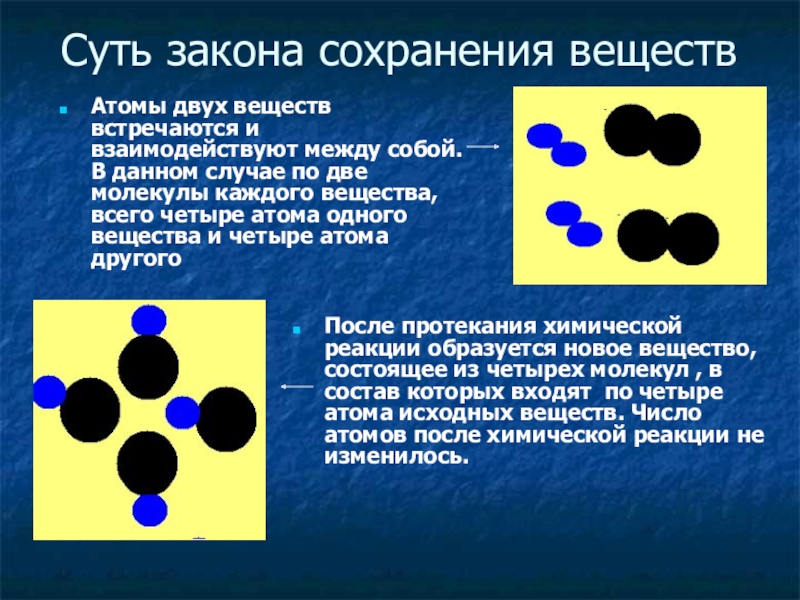
Слайд 13Суть закона сохранения веществ
Атомы двух веществ встречаются и взаимодействуют между собой.
После протекания химической реакции образуется новое вещество, состоящее из четырех молекул , в состав которых входят по четыре атома исходных веществ. Число атомов после химической реакции не изменилось.
Слайд 14Проверь себя!
Сколько атомов каждого элемента потребовалось для получения молекулы оксида алюминия
Молекула оксида алюминия : 2 атома алюминия и 3 атома кислорода
3 атома серы, 6 атомов водорода и 9 атомов кислорода
Слайд 15
Для получения сульфида железа смешали 36 г серы и железо, в
63г железа
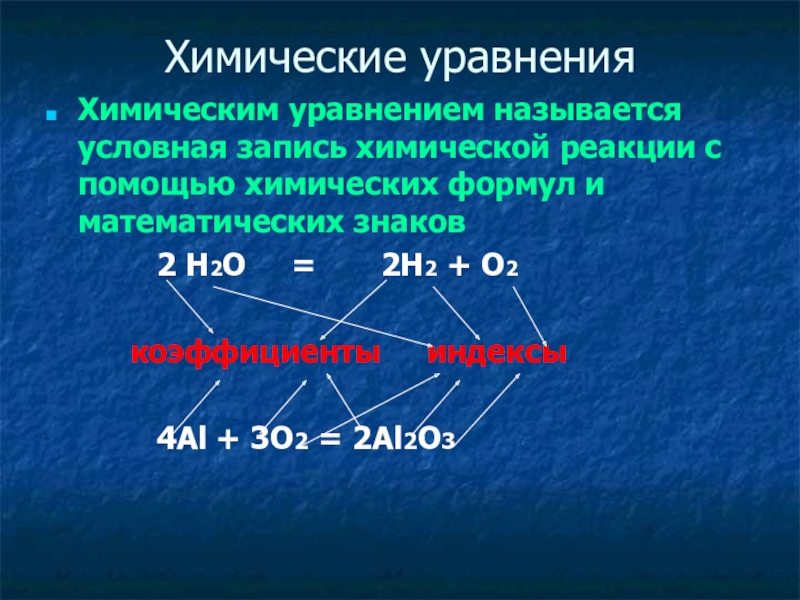
Слайд 16Химические уравнения
Химическим уравнением называется условная запись химической реакции с помощью химических
2 Н2О = 2Н2 + О2
коэффициенты индексы
4Al + 3O2 = 2Al2O3
Слайд 17Алгоритм составления
химического уравнения
В левой части уравнения записывают формулы веществ, вступивших
CuCl2 + Al AlCl3 + Cu
Находим и расставляем коэффициенты к формулам так, чтобы число атомов одинаковых элементов в левой и правой частях уравнения были одинаковы. Заменяем стрелку знаком «=» .
3CuCl2 + 2Al = 2 AlCl3 + 3Cu
Меди : с правой стороны 3 и с левой 3
хлора : 6 и 6
Алюминия: 2 и 2
Слайд 18Попробуйте свои силы
Расставьте коэффициенты в уравнениях
P+O2 P2O5
4P +
Al + H2SO4 Al2(SO4)3 + H2
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
САМОСТОЯТЕЛЬНО
S + O2 SO3
Na + H2O NaOH + H2
MgCO3 + Al Al2(CO3)3 + Mg
Проверь !
2S +3O2 = 2SO3
2Na + 2H2O = 2NaOH + H2
3MgCO3 + 2Al = Al2(CO3)3 + 3Mg