- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии Алюминий. Свойства. Применение.
Содержание
- 1. Презентация к уроку химии Алюминий. Свойства. Применение.
- 2. Цель урока: Изучить особенности алюминия и области
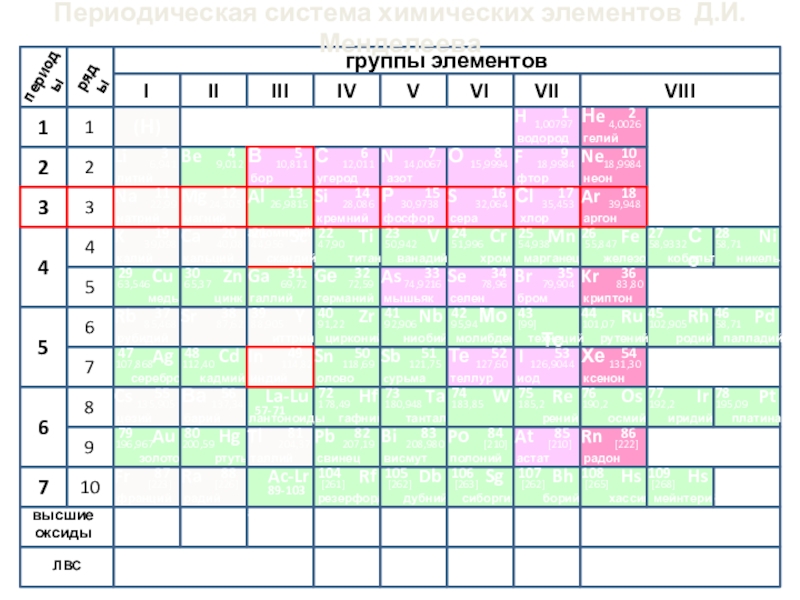
- 3. Периодическая система химических элементов Д.И.Менделеева(Н)
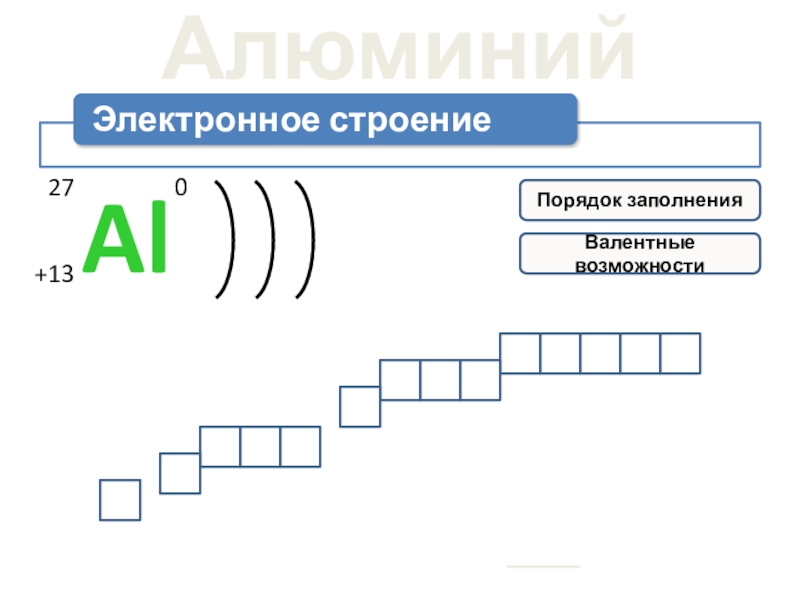
- 4. Алюминий1s2 2s22p6 3s23p13d0Электронная формула:1s2 2s22p6 3s23p1Порядок заполненияВалентные возможности
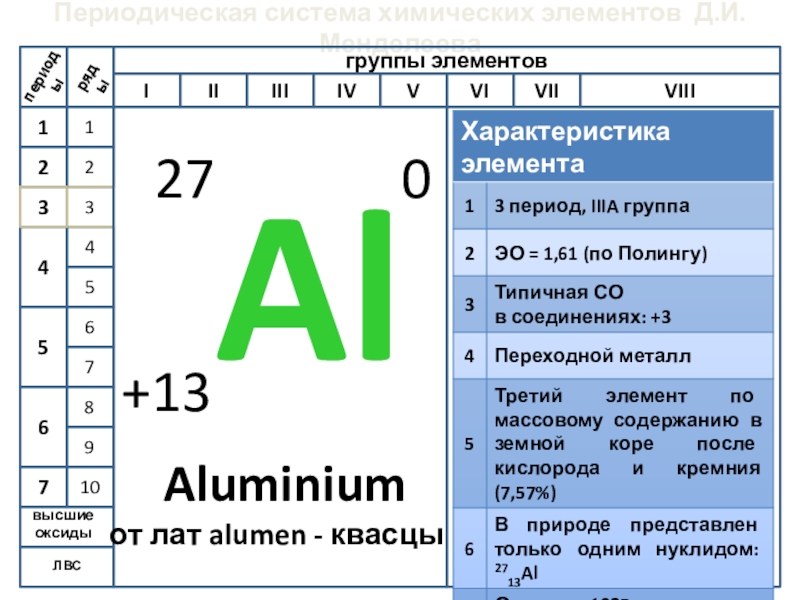
- 5. Периодическая система химических элементов Д.И.МенделееваЛВС Aluminium от лат alumen - квасцы
- 6. Алюминий Заряд ядра атома алюминия Количество
- 7. Природные соединения алюминия
- 8. Природные соединения алюминия
- 9. Природные соединения алюминия
- 10. ПолучениеАлюминий получают электрохимическим методом из бокситов
- 11. Физические свойства cеребристо-белый; пластичный; легкий; температура плавления 6600С; хорошая теплопроводность; высокая электропроводность.Оксидная пленка на поверхности
- 12. Химические свойства взаимодействие с кислородом взаимодействие с
- 13. Химические свойства взаимодействие с растворами щелочей взаимодействие
- 14. Применениесудостроениесамолетостроениестроительствокосмическая техникаавтомобилестроениепроизводство посудыпроизводство аппаратуры для пищевой промышленностихимическое машиностроениепровода для ЛЭПпроизводство упаковочных материаловполучение металлов алюминотермией
- 15. ТестированиеУкажите число протонов в ядре алюминия: а) 13;
- 16. Тестирование7. C какими из указанных веществ
- 17. Тестирование Алюминиевая проволока взаимодействует с водой
Цель урока: Изучить особенности алюминия и области его применения.Задачи:Рассмотреть положение в ПСХЭ, строение свойства ХЭ алюминияИзучить физические и химические свойства простого вещества алюминияОпределить области применения металлаСовершенствовать навыки составления ОВР методом электронного баланса.
Слайд 2Цель урока:
Изучить особенности алюминия и области его применения.
Задачи:
Рассмотреть положение в ПСХЭ,
строение свойства ХЭ алюминия
Изучить физические и химические свойства простого вещества алюминия
Определить области применения металла
Совершенствовать навыки составления ОВР методом электронного баланса.
Изучить физические и химические свойства простого вещества алюминия
Определить области применения металла
Совершенствовать навыки составления ОВР методом электронного баланса.
Слайд 4Алюминий
1s2
2s2
2p6
3s2
3p1
3d0
Электронная формула:
1s2
2s2
2p6
3s2
3p1
Порядок заполнения
Валентные возможности
Слайд 5Периодическая система химических элементов Д.И.Менделеева
ЛВС
Aluminium
от лат alumen - квасцы
Слайд 6Алюминий
Заряд ядра атома алюминия
Количество нейтронов
в ядре атома
алюминия
Количество энергетических уровней атома алюминия
Число валентных электронов атома алюминия
Высшая СО алюминия
Слайд 11Физические свойства
cеребристо-белый;
пластичный;
легкий;
температура плавления 6600С;
хорошая теплопроводность;
высокая электропроводность.
Оксидная пленка на поверхности
Слайд 12Химические свойства
взаимодействие с кислородом
взаимодействие с другими неметаллами
(галогенами, серой,
углеродом, азотом)
взаимодействие с оксидами металлов
взаимодействие с водой
взаимодействие с оксидами металлов
взаимодействие с водой
Слайд 13Химические свойства
взаимодействие с растворами щелочей
взаимодействие с растворами кислот
(концентрированные кислоты
– пассивируют алюминий)
взаимодействие с растворами солей
взаимодействие с растворами солей
Слайд 14Применение
судостроение
самолетостроение
строительство
космическая техника
автомобилестроение
производство посуды
производство аппаратуры для пищевой
промышленности
химическое машиностроение
провода для
ЛЭП
производство упаковочных материалов
получение металлов алюминотермией
производство упаковочных материалов
получение металлов алюминотермией
Слайд 15Тестирование
Укажите число протонов в ядре алюминия:
а) 13;
б) 14; в) 27; г) 3.
2. Какова электронная формула атома алюминия:
а) 2ē;3ē; б) 2ē;5ē; в) 2ē;8ē;3ē; г) 2ē;8ē;8ē;3ē.
3. Сколько протонов содержит ион Al3+:
а) 13; б) 10; в) 27; г)30.
4. Какова электронная формула иона Al3+:
а) 2ē; б) 2ē;8ē; в) 2ē;8ē;6ē; г) 2ē;8ē;3ē.
5. В соединениях для алюминия более характерна степень
окисления, равная:
а) -3; б) -1; в) +1; г) +3.
6. Укажите формулу защитной пленки на поверхности
алюминия:
а) AlN; б) Al(OH)3; в) Al2O3; г) AlCl3.
2. Какова электронная формула атома алюминия:
а) 2ē;3ē; б) 2ē;5ē; в) 2ē;8ē;3ē; г) 2ē;8ē;8ē;3ē.
3. Сколько протонов содержит ион Al3+:
а) 13; б) 10; в) 27; г)30.
4. Какова электронная формула иона Al3+:
а) 2ē; б) 2ē;8ē; в) 2ē;8ē;6ē; г) 2ē;8ē;3ē.
5. В соединениях для алюминия более характерна степень
окисления, равная:
а) -3; б) -1; в) +1; г) +3.
6. Укажите формулу защитной пленки на поверхности
алюминия:
а) AlN; б) Al(OH)3; в) Al2O3; г) AlCl3.
Слайд 16Тестирование
7. C какими из указанных веществ реагирует алюминий:
а) CaO;
б) HCl; в) Cl2; г) KOH.
С какими веществами реагирует алюминий при
обычных условиях:
а) водный раствор гидроксида калия;
б) концентрированная азотная кислота;
в) концентрированная серная кислота;
г) разбавленная серная кислота.
Какую роль играет алюминий в алюминотермических
процессах:
а) восстановителя;
б) окислителя;
в) катализатора;
г) вещества, создающего защитную оксидную пленку.
С какими веществами реагирует алюминий при
обычных условиях:
а) водный раствор гидроксида калия;
б) концентрированная азотная кислота;
в) концентрированная серная кислота;
г) разбавленная серная кислота.
Какую роль играет алюминий в алюминотермических
процессах:
а) восстановителя;
б) окислителя;
в) катализатора;
г) вещества, создающего защитную оксидную пленку.
Слайд 17Тестирование
Алюминиевая проволока взаимодействует с водой
при следующих условиях:
а) только при нагревании;
б) будучи очищенной от оксидной пленки и только при нагревании;
в) будучи очищенной от оксидной пленки и в обычных условиях;
г) если ее сначала выдержать в растворе щелочи, а затем опустить в воду.
а) только при нагревании;
б) будучи очищенной от оксидной пленки и только при нагревании;
в) будучи очищенной от оксидной пленки и в обычных условиях;
г) если ее сначала выдержать в растворе щелочи, а затем опустить в воду.